
С.А. Мазунин, Г.С. Посягин ОСНОВЫ ФИЗИКО-ХИМИЧЕСКОГО АНАЛИЗА Часть 2. 1999г
..pdf
|
|
|
181 |
|
|
|
|
|
(C2H5)2NH2HCO3 |
|
|
|
|
(C2H5)2NH2Cl |
|
|
|
|
|
|
|
|
|
NH4HCO3 |
|
|
|
|
QX |
|
|
|
|
|
0 |
20 |
40 |
60 |
80 |
100 |
|
(C2H5)2NH2Cl |
|
% мас. |
NH HCO |
3 |
||
|
|
|
|
4 |
|
|
Рис. 13. 21. Комбинированная проекция изотермы растворимости системы 10 NH4НСО3 - (С2Н5)2NН2HСl - (С2Н5)2NН2HСO3 - Н2О при 25°С
Как отмечалось выше, в данной пятерной взаимной системе происходят гидролиз гидрокарбонат-ионов и удаление, рассеивание, диссипация из системы углекислого газа. Наличие данного процесса накладывает отпечаток как на изотерму растворимости (диссипационный тип), так и на способ ее исследования и графического представления экспериментальных данных.
Характерной особенностью изотерм растворимости диссипационного типа является отсутствие части экспериментальных данных (точек, линий, частей поверхностей) в оконтуривающих системах меньшей компонентности и во внутренних частях самой изотермы растворимости.
Исследование растворимости в таких системах необходимо проводить в атмосфере газа, удаляющегося из системы. Иначе система превращается в неравновесную со всеми вытекающими из этого факта неприятными последствиями.
Графическое представление экспериментальных данных становится исключительно важным. Возможные примесные солевые компоненты процесса диссипации определяются триангуляцией многокомпонентной системы, образованной всеми ионами, присутствующими в насыщенных растворах. Для изображения таких систем целесообразно использовать комбинированные проекции. Порядок построения комбинированной проекции в немалой степени определяется прикладным значением изучаемой системы. Комбинированная проекция строится таким образом, чтобы на проекции без изменения оставался коэффициент выхода целевого компонента и не искажался тип изотермы растворимости.
Различные части системы могут иметь различную степень полноты диссипационного процесса. Например, для данной пятерной взаимной системы при ис-
182
следовании пятерных систем NaCl - (C2H5)2NH2Cl - NH4Cl - NaHCO3 - H2O (1) и NaHCO3 - NH4HCO3 - NH4Cl - (C2H5)2NH2Cl - H2O (2), образующиеся в результате проведения опытов, насыщенные растворы находились в шестерных системах:
NaHCO3 - NaCl - NH4Cl - (C2H5)2NH2Cl - Na2CO3 - H2O;
NaHCO3 - NH4Cl - NH4HCO3 - (C2H5)2NH2Cl - [(C2H5)2NH2]2CO3 - H2O, со-
держащих только один карбонат (натрия или диэтиламмония). Эти системы находятся в "поверхностной", "слабой" диссипационной части системы.
Пятерная система NaHCO3 - NH4HCO3 - (C2H5)2NH2Cl - (C2H5)2NH2HCO3 - H2O может быть отнесена к "глубокой" диссипационной части, так как образующиеся в результате проведения опытов насыщенные растворы находились в шестерных системах:
NaHCO3 - NH4Cl - (C2H5)2NH2Cl - [(C2H5)2NH2]2CO3- Na2CO3 - H2O; NaHCO3 - NH4Cl - NH4HCO3 - (NH4)2CO3 - [(C2H5)2NH2]2CO3 - H2O;
NaHCO3 - NH4Cl - (NH4)2CO3 - [(C2H5)2NH2]2CO3 - Na2CO3 - H2O, содержащих два или три карбоната натрия, диэтиламмония и аммония.
Кроме того, при более высоких температурах могла бы происходить и "полная" диссипация данной системы при переходе в газообразную фазу диэтиламина вместе с диоксидом углерода.
Ближайшим математическим аналогом диссипационных систем является класс некорректных задач, решение которых зависит от графического представления исходных данных, от способа решения задачи и т.д. С этой точки зрения диссипационные системы можно назвать и "некорректными". Но нам кажется, что класс некорректных систем шире и к нему кроме диссипационных можно было бы отнести и неравновесные системы.
13. 7. Использование результатов исследования растворимости в пятерной взаимной системе Na+, NH4+, (C2H5)2NH2+ //HCO3-, Cl- – H2O для технологических прогнозов
Полученные нами экспериментальные данные о растворимости в данной пятерной взаимной системе позволяют выбрать наиболее перспективные с технологической точки зрения способы синтеза гидрокарбоната натрия из хлорида натрия, аммиака, диэтиламина и диоксида углерода.
Наиболее простые варианты - использование для синтеза чистых диэтиламина или аммиака - обсуждались выше, в разделах 11 и 12. Исследование пятерной взаимной водно-солевой системы позволяет проанализировать возможность проведения комбинированного варианта синтеза - использование для получения гидрокарбоната натрия смеси аммиака и диэтиламина любого состава, определить оптимальный состав такой смеси. Кроме того, данное исследование позволяет определить оптимальные составы реакционных смесей при поэтапном переходе с аммиачной технологии производства сода на аминную или аминоаммиачную.
13. 7. 1. Максимальные равновесные коэффициенты использования ионовNa+, NH4+, (C2H5)2NH2+ при синтезе гидрокарбоната натрия из кристаллического
183
хлорида натрия, насыщенного раствора хлорида натрия, аммиака, диэтиламина и диоксида углерода
Растворимость в пятерной системе (C2H5)2NH2Cl - NаСl - NH4Cl - NаНСО3 - Н2О моделирует процесс получения гидрокарбоната натрия из хлорида натрия, воды, аминоаммиачной смеси и диоксида углерода в условиях избытка хлорида натрия. Составы растворов данной системы, насыщенных относительно гидрокарбоната натрия, и коэффициенты использования ионов натрия, аммония и диэтиламмония этих растворов приведены в табл. 13. 19.
В случае, когда в составе насыщенного раствора отсутствовали ионы диэтиламмония, коэффициент использования ионов аммония вычисляли по формуле Федотьева:
UNH4+ = |
100 |
([NH4 |
+ ]− |
[П.Т.]) |
|
|||
|
|
|
|
|
|
. |
(13. 13) |
|
|
|
|
+ |
] |
|
|||
|
|
|
[NH4 |
|
|
|
||
Таблица 13. 19 Составы насыщенных растворов относительно гидрокарбоната натрия в системе NаСl - NH4Cl - NаНСО3 - (C2H5)2NH2Cl - Н2О при 25°С, коэффициенты использо-
вания ионов Na+, NH4+ и (C2H5)2NH2+ этих растворов
|
Состав насыщенного раствора, % мас. |
|
|
|
|||||
№ |
|
|
|
|
|
|
UNa+, |
Uam+, |
Твердая |
NaCl |
NH4 |
Et2NH2 |
Na |
(Et2NH2)2 |
H2O |
||||
п/п |
|
Cl |
Cl |
HCO3 |
CO3 |
|
% |
% |
фаза |
|
|
|
|
|
|
||||
|
- |
- |
68.6 |
0.5 |
0.0 |
30.9 |
99.1 |
99.0 |
NаНСО3+Et2NH2Cl |
- |
3.3 |
65.4 |
0.5 |
0.1 |
30.7 |
99.1 |
99.0 |
NаНСО3+NН4С1+Et2NH2Cl |
|
0.4 |
- |
68.4 |
0.04 |
0.0 |
31.16 |
98.8 |
99.9 |
NaCl+NаНСО3+Et2NHCl |
|
0.3 |
3.4 |
65.7 |
0.04 |
0.0 |
30.56 |
99.2 |
99.9 |
NaHCO3+NaCl+NH4Cl+ |
|
|
|
|
|
|
|
|
|
|
Et2NH2Cl |
0.8 |
4.7 |
56 |
0.4 |
0.3 |
37.8 |
97.0 |
98.7 |
NaHCO3+NaCl+NH4Cl |
|
1.3 |
5.9 |
50.5 |
0.4 |
0.1 |
41.8 |
95.5 |
99.0 |
-"- |
|
4 |
8.5 |
37.3 |
0.6 |
0.1 |
49.5 |
86.7 |
98.4 |
-"- |
|
6.4 |
10.5 |
27.9 |
0.5 |
0.4 |
54.3 |
79.4 |
97.8 |
-"- |
|
8.8 |
12.6 |
19.2 |
0.8 |
0.1 |
58.5 |
71.5 |
97.5 |
-"- |
|
12.6 14.2 |
9.5 |
0.4 |
0.9 |
62.4 |
61.2 |
96.3 |
-"- |
||
В случае, когда в составе насыщенного раствора отсутствовали ионы аммония, коэффициент использования ионов диэтиламмония вычисляли по аналогичной формуле
U DEA = |
100 ([(C2 H |
5 )NH 2 |
+ ] − [П.Т.]) . |
(13. 14) |
||
[(C2 |
|
+ |
] |
|
||
|
H5 )NH 2 |
|
|
|||
В случае, когда в составе насыщенного раствора присутствовали и ионы аммония, и ионы диэтиламмония, вычисляли суммарный коэффициент использования этих ионов по формуле:
184
|
100 |
([(C H |
5 |
)NH |
+ ] +[NH + ] −[П.Т.]) |
. |
|
|||
U Am+ = |
|
|
2 |
2 |
|
4 |
|
(13. 15) |
||
|
|
|
|
|
+ |
+ |
] |
|
||
|
|
|
[(C2 H5 )NH2 |
] +[NH4 |
|
|
||||
В формулах 13.13 - 13.15 прямой титр растворов обозначен как [П.Т.].
Анализ данных, приведенных в табл. 13.19, показывает, что наибольшие коэффициенты использования ионов натрия, аммония и диэтиламмония имеют двойной эвтонический раствор, насыщенный относительно хлорида диэтиламмония и гидрокарбоната натрия, а также четверной эвтонический раствор, насыщенный относительно хлоридов натрия, аммония, диэтиламмония и гидрокарбоната натрия. Наиболее технологичным, конечно, является способ, при котором для синтеза гидрокарбоната натрия используется эквимолярная смесь хлорида натрия и чистого диэтиламина.
Растворимость в пятерной системе (C2H5)2NH2Cl - NH4HСO3 - NH4Cl - NаНСО3 - Н2О моделирует процесс получения гидрокарбоната натрия из хлорида натрия, воды, аминоаммиачной смеси и диоксида углерода при недостатке диэтиламина и избытке аммиака по отношению к хлориду натрия. Составы растворов данной системы, насыщенных относительно гидрокарбоната натрия, и коэффициенты использования ионов натрия, аммония и диэтиламмония этих растворов приведены в табл. 13. 20.
Таблица 13. 20 Составы насыщенных растворов относительно гидрокарбоната натрия в системе
NH4HСO3 - NH4Cl - NаНСО3 - (C2H5)2NH2Cl - Н2О при 25°С, коэффициенты ис-
пользования ионов Na+, NH4+ и (C2H5)2NH2+ этих растворов
№ |
Состав насыщенного раствора, % мас. |
U + |
U |
+ |
|
|||||
|
|
|
|
|
|
|
Na , |
Am , |
|
|
п/п |
Et2NH2 |
NH4Cl |
NH4 |
Na |
(Et2NH2)2 |
H2O |
% |
% |
|
Твердая фаза |
|
Cl |
|
HCO3 |
HCO3 |
CO3 |
|
|
|
|
|
|
68.6 |
- |
- |
0.5 |
0.0 |
30.9 |
99.1 |
99.0 |
NаНСО3+Et2NH2Cl |
|
65.4 |
3.3 |
0.0 |
0.5 |
0.1 |
30.7 |
99.1 |
99.0 |
NaHCO3+NH4Cl+Et2NH2Cl |
||
64.0 |
1.4 |
3.3 |
0.1 |
2.6 |
28.6 |
99.8 |
90.0 |
NaHCO3 + NH4HCO3 + Et2NH2Cl |
||
63.9 |
2.1 |
3.1 |
0.1 |
1.8 |
29.0 |
99.8 |
91.5 |
NH4HCO3+NaHCO+ |
||
|
|
|
|
|
|
|
|
|
|
NH4Cl+Et2NH2Cl |
48.4 |
6.2 |
2.0 |
0.4 |
2.1 |
40.9 |
99.1 |
91.7 |
NH4HCO3+NaHCO3 +NH4Cl |
||
33.2 |
11.3 |
0.8 |
1.3 |
3.4 |
50.0 |
97.0 |
89.5 |
-"- |
||
30.2 |
12.6 |
0.0 |
1.6 |
4.2 |
51.4 |
96.3 |
89.2 |
-"- |
||
14.4 |
19.2 |
0.5 |
3.9 |
2.5 |
59.5 |
90.5 |
85.3 |
-"- |
||
Данные, приведенные в табл. 13. 20, показывают, что максимальный коэффициент использования ионов натрия наблюдается в тройном эвтоническом растворе, насыщенном относительно гидрокарбоната натрия, гидрокарбоната аммония и хлорида диэтиламмония, а также в четверном эвтоническом растворе, насыщенном относительно всех солевых компонентов данной пятерной системы. Появление в составе тройного эвтонического раствора хлорида аммония обусловлено протеканием в системе процесса декарбонизации.
185
Растворимость в пятерной системе (C2H5)2NH2HCO3 - (C2H5)2NH2Cl - NH4HСO3 - NаНСО3 - Н2О моделирует процесс получения гидрокарбоната натрия из хлорида натрия, воды, аминоаммиачной смеси и диоксида углерода при избытке аммиака и диэтиламина по отношению к хлориду натрия. Составы растворов данной системы, насыщенных относительно гидрокарбоната натрия, и коэффициенты использования ионов натрия, аммония и диэтиламмония этих растворов приведены в табл. 13. 21.
Таблица 13. 21 Составы насыщенных растворов относительно гидрокарбоната натрия в системе
NH4HСO3 - (C2H5)2NH2НСО3 - NаНСО3 - (C2H5)2NH2Cl - Н2О при 25°С, коэффици-
енты использования ионов Na+, NH4+ и (C2H5)2NH2+ этих растворов
№ |
Состав насыщенного раствора, % мас. |
UNa+, |
UAm+, |
Твердая |
||||||
п/п |
Et2NH2 |
Na |
NH4 |
Et2NН2 |
NH4 |
[Et2NH2]2 |
H2O |
фаза |
||
|
Cl |
HCO3 |
HCO3 |
НСО3 |
Cl |
CO3 |
|
% |
% |
|
|
|
|
|
|
|
|
|
|
||
1 |
69.0 |
0.5 |
- |
- |
- |
0.0 |
30.5 |
99.1 |
99.1 |
NaHCO3+ Et2NH2Cl |
2 |
48.09 |
0.06 |
- |
23.67 |
- |
4.48 |
23.70 |
99.8 |
66.7 |
Et2NH2HCO3+NaHCO3+ |
|
|
|
|
|
|
|
|
|
|
Et2NH2Cl |
3 |
64.0 |
0.1 |
3.3 |
- |
1.4 |
2.6 |
28.6 |
99.8 |
90.0 |
NH4HCO3 +NaHCO3+ |
|
|
|
|
|
|
|
|
|
|
Et2NH2Cl |
Как отмечалось выше, в данной пятерной системе процесс декарбонизации протекает настолько сильно, что нам не удалось определить состав четверного эвтонического раствора и исследовать линии тройного насыщения. Однако данные, приведенные в табл. 13. 21, позволяют сравнить два возможных способа синтеза гидрокарбоната натрия из кристаллического хлорида натрия, насыщенного раствора хлорида натрия, диоксида углерода и избытка, в первом случае диэтиламина, а во втором - аммиака.
Избыток диэтиламина берется такой, чтобы в результате реакции получился тройной эвтонический раствор насыщенный относительно гидрокарбоната натрия, гидрокарбоната диэтиламмония и хлорида диэтиламмония. Во втором случае диэтиламин прибавляется эквимолярно хлориду натрия, а избыток аммиака должен быть таким, чтобы образующийся раствор был насыщен относительно гидрокарбоната натрия, гидрокарбоната аммония и хлорида диэтиламмония.
Второй способ ведения синтеза предпочтительнее первого по суммарному коэффициенту использования ионов аммония и диэтиламмония. Но, как нам кажется, оба этих способа все же уступают наиболее простому и технологичному - синтезу гидрокарбоната натрия при добавлении эквимолярного хлориду натрия количества чистого диэтиламина (коэффициент использования ионов натрия в этом способе ниже на 0.7 %, зато коэффициент использования ионов диэтиламмония выше на 9 %).
186
13. 7. 2. Максимальные равновесные коэффициенты использования ионов Na+, NH4+, (C2H5)2NH2+ при синтезе гидрокарбоната натрия из насыщенного раствора хлорида натрия, аммиака, диэтиламина и диоксида углерода
Синтез гидрокарбоната натрия из насыщенного раствора хлорида натрия (305 г/л) аммиачным методом подробно рассмотрен выше, в разделе 12. 5. В результате проведения синтеза аммиачным методом в равновесных условиях образуется двояконасыщенный раствор относительно гидрокарбоната натрия и гидрокарбоната аммония. Коэффициент использования ионов натрия при 25°С в этом растворе равен 80.8%, а коэффициент использования ионов аммония - 76.3% ( см.
табл. 12. 7).
Различных вариантов синтеза гидрокарбоната натрия аминоаммиачным способом гораздо больше.
При синтезе гидрокарбоната натрия из насыщенного раствора хлорида натрия (305 г/л) в условиях избытка хлорида натрия и различных соотношений диэтиламина и аммиака в равновесных условиях будут получаться растворы, находящиеся в пятерной системе NаСl - NH4Cl - NаНСО3 - (C2H5)2NH2Cl - Н2О. Наиболее интересные составы таких растворов приведены в табл. 13. 22 совместно с коэффициентам использования ионов натрия и суммарным коэффициентом использования ионов диэтиламмония и аммония.
Таблица 13. 22 Вычисленные составы насыщенных относительно гидрокарбоната натрия растворов при 25°С, получающихся из концентрированного раствора хлорида натрия (305 г/л), в системе NаСl - NH4Cl - NаНСО3 - (C2H5)2NH2Cl - Н2О, коэффициенты
использования ионов натрия, аммония и диэтиламмония этих растворов
№ |
|
Состав насыщенного раствора, % мас. |
|
Твердая |
UNa+, |
UAm+, |
|||
NaCl |
NH4Cl |
Et2NH2 |
NaHCO3 |
(Et2NH2)2 |
H2O |
||||
п/п |
|
|
Cl |
|
CO3 |
|
фаза |
% |
% |
|
|
|
|
|
|
|
|
||
|
3.9 |
0.0 |
35.0 |
1.2 |
0.0 |
59.9 |
NaHCO3 |
79.0 |
95.5 |
0.1 |
0.0 |
40.7 |
2.1 |
0.2 |
56.9 |
-"- |
92.8 |
92.8 |
|
0.3 |
4.8 |
32.4 |
2.6 |
0.5 |
59.4 |
-"- |
90.8 |
90.8 |
|
0.5 |
7.3 |
27.7 |
2.9 |
1.0 |
60.6 |
-"- |
89.2 |
88.9 |
|
1.0 |
11.1 |
20.5 |
2.6 |
1.9 |
62.9 |
-"- |
88.3 |
88.1 |
|
1.8 |
15.6 |
11.4 |
2.9 |
3.2 |
65.1 |
-"- |
84.7 |
84.7 |
|
2.1 |
18.8 |
5.1 |
3.6 |
3.8 |
66.6 |
-"- |
81.8 |
81.7 |
|
Состав № 2 образуется при использовании для синтеза чистого диэтиламина. Это наиболее простой способ синтеза, детально исследованный и с физикохимической, и с технологической точек зрения. Он может служить своеобразным эталоном для других способов.
Состав № 1 образуется при небольшом избытке хлорида натрия (раствор, 305 г/л) по отношению к чистому диэтиламину. Такое ведение процесса приводит к резкому уменьшению равновесного коэффициента использования ионов натрия и незначительному увеличению коэффициента использования ионов диэтиламмония.
187
Составы № 3-7 образуются при эквимолярных соотношениях хлорида натрия и аминоаммиачной смеси различного состава. Нетрудно заметить, что оба коэффициента уменьшаются по мере увеличения содержания в растворах хлорида аммония.
При получении гидрокарбоната натрия из концентрированного раствора хлорида натрия (305 г/л) в условиях избытка аммиака и эквимолярных соотношений диэтиламина и хлорида натрия в равновесных условиях должны получаться растворы, находящиеся в четверной системе NH4HCO3 - NаНСО3 - (C2H5)2NH2Cl - Н2О, однако из-за процесса декарбонизации они оказываются в пятерной системе NH4HCO3 - NH4Cl - NаНСО3 - (C2H5)2NH2Cl - Н2О. Наиболее интересные составы таких растворов приведены в табл. 13. 23 совместно с коэффициентам использования ионов натрия и суммарным коэффициентом использования ионов диэтиламмония и аммония (UAm+).
Таблица 13. 23 Вычисленные составы насыщенных относительно гидрокарбоната натрия растворов при 25°С, получающихся из концентрированного раствора хлорида натрия
(305 г/л), в системе NH4HCO3 - NH4Cl - NаНСО3 - (C2H5)2NH2Cl - Н2О, коэффици-
енты использования ионов натрия, аммония и диэтиламмония этих растворов
№ |
|
Состав насыщенного раствора, % мас. |
|
Твердая |
UNa+, |
UAm+, |
|||
Et2NH2 |
NH4Cl |
NH4HCO3 |
NaHCO3 |
(Et2NH2)2 |
H2O |
||||
п/п |
Cl |
|
|
|
CO3 |
|
фаза |
% |
% |
|
|
|
|
|
|
|
|
||
1 |
35.2 |
1.8 |
6.4 |
0.8 |
3.5 |
52.3 |
NH4HCO3+ |
97.3 |
73.6 |
|
|
|
|
|
|
|
NaHCO3 |
|
|
2 |
37.8 |
1.0 |
3.8 |
0.8 |
2.5 |
54.1 |
NaHCO3 |
97.4 |
81.3 |
3 |
40.7 |
0.2 |
3.0 |
1.1 |
0.8 |
54.2 |
NaHCO3 |
96.5 |
86.0 |
Состав № 1 образуется при наибольшем избытке аммиака, он является двояконасыщенным относительно гидрокарбонатов натрия и аммония. Составы растворов № 2 и 3 насыщены только относительно гидрокарбоната натрия. Причем параметры раствора № 2 превосходят таковые раствора № 1. Следовательно, составы раствора № 2 и 3 находятся в пределах оптимального избытка аммиака при эквимолярном соотношении хлорида натрия и диэтиламина.
Коэффициенты использования ионов натрия растворов № 2 и 3 достаточно сильно превосходит таковой при получении гидрокарбоната натрия из концентрированного раствора хлорида натрия и эквимолярного количества чистого диэтиламина. Оба этих раствора могут быть рекомендованы для практического использования.
В табл. 13. 24 приведен состав двояконасыщенного раствора относительно гидрокарбонатов натрия и диэтиламмония, аналогичный раствору № 1 табл. 13. 23. Несмотря на высокий коэффициент использования ионов натрия, этот раствор не может быть рекомендован для практического использования из-за низкого коэффициента использования ионов диэтиламмония и высоких потерь диэтиламина из-за испарения.
Таблица 13. 24
188
Вычисленный состав насыщенного раствора относительно гидрокарбоната натрия и гидрокарбоната диэтиламмония при 25°С, получающегося из концентрированного раствора хлорида натрия (305 г/л), в системе (C2H5)2NH2HCO3 -(C2H5)2NH2Cl - NаНСО3 - Н2О, коэффициенты использования ионов натрия, аммония и диэтиламмония этого раствора
Состав насыщенного раствора , % мас. |
Твердая |
UNa+, |
UAm+, |
||||
Et2NH2 |
NaHCO3 |
Et2NH2H |
(Et2NH2)2 |
H2O |
|||
Cl |
|
CO3 |
CO3 |
|
фаза |
% |
% |
25.63 |
0.05 |
40.32 |
4.12 |
29.88 |
Et2NH2HCO3+NaHCO3 |
99.7 |
40.8 |
14. ИССЛЕДОВАНИЕ РАСТВОРИМОСТИ В ПЯТЕРНОЙ ВЗАИМНОЙ СИСТЕМЕ (C2H5)3NH+, NH4+ // HPO42-, H2PO4-, Cl- – H2O ПРИ 20 И 60°С
Примерами реальной диаграммы растворимости пятерной взаимной водносолевой системы с весьма редко встречающимся при невысоких температурах и атмосферном давлении явлением расслаивания могут служить изотермы раство-
римости системы (C2H5)3NH+, NH4+ // HPO42-, H2PO4-, Cl- – H2O при 20 и 60°С.
Кроме того, данная диаграмма растворимости лежит в основе способа получения фосфатов аммония из хлорида аммония, фосфорной кислоты и триэтиламина методом высаливания.
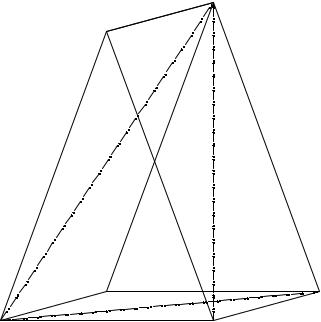
14. 1. Триангуляция пятерной взаимной системы
При синтезе дигидрофосфата- и гидрофосфата аммония из хлорида аммония, фосфорной кислоты и триэтиламина получающиеся в результате реакции соли в идеале образуют следующую пятерную взаимную систему: (C2H5)3NH+, NH4+ // HPO42-, H2PO4-, Cl- – H2O. Эта система триангулируется при 20 и 60°С на три простые пятерные системы (см. рис. 14. 1):
1.NH4Cl - NH4H2PO4 - (NH4)2HPO4 - (C2H5)3NHCl - H2O;
2.(C2H5)3NHH2PO4 - NH4H2PO4 - (NH4)2HPO4 - (C2H5)3NHCl - H2O;
3.(C2H5)3NHH2PO4 - [(C2H5)3NH]2HPO4 - (NH4)2HPO4 - (C2H5)3NHCl - H2O.
Первая простая пятерная система не содержит избытка фосфатов триэти-
ламина и имеет большое прикладное значение для вычисления оптимальных концентрационных условий получения фосфатов аммония (как смеси любого состава, так и чистых солей).
Вторая и третья пятерные системы содержат избыток фосфатов триэтиламина, что будет приводить к неоправданной потере фосфора при регенерации триэтиламина. Эти системы не могут быть рекомендованы для разработки технологии получения фосфатов аммония из хлорида аммония, фосфорной кислоты и триэтиламина.
Триангуляция данной пятерной взаимной системы не может быть осуществлена расчетом произведения растворимости взаимных пар солей, так как при 60°С фосфаты триэтиламина не существуют в кристаллическом состоянии и их растворимость не известна. Стабильные солевые пары в оконтуривающих четверных взаимных системах определены экспериментально.
189
Четверные взаимные системы (C2H5)3NH+, NH4+ // H2PO4-, Cl- – H2O и NH4+, (C2H5)3NH+ // HPO42-, Cl- – H2O при 20 и 60°С имеют стабильные диагонали: трой-
ные системы NH4H2PO4 - (C2H5)3NHCl - H2O и (NH4)2HPO4 - (C2H5)3NHCl - H2O
соответственно; пятерная взаимная система имеет стабильный диагональный раз-
рез: четверную систему NH4H2PO4 - (NH4)2HPO4 - (C2H5)3NHCl - H2O. Раствори-
мость в этой системе при 20 и 60°С описана выше, в разделе 6.
Четверная взаимная система (C2H5)3NH+, NH4+ // HPO42-, H2PO4- – H2O при 20 и 60°С не имеет стабильной диагонали, стабильную пару солей образуют гидрофосфат аммония и дигидрофосфат триэтиламина. В связи с этим фактом в пятерной взаимной системе отсутствует второй стабильный диагональный разрез.
 Et3NHCl
Et3NHCl
NH4Cl
(Et3NH)2HPO4 Et3NHH2PO4
(NH4)2HPO4 NH4H2PO4
Рис. 14. 1. Солевая призма пятерной взаимной системы
(C2H5)3NH+, NH4+ // HPO42-, H2PO4-, Cl- – H2O
14. 2. Методика изучения растворимости
Поскольку в процессе насыщения исходных смесей, содержащих гидрофосфат аммония, при 60°С наблюдался гидролиз этой соли, в результате которого в насыщенных растворах появлялся дигидрофосфат аммония (особенно сильно появление дигидрофосфата аммония сказывалось при исследованиях монотектических равновесий, что приводило к резкому снижению содержания воды в нижней жидкой фазе и нарушало закономерный ход нод в монотектической области), опыты производили в термостатируемой плоскодонной колбе, снабженной магнитной мешалкой и специальной насадкой, позволяющей соединить ее с другой колбой и обратным холодильником. Во вторую колбу помещали раствор аммиака, испарение которого и предотвращало гидролиз в реакционном сосуде.
Установление равновесия определяли по постоянству трех измерений показателя преломления насыщенного раствора, производимых через 30 минут. Из-
190
мерения начинали производить после трех часов от начала опыта. После установления равновесия перемешивание прекращали, давали раствору расслоиться, отстояться до полного осветления обеих жидких фаз и отбирали стеклянными шприцами образцы жидких фаз на анализ в мерные колбы с дистиллированной водой.
С целью уменьшения затрат времени на определение составов эвтонических растворов, линий моновариантных равновесий на изотермах четверной взаимной системы проводили планирование эксперимента.
При вычислениях составов исследуемых жидких фаз использовали уравнение ионного баланса для определения содержания ионов триэтиламмония.
14. 3. Пятерная система NH4Cl - NH4H2PO4 - (NH4)2HPO4 - (C2H5)3NHCl - H2O
Данная пятерная система имеет следующие оконтуривающие четверные системы:
NH4H2PO4 - (NH4)2HPO4 - (C2H5)3NHCl - H2O; NH4Cl - NH4H2PO4 - (C2H5)3NHCl - H2O; NH4Cl - (NH4)2HPO4 - (C2H5)3NHCl - H2O; NH4Cl - NH4H2PO4 - (NH4)2HPO4 - H2O.
Система 1, представляющая собой стабильный диагональный разрез пятерной взаимной системы, описана выше (см. разд. 6). Изотермы растворимости остальных систем изучались экспериментально.
14. 4. Система NH4Cl - NH4H2PO4 - (C2H5)3NHCl - H2O (2)
Изотерма растворимости тройной оконтуривающей системы NH4H2PO4 - (C2H5)3NHCl - H2O описана выше (см. п. 6. 1, 6. 3). Растворимость в системах
NH4Cl - NH4H2PO4 - H2O и (C2H5)3NHCl - NH4Cl - H2O при 20°С описана в литера-
туре. Экспериментальные данные о растворимости в остальных тройных оконтуривающих системах при 60°С сведены в табл. 14. 1.
Данные о растворимости в четверной системе NH4H2PO4 - (C2H5)3NHCl - NH4Cl - H2O при 20°С сведены в табл. 14. 2 и изображены на рис. 14. 2 в виде перспективной проекции на солевое основание тетраэдра состава.
Данные о растворимости в системе NH4H2PO4 - NH4Cl - (C2H5)3NHCl - H2O при 60°С сведены в табл. 14. 3 и изображены на рис. 14. 3 в виде перспективной проекции на солевое основание тетраэдра состава.
Обе изотермы растворимости системы NH4H2PO4 - NH4Cl - (C2H5)3NHCl - H2O при 20 и 60°С имеют простой эвтонический тип с явлением высаливания дигидрофосфата аммония.
Таблица 14. 1
Растворимость в системах NH4H2PO4 - NH4Cl - H2O и (C2H5)3NHCl - NH4Cl - H2O при 60°С
Состав насыщенного раствора, % мас. |
|
Твердая фаза |
|||
NH4H2PO4 |
NH4Cl |
(C2H5)3NHCl |
H2O |
|
|
|
|
Система NH4H2PO4 - NH4Cl - H2O |
|
||
