
С.А. Мазунин, Г.С. Посягин ОСНОВЫ ФИЗИКО-ХИМИЧЕСКОГО АНАЛИЗА Часть 2. 1999г
..pdf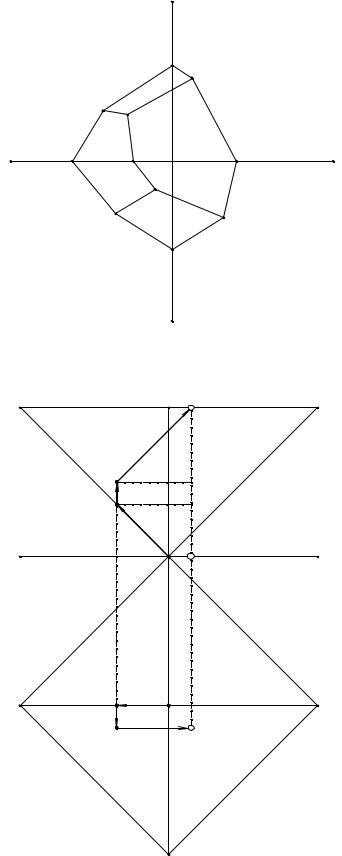
71
BY
|
|
R3 |
|
|
|
e34 |
|
|
e23 |
|
|
|
E2 |
|
|
BX |
e24 |
H2O(A) |
AY |
R2 |
|
||
|
|
R4 |
E1 |
e12
e14
R1
AX
Рис. 7. 2. Принципиальная схема ортогональной проекции изотермической диаграммы растворимости четверной взаимной водно-солевой системы
AX(BY) M' |
AY |
|
BX |
|
|
c |
c |
|
Q' |
b |
|
b |
P' |
|
a Вертикальная проекция |
a |
A |
|
|
M |
|
|
|
BY
BX |
P |
|
Q b |
||
|
a |
A |
AY |
|
|
c |
M |
|
Горизонтальная
проекция
AX
Рис. 7. 3. Геометрическое построение горизонтальной и вертикальной проекций изотермической диаграммы растворимости четверной взаимной системы
72
Существуют два способа построения и чтения составов на плоских проекциях пространственной диаграммы: геометрический и аналитический.
Геометрический метод построения фигуративной точки раствора заданного состава M заключается в том, что находят горизонтальную проекцию этой точки. Для этого откладывают от вершины пирамиды по направлению соответствующих ребер (в масштабе) отрезки, пропорциональные количеству солей раствора (см. рис. 7. 3).
Например, дан состав раствора: а молей соли BX, b молей соли AX и с молей соли AY (на 1000 молей воды). Для построения фигуративной точки раствора на горизонтальной проекции от точки А пересечение диагоналей по направлению к BX откладывают в определенном масштабе отрезок (AP), равный а, от конца Р которого параллельно диагонали А - AX откладывают отрезок (PQ), равный b; от конца Q последнего откладывают по прямой, параллельной А - AY, отрезок (QM), равный с.
Полученная таким образом точка M и будет фигуративной точкой, изображающей солевой состав системы. Положение точки M определяется однозначно и не зависит ни от последовательности отрезков, ни от принятой комбинации солей системы.
Построение фигуративной точки M' на вертикальной проекции производят аналогичным образом, откладывая в том же масштабе отрезки a, b и с вверх по проектирующему перпендикуляру из точки M горизонтальной проекции.
Вертикальная координата проекции фигуративной точки равна сумме количеств соли. По координатам фигуративной точки можно определить состав раствора.
Пусть состав раствора, содержащего соли BX, AX и AY, обозначен точкой M. Ордината точки M (b) указывает определенное содержание соли AX, которая может быть отсчитана непосредственно по графику. Абсцисса точки M (с-а) указывает лишь разность концентраций двух солей AY и BX, величина которой может оставаться постоянной при множестве различных значений концентраций.
На вертикальной проекции координата фигуративной точки M' указывает сумму концентраций всех трех солей. Постоянная сумма концентраций солей определяет содержание солей AY и BX при заданной их разности (с-а).
Таким образом, лишь совместное наличие горизонтальной и вертикальной проекций дает однозначное определение состава раствора, отвечающего заданной фигуративной точке, и позволяет производить расчеты при испарении и охлаждении растворов.
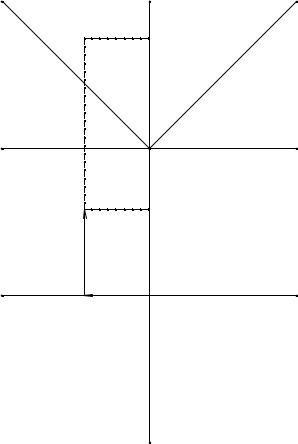
Аналитический метод построения фигуративной точки раствора заданного состава M заключается в том, что в начале вычисляются координаты точек на вертикальной и горизонтальной проекции M'(x, y, z); M(x, y) и по ним непосредственно строятся точки M и M' на обеих проекциях (см. рис. 7. 4).
Обозначим через [AY], [AX], [BX], [BY] содержание в растворе соответствующих солей в молях, а через [B+], [A+], [X-], [Y-] - содержание соответствующих ионов, выраженное в грамм-эквивалентах на 1000 молей воды.
|
|
73 |
|
BX |
|
AX(BY) |
AY |
|
|
||
|
M' |
c |
|
|
|
|
|
|
z |
|
|
|
A |
Вертикальная проекция |
a |
x |
BY |
|
M |
b |
|
|
|
y |
|
|
BX |
A |
AY |
|
x |
|||
a |
|
Горизонтальная проекция
AX
Рис. 7. 4. Схема аналитического построения фигуративной точки М на диаграмме в двух проекциях
Из точки А пересечения диагоналей откладываем по оси х отрезок, пропорциональный содержанию соли BX. Координата х в данном случае будет определенной (независимой) и равной разности концентраций солей [AY] - [BX]. На оси у отложим отрезок, равный разности концентрации солей [BY] - [AX], которая остается постоянной при множестве значений концентраций. В результате построения определим положение фигуративной точки M, отвечающий составу заданной системы в горизонтальной проекции.
На вертикальной проекции, для определения положения указанной фигуративной точки M', по ординате откладывается сумма концентраций солей [BX] + +[BY] + [AX] + [AY], а по оси абсцисс от точки А откладывается отрезок, равный [AY] - [BX]. Тогда координаты точки M будут связаны следующим образом с заданным составом системы:
x= [AY] - [BX];
y= [BY] - [AX];
z= [AY] + [BX] + [BY] + [AX];
или в ионном выражении: x = [Y-] - [B+] = [A+] - [X-]; y = [Y-] - [A+] = [B+] - [X-]; z = [Y-] + [X-] = [A+] + [B+].
74
Отсюда концентрации ионов взаимной пары солей по координатам x, y, z определяются следующим образом:
[Y |
− |
] = |
x + y + z |
; [B |
+ |
] = |
− x + y + z |
; [X |
− |
] = |
− x − y + z |
; [A |
+ |
] = |
x − y + z . |
|
|
2 |
|
2 |
|
2 |
|
2 |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Концентрации отдельных солей в четверных водно-солевых системах не могут быть определены однозначно.
7. 4. Принципиальная схема изотермической диаграммы растворимости в перспективной проекции
Пространственную диаграмму растворимости в четверной взаимной системе, построенную в правильной четырехгранной пирамиде, можно спроецировать перспективно посредством лучей, исходящих из вершины пирамиды, на плоскость солевого основания (перспективную проекцию называют также центральной, конической или полярной).
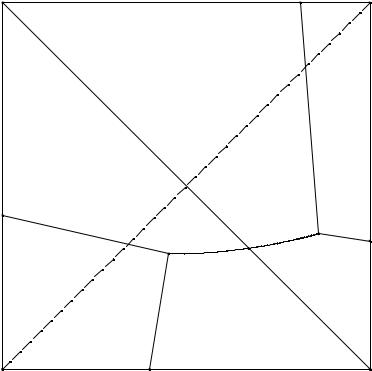
Принципиальная схема перспективной проекции изотермы растворимости четверной взаимной системы А+, В+ // X-, Y- - H2O приведена на рис. 7. 5.
AY |
|
|
e34 |
BY |
|
|
|
|
|
|
AY |
|
|
BY |
e14 |
|
|
E2 |
|
|
E1 |
e24 |
e23 |
|
|
|
|||
|
AX |
BX |
|
|
AX |
e12 |
|
|
BX |
Рис. 7. 5. Перспективная проекция изотермы растворимости в четверной взаимной системе А+, В+ // X-, Y- - H2O
При перспективном проецировании точки, изображающие насыщенные растворы каждой из четырех солей взаимной пары, проецируются посредством прямых, совпадающих с ребрами пирамиды, т. е. попадают в вершины квадрата состава, причем солям с общим ионом отвечают смежные углы квадрата. Точки
75
двойных эвтоник e12, e23, e34, e14 проецируются лучами, лежащими в плоскостях граней пирамиды; эти точки попадут на соответствующие стороны квадрата. Проекции тройных эвтоник E1 и E2 расположатся внутри квадрата состава, а линии совместной кристаллизации изобразятся кривыми, соединяющими перечисленные точки.
Квадратная диаграмма делится этими кривыми на четыре поля. Фигуративные точки, расположенные внутри каждого поля диаграммы, изображают дивариантные насыщенные растворы солей системы в равновесии с одной твердой солью, обозначенной в вершине квадрата, прилегающей к данному полю. Каждое из этих полей носит название поля кристаллизации соответствующей соли. Так, поле BYe34E2e23 является полем кристаллизации соли BY, поле AYe34E2e24E1e14 - полем кристаллизации соли AY и т.д.
Кривые, которыми разделяются поля кристаллизации, называются пограничными кривыми. Фигуративные точки, расположенные на этих кривых, графически изображают моновариантные насыщенные растворы, находящиеся в равновесии с двумя твердыми солями, поля кристаллизации которых соприкасаются по данной линии. Так, линия E1e24E2 отвечает составам растворов, находящихся в равновесии с двумя солями AY и BX; линия e34E2 - линия совместного насыщения солей AY и BY и т.д.
Тройные точки E1 и E2 соответствуют составам растворов, находящихся в равновесии с тремя твердыми солями, поля кристаллизации которых соприкасаются в данной точке. Например, точка E1 соответствует раствору, насыщенному солями AX, ВX и AY, точка E2 - раствору, насыщенному солями ВX, BY и AY. Точки, лежащие на сторонах квадрата, изображают насыщенные растворы двух солей с общим ионом. На концах диагоналей квадрата расположены взаимные пары солей. Соли одной пары располагаются на концах одной диагонали, соли другой пары - на концах другой диагонали. Точка пересечения диагоналей отвечает раствору, состоящему из эквивалентных количеств солей AX и BY или AY и BX.
Точки Е1 и Е2 находятся внутри треугольников, образованных составами равновесных твердых фаз (AX-AY-BX и BX-AY-BY соответственно), что свидетельствует о конгруэнтном характере тройных эвтонических растворов данной четверной взаимной системы. В этом случае диагональ квадрата, соединяющая пару солей, присутствующую в твердой фазе обоих эвтонических растворов, называется стабильной диагональю, а пара солей AY и BX называется стабильной парой солей. Стабильная диагональ делит четверную систему на две четверные системы простого эвтонического типа, каждая из которых может изучаться и изображаться самостоятельно.
Диагональ квадрата, соединяющая нестабильную пару солей AX и BY, называется нестабильной диагональю. В отличие от стабильной диагонали нестабильная диагональ всегда присутствует в четверной взаимной водно-солевой системе (исключением является лишь взаимная система при температуре инверсии).
Часто в четверной взаимной системе одна из тройных точек является инконгруэнтной. О таких системах говорят, что они не имеют стабильной диагона-
76
ли, они называются квазистабильными диагоналями. Но и в этом случае во всех системах имеется стабильная пара солей. Характерным признаком стабильной диагонали является тот факт, что тройные эвтонические точки находятся по разные стороны от прямой, соединяющей стабильную пару солей.
Солевой состав четверных взаимных систем может изображаться при использовании массовых процентов. В этом случае точка эквимолярных соотношений пар солей не находится в середине квадрата. Она лежит на диагонали, соединяющей стабильную пару солей, в точке эквимолярного соотношения стабильной пары солей. Нестабильная диагональ при таком изображении системы является ломаной. Ломаными являются и линии моновариантного равновесия, пересекающие стабильную или квазистабильную диагональ.
7. 5. Порядок кристаллизации солевых компонентов в процессе изотермического испарения исходных реакционных смесей
четверных взаимных водно-солевых систем
Как отмечалось выше, если в четверной взаимной системе имеется стабильная диагональ, эта система может быть триангулирована на две простые четверные системы. Порядок кристаллизации солевых компонентов в таких системах подробно описан выше. Остается рассмотреть особенности протекания процесса изотермического испарения в четверных взаимных системах с квазистабильной диагональю.
Рассмотрим изотерму растворимости четверной взаимной системы, представленную на рис. 7. 6. На изотерме имеется две тройные точки Е и Р - растворы, насыщенные относительно солей AX, BX, AY и BX, AY, BY соответственно. Взаимная пара солей BX и AY входит в обе тройки солей и, следовательно, является стабильной парой. Диагональ BX-AY проходит по одну сторону от тройных точек, что говорит об отсутствии стабильной диагонали в системе.
Изотермическое испарение растворов, находящихся в квазичетверной системе AY-BX-BY-H2O, всегда заканчивается в точке Р, а в системе AY-BX-AX-H2O - в точке Е.
Солевой состав исходного раствора M находится в поле кристаллизации безводного компонента BY, а также в треугольнике AY-BX-BY. При испарении этого раствора кристаллизоваться начинает компонент BY, солевой состав насыщенного раствора изменяется по прямой от точки М до точки М1, точка твердой фазы в это время находится в вершине BY.
Вточке М1 начинается совместная кристаллизация солей BY и BX, состав жидкой фазы при этом меняется по кривой e23Р от точки М1 до точки Р, а суммарный состав твердой фазы меняется по прямой от BY до точки М2.
Вточке P заканчивается изменение жидкой фазы в процессе изотермического испарения, происходит условно нонвариантная инконгруэнтная перитони-
ческая фазовая реакция: P(L)+ BY(S) → AY(S) + BX(S) (жидкость состава Р взаимодействует с кристаллами BY с образованием смеси кристаллов компонентов BX и

77
AY), состав жидкой фазы при этом остается постоянным (Р), а точка твердой фазы перемещается по прямой от точки М2 до точки М.
AY |
|
e34 |
BY |
|
|
BY |
M2 |
|
AY |
|
|
|
M |
N1 |
|
|
p2 |
|
|
|
N2 |
N3 |
|
e14 |
N |
e23 |
|
E |
p1 |
|
|
AX |
P M1 |
|
|
BX |
|
|
|
AX |
e12 |
|
BX |
Рис. 7. 6. Изменение составов равновесных фаз в процессе |
|||
|
изотермического испарения |
|
|
Исходный солевой состав раствора N находится в поле кристаллизации компонента BY на том же луче кристаллизации, что и точка М, но в треугольнике AY-BX-AX. При испарении этого раствора кристаллизоваться начинает компонент BY, солевой состав насыщенного раствора будет изменяться по прямой от точки N до точки М1, точка твердой фазы в это время находится в вершине BY.
Вточке М1 начинается совместная кристаллизация солей BY и BX, состав жидкой фазы при этом меняется по кривой e23Р от точки М1 до точки Р, а суммарный состав твердой фазы меняется по прямой от BY до точки N1.
Вточке P происходит условно нонвариантная инконгруэнтная перитони-
ческая фазовая реакция: P(L)+ BY(S) → AY(S) + BX(S), состав жидкой фазы при этом остается постоянным (Р), а точка твердой фазы перемещается по прямой от точки
N1 до точки N2.
В точке N2 исчезает последний кристалл соли BY, раствор становится двояконасыщенным, состав его меняется по линии РЕ от точки Р до точки Е и из него выделяется смесь кристаллов компонентов AY и BX. Суммарный состав твердой фазы изменяется по прямой AY-BX от точки N2 до точки N3.
78
В точке Е заканчивается изменение состава жидкой фазы, происходит совместная кристаллизация компонентов AY, AX и ВX. Точка твердой фазы при этом двигается по прямой от точки N3 до точки N.
8. ВОДНЫЕ СИСТЕМЫ С ЧИСЛОМ КОМПОНЕНТОВ БОЛЕЕ ЧЕТЫРЕХ
Для изображения систем из пяти и более компонентов разные авторы предлагали различные методы. Однако в большинстве случаев эти методы носили частный характер и не давали общего решения вопроса.
Все это побудило Н.С. Курнакова и его учеников провести ряд исследований, в результате которых были разработаны общие методы исследования и изображения многокомпонентных систем любого типа - как простых, так и взаимных.
Вопросы классификации многокомпонентных взаимных систем впервые были поставлены А.Г. Бергманом, который показал, что по мере возрастания числа компонентов разнообразие типов взаимных систем значительно увеличивается.
Для выбора многомерной геометрической фигуры и метода построения ее проекций В.П. Радищев предложил делить многокомпонентные системы на классы и виды. Если обозначить дробью К/А отношение числа катионов к числу анионов, то системами первого класса будут такие, для которых в этом отношении наименьшим числом является единица (например: 1/1, 1/2, 3/1, 1/5 и т.д.), системами второго класса - двойка (2/2, 3/2, 2/5 и т.п.), системами шестого класса - шестерка (6/7, 8/6 и т.п.) и т.д. Таким образом, в пределах каждого класса могут существовать системы с любым числом компонентов. Только системы первого класса являются простыми.
Внутри каждого класса различными отношениями К/А определяются виды систем. Для построения каждого вида характерно отношение числа взаимных пар солей к общему числу простых солей в системе B : N = R, называемое полнотой взаимодействия. С ростом компонентности для всех систем значение R увеличивается (кроме простых, т.е. систем первого класса, для которых R=0), но в пределах класса системы остаются сходными по своему строению. Поэтому для систем первого класса может быть выбран единый способ изображения фазовых диаграмм с использованием геометрических фигур аналогичной структуры - по мере увеличения компонентности мерность фигуры будет увеличиваться (например: треугольник - тетраэдр - пентатоп -...).
Ф.М. Перельман предложила оптимальные проекции фигур Радищева для изображения систем с любым количеством компонентов. Именно эти проекции будут использоваться далее.
8. 1. Принципиальная схема изотермы растворимости пятерной водно-солевой системы простого эвтонического типа
Применение правила фаз к пятерным системам позволяет сделать следующие выводы. При постоянных давлении и температуре (изобара и изотерма) система будет нонвариантной при равновесии пяти фаз (В = 5-5+0 = 0), моновариант-
79
ной - при равновесии четырех фаз (В = 5-4+0 = 1), дивариантной - при трехфазном равновесии (В = 5-3+0 = 2), двухфазные равновесия являются тривариантными
(В= 5-2+0= 3).
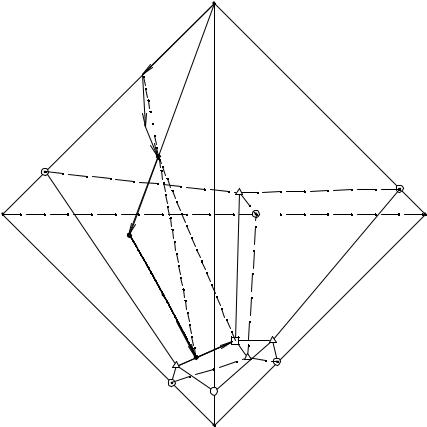
Простая пятерная водно-солевая система может быть составлена четырьмя солями с одинаковыми катионами или анионами. Солевая проекция изотермы растворимости может быть изображена в виде тетраэдра, вершины которого отвечают проекциям растворов чистых солевых компонентов, стороны - тройных водносолевых систем, грани - оконтуривающих четверных систем, внутренняя часть тетраэдра - солевым проекциям пятерных систем. Принципиальная схема солевой проекции изотермы растворимости простой пятерной водно-солевой системы простого эвтонического типа приведена на рис. 8. 1.
На диаграмме растворимости солевые проекции растворов, насыщенных относительно одной соли, попадают в объемы кристаллизации соответствующих
солей: AeADE4eACE1EE2eABE1A; BeBDE2eABE1EE3eCBE1B; CeCDE4eACE1EE3eCBE1C; DeADE4eCDE3EE2eBDE3D.
Двояконасыщенные растворы относительно солей А и В проецируются на поверхность двойного насыщения eABE2EE1eAB, относительно солей А и С -
eAСE4EE1eAС, относительно солей А и D - eADE4EE2eAD, относительно солей B и С - eCBE3EE1eCB, относительно солей B и D - eBDE2EE3eBD и, наконец, относительно со-
лей C и D - eCDE4EE3eCD.
Трояконасыщенные растворы относительно солей А, В и С проецируются на линию тройного насыщения EE1, относительно солей А, В и D - на EE2, относительно солей B, C и D - на EE3, относительно солей А, C и D - на E4E.
Состав четверного эвтонического раствора представлен на солевой проекции точкой Е.
При помощи рис. 8. 1 рассмотрим, как будет протекать процесс изотермического испарения исходной реакционной смеси, солевой состав которой отображен точкой М. До появления первых кристаллов соли D солевой состав жидкой фазы не изменяется и отображается точкой М. Твердая фаза в системе в это время отсутствует.
После появления первых кристаллов D точка жидкой фазы перемещается по лучу DM от точки М до точки М1, а точка твердой фазы остается в вершине солевого тетраэдра состава, отвечающей компоненту D.
В точке М1 начинается совместная кристаллизация компонентов А и D. Соотношение компонентов В и С в растворе при этом не изменяется. Точка жидкой фазы перемещается по следу пересечения поверхности совместной кристаллизации компонентов А и D плоскостью АDМ от точки М1 до точки М2, точка твердой фазы - по стороне DА от точки D до точки М3.
Координаты точки М2 могут быть вычислены по уравнению прямой Е2Е в многомерном пространстве с учетом того условия, что соотношение содержания компонентов В и С на этой прямой и в точке М одинаковы. Координаты точки М3 могут быть вычислены по уравнению прямой М2М в многомерном пространстве с
80
учетом того условия, что содержание компонентов В и С на этой прямой одинаковы и равны 0.
D
M3
M4 
eAD |
M |
A |
M1 |
|
E2 |
eAB |
E4 |
eCD |
eAC |
C
E |
E3 |
E1 |
eCB |
M2 |
|
eBD |
|
B
Рис. 8. 1. Принципиальная схема солевой проекции изотермы растворимости простой пятерной водно-солевой системы простого эвтонического типа
Вточке М2 начинается совместная кристаллизация компонентов А, В и D. Точка жидкой фазы перемещается по линии тройного насыщения Е2Е от точки М2 до точки Е, точка твердой фазы - по грани DАВ от точки М3 до точки М4. Координаты точки М4 могут быть вычислены по уравнению прямой ЕМ в многомерном пространстве с учетом того условия, что содержание компонента С на этой прямой равно 0.
Вточке Е начинается совместная кристаллизация компонентов А, В, С и D. Солевой состав жидкой фазы остается постоянным, соответствующим точке Е, точка твердой фазы перемещается с грани DАВ внутрь солевого тетраэдра состава от точки М4 до точки М. Когда суммарный солевой состав твердой фазы приходит
вточку М, исчезает последняя капля четверного эвтонического раствора.
8. 2. Принципиальная схема изотермы растворимости пятерной взаимной водно-солевой системы
Переходя к рассмотрению диаграмм более сложных систем, остановимся на системах, образованных водой и взаимной парой солей и содержащих, кроме
