
С.А. Мазунин, Г.С. Посягин ОСНОВЫ ФИЗИКО-ХИМИЧЕСКОГО АНАЛИЗА Часть 2. 1999г
..pdf91
|
F x |
|
−G |
( |
b |
xl |
− yl |
+ y |
) − H ( |
c |
xl |
− zl |
+ z |
) |
|
|
|
|||||||
|
|
|
|
|
|
|||||||||||||||||||
x = |
|
|
|
1 |
|
|
|
a 1 |
1 |
|
|
1 |
|
|
|
a 1 |
1 |
1 |
|
, |
(9. |
9) |
||
|
|
|
|
|
|
|
|
|
|
b |
− H |
c |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
F −G |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
a |
a |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
y = |
b |
(x − x1l |
) +y1l , |
|
|
|
|
|
|
|
|
|
|
|
|
(9. |
10) |
|||||||
a |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
z = |
c |
(x − x1l |
|
) +z1l , |
|
|
|
|
|
|
|
|
|
|
|
|
(9. |
11) |
||||||
a |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где F = b1c2 – b2c1; G = a1c2 – a2c1; H = a2b1 – a1b2.
10. МАТЕМАТИЧЕСКОЕ МОДЕЛИРОВАНИЕ ИЗОТЕРМ РАСТВОРИМОСТИ ВОДНО-СОЛЕВЫХ СИСТЕМ ПРОСТОГО ЭВТОНИЧЕСКОГО ТИПА
Разработка или модернизация технологии получения минеральных солей требует исследования физико-химических основ этих процессов, фундаментом которых являются фазовые равновесия в соответствующих многокомпонентных системах. Для определения оптимальных условий синтеза солей с участием водных растворов (температурный диапазон процесса, влияние концентрации и избытка компонентов реакционной смеси на выход продукта и т.д.) изучают изотермы растворимости водно-солевых систем.
Графическая обработка экспериментальных данных по растворимости в многокомпонентных водно-солевых системах позволяет наглядно представить взаимное расположение фазовых областей, произвести необходимые расчеты, но не обеспечивает высокой точности получаемых результатов и становится затруднительной при переходе к системам, для изображения растворимости в которых требуются пространственные диаграммы.
Важной задачей является определение составов равновесных фаз для любой исходной реакционной смеси данной водно-солевой системы. Применение графического метода для четверных систем и систем более высокого порядка возможно лишь при использовании всех необходимых плоских проекций, что увеличивает время и снижает точность обработки экспериментальных данных. Построение математической модели соответствующей водно-солевой системы позволяет быстро и точно решить данную задачу.
Рассмотрим алгоритм построения математической модели на примере изотермы растворимости четверной водно-солевой системы простого эвтонического типа.
10. 1. Общие принципы построения модели
Цель построения математической модели – дать целостную картину по растворимости в системе, описать все фазовые равновесия. При этом одна из важнейших задач заключается в определении функциональных зависимостей не только для моновариантных равновесий, описываемых линиями, но и для ди- и более вариантных равновесий, описываемых поверхностями различного порядка.
92
При аппроксимации линий моновариантного равновесия полиномиальными зависимостями второго и более высоких порядков возникает множественность решений по определению состава равновесной жидкой фазы для данной исходной реакционной смеси. Этот недостаток обнаруживается уже при рассмотрении изотерм растворимости тройных водно-солевых систем.
Например, пересечение прямой (состав твердой фазы - состав исходной реакционной смеси - насыщенный раствор) с полиномом второй степени может происходить в двух точках, третьей степени – в трех и т.д. Исключить посторонний корень часто бывает невозможно. Кроме того, две линии моновариантного равновесия, построенные по методу наименьших квадратов, также могут пересечься в двух точках или не пересечься вообще, в тройной же эвтонической точке простой четверной водно-солевой системы должны пересечься сразу три линии моновариантных равновесий.
Для частичного решения этих проблем возникает необходимость применения взвешенного метода наименьших квадратов с большим весом узлов в точках, соответствующих нонвариантным равновесиям (эвтоническим растворам или растворимостям компонентов). Это не оправдано с точки зрения физико-химического анализа, поскольку выделение той или иной точки не совместимо с его принципами. Кроме того, аппроксимирование полиномами высоких порядков не дает гладких кривых, адекватно отражающих фазовые равновесия системы.
Восстановление поверхностей насыщения в четверных водно-солевых системах с помощью метода наименьших квадратов, где в качестве вида эмпирической формулы использовались полиномы второго и третьего порядков, также приводит к ряду практических трудностей:
1.Поверхности, аппроксимированные полиномами второго или третьего порядков, не пересекаются по линиям двойного насыщения, и построение математической модели всей системы целиком становится невозможным.
2.Так как экспериментальные данные описываются поверхностью, близкой к плоскости, восстановление зависимости методом наименьших квадратов поверхностями второго порядка обычно приводит к многомерным эллипсоидам с одной из полуосей, близкой к нулю, поэтому пересечение этой поверхности прямой дает два близких корня и исключение постороннего корня невозможно.
Возможно, полиномиальный вид эмпирической модели в принципе не подходит для моделирования поверхностей насыщения из-за множественности решений и возникновения биений при увеличении степени полинома.
По этой причине для построения математических моделей изотерм растворимости четверных водно-солевых систем предлагается использовать "мозаичные" поверхности кристаллизации, составленные плоскостями, построенными по трем экспериментальным точкам, лежащим на этих поверхностях. При таком подходе линии моновариантного равновесия представляются как совокупности отрезков прямых, построенных по двум точкам этой линии. При переходе к системам с бóльшим числом компонентов гиперповерхности моделируются как сово-
93
купности гиперплоскостей, построенных по четырем, пяти и т.д. точкам этой гиперповерхности.
Кроме построения поверхностей дивариантного и линий моновариантного равновесия, математическая модель четверной водно-солевой системы должна решать следующие задачи:
1.Определение фазовой области, в которой лежит фигуративная точка, соответствующая составу данной исходной реакционной смеси (СИРС).
2.Определение фазы переменного состава и фиксация фаз постоянного состава, на которые распадается данная реакционная смесь.
3.Решение вспомогательных задач:
a)определение состава равновесных твердых фаз по результатам анализа жидкой фазы и составу исходной реакционной смеси для контроля правильности проводимых исследований;
b)построение изогидрических линий при окончательной обработке экспериментальных данных;
c)вычисление состава жидкой фазы по ее солевому составу при сервисном использовании математической модели на персональном компьютере;
d)определение выхода соли или смеси солей в кристаллическом виде;
e)вычисление состава исходной реакционной смеси для выделения одного из компонентов в твердую фазу с максимальным выходом.
Взависимости от конкретной области применения модели могут возникнуть и другие задачи.
При построении рассматриваемой модели метод наименьших квадратов использовался в качестве вспомогательного метода для сглаживания экспериментальных данных и вычисления промежуточных точек с необходимым шагом.
10.2. Основные алгоритмы построения математической модели четверной водно-солевой системы простого эвтонического типа
Изотерму растворимости простой четверной водно-солевой системы изобразим в виде тетраэдра, вершинам которого соответствуют чистые компоненты (см. рис. 10. 1). Ребра тетраэдра отвечают соответствующим двойным, а грани – тройным системам. Четверные составы представлены точками внутри тетраэдра.
Для построения математической модели простой четверной водно-солевой системы используем барицентрическую систему координат, где за начало координат примем вершину Н2О – точку O с координатами (0, 0, 0). По осям откладываем содержание компонентов A, B и C, выраженное в массовых или мольных %. Тогда вершины тетраэдра, отвечающие солевым компонентам А, B и С, имеют соответственно координаты (100, 0, 0), (0, 100, 0) и (0, 0, 100). Состав исходной реакционной смеси соответствует фигуративной точке F с координатами (x, y, z). Содержание воды (w) не является независимой координатой и вычисляется по уравнению w = 100 - x - y - z.

94
При помощи рис. 10. 1 рассмотрим порядок графических построений для определения местоположения состава (F) и солевого состава (F') фигуративной точки F.
H2O (0, 0, 0)
O
x+y+z |
|
OA z c |
OC |
y |
F |
100-(x+y+z) |
x z c |
|
|
|
z' |
OB |
|
|
|
|
A |
0) |
c' |
C |
(100, 0, |
y' |
(0, 0, 100) |
F'
x'
z' c'
B
(0, 100, 0)
Рис. 10. 1. Изображение состава (F) и солевого состава (F') фигуративной точки в четверной водно-солевой системе
Фигуративная точка F находится на плоскости ОAОBОC с постоянным содержанием воды, равным 100 - (x+y+z). Положение точек ОA, ОB, ОC находим, отложив в масштабе сторон АО, ВО, СО отрезки АОA, ВОB, СОC, равные содержанию воды в точке F, или отрезки ООA, ООB, ООC, равные сумме x + y + z.
Кроме того, фигуративная точка F находится на прямой сс, содержание компонента С на которой постоянно и равно z. Для построения этой прямой необходимо в масштабе стороны АС отложить отрезок ОAс, равный z, в масштабе стороны ВС - отрезок ОBс, также равный z.
Последним действием от стороны ОAОC в масштабе стороны АВ на прямой сс откладываем отрезок сF, равный y, и находим положение фигуративной точки
F.
Положение точки F' (солевая проекция точки F c координатами (x', y', z'), причем x' + y' + z' = 100) можно определить, построив луч ОF и продолжив его до пересечения с солевым основанием тетраэдра состава. Можно также вычислить солевой состав точки F и отложить его в солевом треугольнике АВС.
95
Для построения модели изотермы растворимости четверной водно-солевой системы A – B – C – H2O простого эвтонического типа необходимы следующие экспериментальные данные (см. рис. 10. 2):
1. Растворимости солевых компонентов А, В и С: RA, RB, и RC соответст-
венно.
2.Составы двойных эвтонических растворов:
1)EAB в системе A – B – H2O;
2)EBC в системе B – C – H2O;
3)EAC в системе A – C – H2O.
3.Состав тройного эвтонического раствора (E) системы A – B – C –H2O.
4.Составы насыщенных растворов на линиях моновариантного равновесия
втройных системах:
1)RA – EAB и RB – EAB в системе A – B – H2O;
2)RA – EAC и RC – EAC в системе A – C – H2O;
3)RB – EBC и RC – EBC в системе B – C – H2O.
5. Составы насыщенных растворов на линиях моновариантного равновесия
EAB – E, EAC – E и EBC – E в системе A – B – C – H2O.
6. Составы насыщенных растворов на поверхностях кристаллизации компонентов A, B или С в системе A – B – C – H2O, полученные при изучении разрезов данной системы.
Задача определения фазовой области для четверной системы решается путем нахождения объема, в который попадает фигуративная точка состава исходной реакционной смеси.
Согласно принципу соответствия каждому фазовому равновесию на диаграмме должен соответствовать свой геометрический образ. Изотерма растворимости четверной водно-солевой системы простого эвтонического типа A – B – C – H2O имеет следующие области, соответствующие определенным фазовым равновесиям:
I. Область Н2O - RA - EAB - RB - EBC - RC - EAC - E - EAB - E - EBC – Н2O характе-
ризует однофазное равновесие и является областью ненасыщенных растворов. II. Области насыщенных растворов относительно одной соли:
1)область A – RA – EAB – E – EAC – RA – A образует объем кристаллизации
соли А;
2)область В – RB – EAB – E – ECB – RB – B образует объем кристаллизации
соли В;
3)область С – RC – EAC – E – EСB – RC – C образует объем кристаллизации
соли С.
III. Области насыщенных растворов относительно двух солей:
1)область A – B – EAB – E – B – A образует объем совместной кристаллизации солей А и В;
2)область B – C – ECB – E – C – B образует объем совместной кристаллизации солей В и С;
96
3) область С – А – EAС – E – А– С образует объем совместной кристаллизации солей С и А.
IV. Область E – А – В – С – E образует объем совместной кристаллизации солей А, В и С.
Состав исходной реакционной смеси может оказаться в одной из восьми фазовых областей. Задача по определению местоположения СИРС решается путем последовательного исключения фазовых областей, в которые не попадает данная фигуративная точка.
Оптимальная последовательность проверки областей кристаллизации, на наш взгляд, должна быть следующей:
1.Четырехфазная область кристаллизации трех солей.
2.Три трехфазные области кристаллизации двух солей.
3.Три двухфазные области кристаллизации одной соли.
4.Область ненасыщенных растворов.
H2O
RA 

 EAC
EAC 
 RC
RC
ECB 

A 






 E
E


 RB
RB







 C
C
EAB
B
Рис. 10. 2. Изотерма растворимости четверной водно-солевой системы простого эвтонического типа
Если состав исходной реакционной смеси находится в четырехфазной области кристаллизации трех компонентов A, B и C, принадлежность фигуративной точки F данной фазовой области (см. рис. 10. 3) определяется путем нахождения точки пересечения прямой EF c плоскостью солевого основания (ABC). Необходимые условия принадлежности:
1)локализация точки пересечения FS внутри треугольника ABC;
2)принадлежность точки F отрезку FSE.
97
Выполнение этих условий является достаточным основанием для заключения о том, что исходная реакционная смесь находится в четырехфазной области. В этом случае состав равновесной жидкой фазы является постоянным и соответствует тройному эвтоническому раствору, а состав твердой фазы переменный и отвечает точке FS на солевом основании диаграммы. Соотношение равновесных твердой и жидкой фаз определяется по правилу рычага, а содержание солевых компонентов в твердой фазе – по правилу центра масс.
E
A





 ·F
·F








 C
C
·FS
B
Рис. 10. 3. Моделирование объема совместной кристаллизации компонентов A, B и C
Для трех объемов совместной кристаллизации двух солей (A и B; B и C или A и C) моделирование сводится к нахождению функциональной зависимости для линии моновариантного равновесия двояконасыщенных растворов, а также определения условий принадлежности СИРС данной фазовой области.
Линии моновариантного равновесия после проведения сглаживания и интерполяции, например, методом наименьших квадратов моделируются как совокупность отрезков прямых, построенных по двум ближайшим точкам, между которыми проходит луч кристаллизации твердая фаза - СИРС для данного состава исходной реакционной смеси.
Математически задача решается следующим образом. Линия моновариантного равновесия EAB – E представляется как ломаная, составленная из отрезков EABM1, M1M2, ..., Mn-1Mn, MnE, где M1, M2, ..., Mn – экспериментальные (или вычисленные после аппроксимации) моновариантные точки на данной линии. Таким образом, для n экспериментальных точек имеем n+1 отрезков. Рассмотрим случай, когда n = 3 (см. рис. 10. 4)
В этом случае объем совместной кристаллизации солей A и B (A – B – EAB– –E – B – A) разбивается на соответствующее количество частичных областей. Для n=3 имеем:
I. A – B – EAB – M1 – B – A;
II. A – B – M1 – M2 – B – A;
98
III. A – B – M2 – M3 – B – A;
IV. A – B – M3 – E – B – A.
Далее решается задача по последовательной проверке принадлежности данной фигуративной точки каждому из (n+1) объемов. Если состав исходной реакционной смеси не принадлежит ни одному объему, то он не находится в данной фазовой области. Принадлежность исследуемой фигуративной точки данному объему определяется путем вычисления составов равновесных твердых и жидкой фаз. Эти вычисления производятся следующим образом.
Пусть дана фигуративная точка F (x0, y0, z0) состава исходной реакционной смеси в объеме совместной кристаллизации компонентов А и В. Необходимо определить координаты точки FS (xS, yS, zS), находящейся на стороне АВ концентрационного треугольника, представляющей собой состав равновесной смеси кристаллов А и В, и точки FL (xL, yL, zL), находящейся на линии двояконасыщенных растворов ЕАВ-Е и представляющей собой состав равновесной жидкой фазы.
Точки FS, F и FL лежат на одной прямой. Известны координаты точек M1(x1, y1, z1) и M2 (x2, y2, z2) на линии моновариантного равновесия, а также точек, отвечающих составам солевых компонентов A (100, 0, 0) и B (0, 100, 0). Точка FS лежит на прямой AB, а точка FL – на прямой M1M2 соответственно. На прямой AB содержание третьего солевого компонента C и H2O равно 0, поэтому для координат точки FS выполняются следующие условия:
xS + yS = 100; zS =0. |
(10. 1) |
Подставив координаты этих точек в соответствующие уравнения прямых в трехмерном пространстве, получим систему уравнений, решением которой будут координаты точек FS и FL:
x |
− x |
= |
|
y |
− y |
= |
|
z |
|
− z |
|
|
||||||||
|
L |
1 |
|
|
L |
1 |
|
L |
1 |
|
||||||||||
x |
− x |
y |
− y |
|
z |
− z |
||||||||||||||
|
2 |
− x |
1 |
|
|
|
y |
2 |
− y |
1 |
|
|
2 |
1 |
|
|||||
x |
0 |
L |
|
= |
|
0 |
L |
|
= |
|
z |
0 |
− z |
L |
||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
yS |
− yL |
|
|
zS − zL |
|||||||||||
xS − xL |
|
|
|
|
|
|||||||||||||||
|
|
xS + yS |
=100; zS |
= |
0 |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Данную систему можно преобразовать к виду:
(z |
2 |
− z |
1 |
)x |
L |
−(x |
2 |
− x )z |
L |
= x z |
2 |
− z |
x |
2 |
|
|
|
|
|
1 |
|
1 |
1 |
|
|||||||
(z |
2 |
− z1 ) yL −( y2 − y1 )zL = y1 z2 − z1 y2 |
|||||||||||||
|
|
|
|
|
|
+(100 − x0 |
− y0 |
− z0 )zL =100z0 |
|||||||
z0 xL + z0 yL |
|||||||||||||||
(10. 2)
(10. 3)
Система (10. 3) является системой трех линейных уравнений с тремя неизвестными xL, yL и zL и является легко разрешимой. Координата xS находится по формуле:
|
|
|
|
|
99 |
xS |
= |
xL z0 |
− zL x0 |
, |
(10. 4) |
zL |
|
||||
|
|
− z0 |
|
||
а координаты yS и zS по формуле (10. 1) соответственно.
Таким образом, достаточные условия принадлежности фигуративной точки F рассматриваемой фазовой области:
1)точка FS принадлежит отрезку AB.
2)точка FL принадлежит отрезку M1M2.
3)точка F принадлежит отрезку FLFS.
M3 |
E |
M1 FL M2 |
|
EAB |
|
F |
|
A |
FS
B |
Рис. 10. 4. Моделирование области совместной кристаллизации компонентов A и B
В случае, если данная фигуративная точка не принадлежит ни одному из частных объемов, проверяется принадлежность данного состава исходной реакционной смеси двум другим областям совместной кристаллизации двух солей, которая проводится аналогичным образом.
После исключения области кристаллизации трех солей и трех объемов кристаллизации двух солей задача определения фазовой области сводится к следующему: определить, в какой из трех двухфазных областей (объеме кристаллизации компонента A, B или C) или области ненасыщенных растворов лежит данная фигуративная точка.
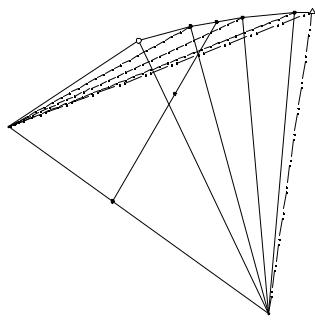
Определение принадлежности данной фигуративной точки объему кристаллизации одного из трех компонентов в алгоритме осуществляется при помощи солевой проекции системы (см. рис.10. 5).
На рис. 10. 5 точками EAB; EAC; ECB обозначены солевые проекции двойных эвтонических растворов оконтуривающих систем, точка E - солевая проекция тройного эвтонического раствора, точки М1, М2 и М3 ... М6 соответствуют солевым

100
составам насыщенных растворов, находящихся на линиях моновариантного равновесия ЕАВ-Е и ЕАС-Е соответственно. Точки F1 и F2 являются солевыми проекциями исходных смесей, исследуемых на принадлежность объему кристаллизации соли А. FL; FLAB; FLAC - точки пересечения лучей АF2 и АF1 с проекциями линий моновариантных равновесий и их продолжениями.
C
|
|
ECB |
EAC |
|
|
M6· |
|
|
M5· |
|
|
M4·F·2·FABL |
|
|
|
F·L |
|
|
M·3 E |
|
F·1 |
MFL2··M·1FACL |
B |
A |
EAB |
|
Рис. 10. 5. Моделирование объема кристаллизации компонента A
Проекции линий моновариантного равновесия рассматриваются при этом как совокупность отрезков прямых. Определяется точка пересечения FL прямой, проведенной из вершины треугольника состава, соответствующей изучаемому объему кристаллизации одной соли, через точку F1 с проекциями частных отрезков линий моновариантного равновесия (в данном случае М1М2). При этом, кроме точки FL, получается еще одна точка пересечения - FLAC, которая лежит на продолжении частного отрезка М3Е линии ЕАС-Е. Точка FL должна обязательно находиться внутри или на границе одного из частных отрезков (М1М2).
Если AFL ≥ AF1, то F1 принадлежит полю кристаллизации компонента A. При невыполнении данного условия точка F2 может лежать в областях кристаллизации компонента С или В, принадлежность к которым проверяется аналогично.
Однако выполнение этих двух условий еще не позволяет сделать однозначный выбор между объемом кристаллизации одной твердой фазы и областью ненасыщенных растворов. Для однозначного вывода необходимо определить состав насыщенного раствора, который образуется из данной исходной реакционной смеси при условии кристаллизации только той твердой фазы, в поле которой на-
