
С.А. Мазунин, Г.С. Посягин ОСНОВЫ ФИЗИКО-ХИМИЧЕСКОГО АНАЛИЗА Часть 2. 1999г
..pdf
141
тях, не могут быть определены графически на данной диаграмме, так как эти растворы находятся вне плоскости данной системы. Для таких исходных реакционных смесей, используя диаграмму растворимости, можно прогнозировать лишь состав твердой фазы.
|
|
|
H2O |
|
|
|
NaHCO3 + NH4HCO3 |
|
|
|
|
|
|
NaHCO3 |
NH4Cl |
|
|
|
|
|
|
|
|
|
|
NaHCO3 + NH4HCO3 + NH4Cl |
|
||
0 |
20 |
40 |
60 |
80 |
100 |
NaHCO3 |
|
% мас. |
|
NH4Cl |
|
|
Рис. 12. |
15. Комбинированная проекция |
|||
|
изотермы растворимости системы |
||||
|
NaНСО3 - NН4Сl - Н2О при 25°С |
||||
|
|
|
H2O |
|
|
|
NaHCO3+ NH4HCO3 |
|
|
|
|
|
|
NaHCO3 |
NH4Cl |
|
|
|
|
|
|
|
|
|
|
NaHCO3+ NH4HCO3+ NH4Cl |
|
||
0 |
20 |
40 |
60 |
80 |
100 |
NaHCO3 |
|
% мас. |
|
NH4Cl |
|
|
Рис. 12. |
16. Комбинированная проекция |
|||
|
изотермы растворимости системы |
||||
|
NaНСО3 - NН4Сl - Н2О при 30°С |
||||
К посторонним фазовым областям относятся: поле кристаллизации гидрокарбоната аммония; поле совместной кристаллизации гидрокарбонатов аммония и натрия; поле совместной кристаллизации хлорида и гидрокарбоната аммония; поле совместной кристаллизации хлорида аммония, гидрокарбоната натрия и гидрокарбоната аммония.
Кроме посторонних фазовых областей на всех изотермах растворимости выявлены поля кристаллизации гидрокарбоната натрия и хлорида аммония. Исходные реакционные смеси, лежащие в этих фазовых областях, после проведения термостатирования распадаются на насыщенные растворы и твердые фазы, составы которых могут быть определены графически при использовании диаграмм соответствующих изотерм растворимости.
12.4. Система NH4+, Na+ // HCO3-, Cl- - H2O
Всоставах насыщенных растворов четверной взаимной системы имеются карбонат-ионы, содержание которых, в полном соответствии с теорией, возрастает в присутствии гидрокарбоната аммония - соли, образованной слабым основанием и слабой кислотой, и уменьшается в присутствии хлорида натрия - соли, образованной сильным основанием и сильной кислотой.
Наличие карбонат-ионов в насыщенных растворах увеличивает вариантность всех фазовых равновесий на единицу, а система становится пятерной взаимной: NH4+, Na+ // HCO3-, CO32-, Cl- - H2O. Увеличение вариантности фазовых
142
равновесий делает необходимым приведение в итоговой таблице в качестве составов эвтонических растворов не средних, а экспериментально полученных составов с минимальным содержанием карбонат-ионов. Повышенный разброс экспериментальных данных на линиях моновариантного равновесия также объясняется увеличением вариантности равновесий.
Цифровой материал по растворимости в четверной взаимной системе при
15, 20, 25 и 30°С сведен в табл. 12. 5, 12. 6 и изображен на рис. 12.17-12.20 совме-
стно с изолиниями коэффициента использования ионов натрия.
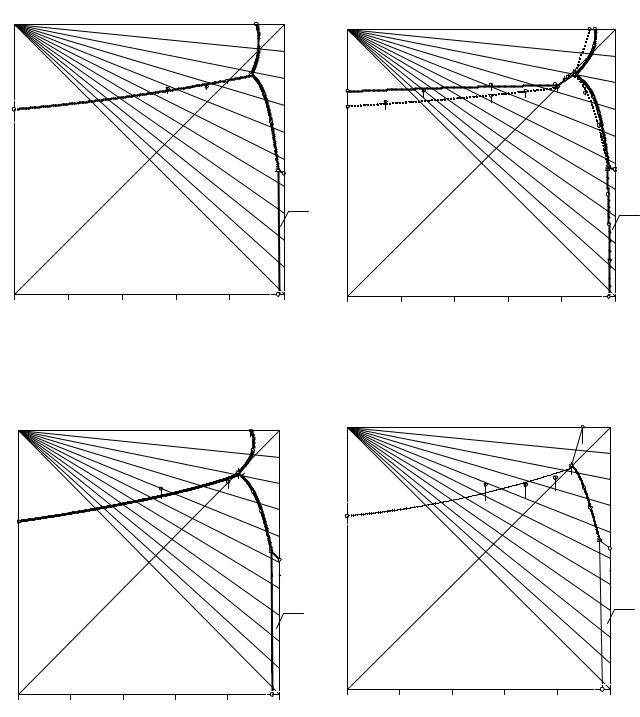
Все изотермы растворимости четверной взаимной системы не имеют стабильной диагонали. Первые тройные эвтонические растворы, насыщенные относительно хлорида аммония, гидрокарбоната аммония и гидрокарбоната натрия, являются инконгруэнтными (точки Р на рисунках). Вторые тройные эвтонические растворы, насыщенные относительно хлорида натрия, хлорида аммония и гидрокарбоната натрия, имеют конгруэнтный характер (точки Е на рисунках).
В составах первых тройных эвтонических растворов содержатся значительные количества карбонат-ионов и отчетливо заметно увеличение вариантности четырехфазных равновесий и превращение нонвариантных точек в отрезки линий моновариантного равновесия. При температурах 15 и 20°С прослеживается обратно пропорциональное влияние карбоната натрия на содержание хлорида натрия в тройных перитонических растворах.
Так, используя данные о содержании хлорида и карбоната натрия в эвтонических растворах при 15°С (см. табл. 12. 5, строки 3, 3а, 3б) и содержание хлорида натрия, приводимое Федотьевым, можно вычислить содержание карбоната натрия в его растворе и восстановить полный состав эвтонического раствора, насыщенного относительно гидрокарбоната аммония, хлорида аммония и гидрокарбоната натрия. Этот состав оказался следующим (% мас.): 23.3 - NH4Cl; 2.0 - NaCl; 4.7 - NaHCO3; 0.8 - Na2CO3.
Таким образом, карбонат натрия, содержащийся в первых (инконгруэнтных) тройных перитонических растворах, является источником экстраполяционной ошибки определения Федотьевым температуры, при которой состав эвтонического раствора должен был бы оказаться на диагонали состава четверной взаимной системы и выше которой она становится стабильной.
Вторые эвтонические растворы, в отличие от первых, содержат значительно меньше карбонат-ионов. Их составы в различных сериях опытов воспроизводятся с точностью до десятых долей процента.
На линиях е1Р, е2Р, РЕ, е3Е и е4Е находятся составы растворов, насыщенных относительно двух солей: гидрокарбоната натрия и гидрокарбоната аммония, гидрокарбоната аммония и хлорида аммония, гидрокарбоната натрия и хлорида аммония, хлорида натрия и хлорида аммония, гидрокарбоната натрия и хлорида натрия соответственно. Наличие в растворе карбонат-ионов приводит к превращению линий в куски поверхностей. Особенно хорошо это заметно на рис. 12. 18. Пунктиром на этом рисунке обозначены границы двояконасыщенных растворов с большим содержанием карбонат-ионов.
143
144
145
146
NH4HCO3 |
|
|
|
e2 NH4Cl |
||
|
|
|
|
|
|
UNa+ |
|
|
|
|
NH4HCO3 |
90 |
90 |
|
|
|
|
80 |
NH4Cl |
80 |
|
|
|
|
|
P |
|
|
|
|
|
70 |
|
|
e1 |
|
|
|
|
70 |
|
|
|
|
60 |
|
||
|
|
|
|
|
||
|
|
|
|
50 |
|
60 |
|
|
|
40 |
|
||
|
|
|
30 |
|
|
|
|
|
UNa+ |
20 |
|
E |
50 |
|
NaHCO3 |
10 |
|
|||
|
|
0 |
|
|
e3 |
|
|
|
|
|
|
|
40 |
|
|
|
|
|
|
NaCl |
|
|
|
|
|
• |
|
|
|
|
|
|
|
20 |
|
|
|
|
|
|
10 |
|
|
|
|
|
|
0 |
0 |
20 |
40 |
60 |
80 |
e4 100 |
|
NaHCO3 |
% мол. |
|
NaCl |
|||
Рис. 12. 17. Комбинированная проекция |
||||||
|
изотермы растворимости системы |
|||||
Na+, NH4+ // HCO3-, Cl- – H2O при 15°С |
||||||
NH4HCO3 |
|
|
|
NH4Cl |
||
|
|
|
|
e2 |
|
|
|
|
|
|
|
UNa+ |
|
|
|
|
|
NH4HCO3 |
90 |
90 |
|
|
|
|
80 |
NH4Cl |
|
|
|
|
|
P |
80 |
|
|
|
|
|
|
||
|
|
|
|
70 |
|
70 |
e1 |
|
|
|
60 |
|
|
|
|
|
50 |
|
60 |
|
|
|
|
40 |
E |
||
|
|
|
30 |
|
e3 |
|
|
|
UNa+ |
20 |
|
|
|
|
NaHCO3 |
10 |
|
|
||
|
|
0 |
|
|
50 |
|
|
|
|
|
|
|
40 |
|
|
|
|
|
|
NaCl |
|
|
|
|
|
• |
|
|
|
|
|
|
|
20 |
|
|
|
|
|
|
10 |
0 |
20 |
40 |
60 |
80 |
e |
0 |
4 100 |
||||||
NaHCO3 |
% мол. |
|
NaCl |
|
||
Рис. 12. 19. Комбинированная проекция |
||||||
|
изотермы растворимости системы |
|||||
Na+, NH4+ // HCO3-, Cl- – H2O при 25°С |
||||||
147 |
|
|
|
|
|
|
NH4HCO3 |
|
|
|
e2 NH4Cl |
||
|
|
|
|
|
|
UNa+ |
|
|
|
|
NH4HCO3 |
90 |
90 |
|
|
|
|
|
NH4Cl |
|
e1 |
|
|
|
80 P |
80 |
|
|
|
|
70 |
|
70 |
|
|
|
|
|
60 |
|
|
|
|
|
|
50 |
|
60 |
|
|
|
30 |
40 |
|
|
|
|
|
|
|
50 |
|
|
|
UNa+ |
20 |
|
|
|
|
NaHCO3 |
10 |
|
E |
e3 |
|
|
|
0 |
|
|||
|
|
|
|
|
|
40 |
|
|
|
|
|
|
NaCl |
|
|
|
|
|
|
• |
|
|
|
|
|
|
20 |
|
|
|
|
|
|
10 |
0 |
20 |
40 |
60 |
80 |
|
e4 1000 |
NaHCO3 |
% мол. |
|
NaCl |
|||
Рис. 12. 18. Комбинированная проекция |
||||||
|
изотермы растворимости системы |
|||||
Na+, NH4+ // HCO3-, Cl- – H2O при 20°С |
||||||
NH4HCO3 |
|
|
|
e2 NH4Cl |
||
|
|
|
|
|
|
UNa+ |
|
|
|
|
NH4HCO3 |
90 |
90 |
|
|
|
|
P |
NH4Cl |
|
|
|
|
|
80 |
||
|
|
|
|
|
80 |
|
|
|
|
|
70 |
|
70 |
e1 |
|
|
|
60 |
|
|
|
|
|
50 |
|
60 |
|
|
|
|
40 |
E |
||
|
|
|
30 |
|
e3 |
|
|
NaHCO3 |
UNa+ |
1020 |
|
|
|
|
|
0 |
|
|
50 |
|
|
|
|
|
|
|
40 |
|
|
|
|
|
|
NaCl |
|
|
|
|
|
|
• |
|
|
|
|
|
|
20 |
|
|
|
|
|
|
10 |
0 |
20 |
40 |
60 |
80 |
e4 1000 |
|
NaHCO3 |
% мол. |
|
NaCl |
|||
Рис. 12. 20. Комбинированная проекция |
||||||
|
изотермы растворимости системы |
|||||
Na+, NH4+ // HCO3-, Cl- – H2O при 30°С |
||||||
Внутри фигур NaHCO3–e1–P–E–e4–NaHCO3, NH4HCO3–e1–P–e2– NH4HCO3, NH4Cl–e2–P–E–e3–NH4Cl, NaCl–e3–E–e4–NaCl располагаются составы растворов насыщенных относительно одной соли - гидрокарбоната натрия, гидрокарбоната аммония, хлорида аммония, хлорида натрия соответственно. Эти фигуры также называются полями кристаллизации. Наличие в насыщенных растворах карбонатионов приводит к уменьшению поля кристаллизации гидрокарбоната натрия.
148
12. 5. Использование данных о растворимости в системе Na+, NH4+ // HCO3-, Cl- - H2O при 15, 20, 25 и 30°С для технологических прогнозов
Прежде чем начинать рассматривать практические следствия, вытекающие из представленных равновесных данных о растворимости в четверной взаимной системе, необходимо соотнести их с результатами работы промышленных и модельных лабораторных карбонизационных колонн, сведения о которых нам удалось найти в литературных источниках. Приводимые в литературе данные не всегда содержат сведения о плотности растворов и, как правило, концентрации компонентов даются в нормальных делениях (н. д.). Причем 20 н. д. = 1 г-экв/л данного иона или компонента.
Такой способ выражения составов растворов принят в содовой промышленности, и мы решили привести наши основные данные в таком же виде. Составы двояконасыщенных и тройных эвтонических растворов, выраженные в нормальных делениях, приведены в табл. 12. 6.
Количество абсорбированного диоксида углерода в содовом производстве принято характеризовать коэффициентом карбонизации системы, который определяется отношением всего поглощенного диоксида углерода, находящегося как в жидкой (CO2 общ.), так и в твердой фазах (2·NH3 связ.), к общему содержанию аммиака в жидкой фазе (NH3 общ.), выраженным в %:
RC = |
[CO2 |
общ.] + 2[NH3 |
связ.] |
100. |
(12. 5) |
|
|
[NH3 общ.] |
|
|
|||
|
|
|
|
|
|
|
Концентрации веществ в формуле (12. 5) выражены в н.д., поэтому при пересчете содержания хлорида аммония (NH3 связ.) на диоксид углерода, связанный в виде гидрокарбоната натрия, содержание связанного аммиака (NH3 связ.) увеличивается вдвое. При RC = 200% (т.е. когда на 1 н.д. NH3 приходится 2 н.д. СО2) все углекислые соли в системе существуют в виде гидрокарбонатов. В условиях производства обычно достигаемая величина RC составляет 187-193%.
Приведенные в табл. 12. 6 данные показывают, что при лабораторном исследовании растворимости в воде слагающих систему солей в токе диоксида углерода получаются насыщенные растворы лишь с немногим большими степенями карбонизации, чем растворы, образующиеся в промышленных карбонизационных колоннах. Следовательно, полученные данные могут служить равновесной моделью реального производства.
В случае если в реальном процессе образуются растворы с большей степенью карбонизации, чем приведенные в табл. 12. 6, то тогда потребуется изучение растворимости в четверной взаимной системе при повышенном давлении диоксида углерода, при этом линии моновариантного равновесия и нонвариантные точки изменят свое положение на диаграмме.
12. 5. 1. Влияние температуры на процесс карбонизации
Наиболее известный прогноз влияния температуры на процесс карбонизации был сделан П.П. Федотьевым, который на основании исследованных им изо-
149
терм растворимости четверной взаимной системы Na+, NH4+ // HCO3-, Cl- - H2O при 0 и 15°С экстраполяцией определил состав тройного перитонического раство-
ра при 30°С (U[Na+] = 83.4%, U[NH4+] = 84.1 %) и вычислил, что при 32°С солевой состав тройного перитонического раствора будет находиться на диагонали квадрата состава, соединяющей стабильную пару солей, и этот состав будет иметь одинаковые коэффициенты утилизации ионов аммония и натрия, равные 84 %.
Проведенные нами исследования равновесий в системе при 25 и 30°С показали, что составы первых тройных перитонических растворов (точки Р на рис. 12. 17-20) не находятся в плоскости диагональных разрезов квадрата состава и не будут находиться там при 32°С. Следовательно, вывод Федотьева является необоснованным, так как не учитывается содержание карбонатов натрия и аммония в жидкой фазе.
Данные, приведенные в табл. 12. 5 и 12. 6, показывают, что температура противоречиво влияет на равновесие процесса получения гидрокарбоната натрия. С ростом температуры, с одной стороны, неуклонно увеличивается растворимость хлорида аммония и его содержание в первом тройном перитоническом растворе, насыщенном относительно гидрокарбоната натрия, хлорида и гидрокарбоната аммония, увеличивается при этом и максимальный равновесный коэффициент использования ионов натрия. С другой стороны, увеличиваются степень гидролиза карбонатов аммония и парциальная упругость аммиака и диоксида углерода в газовой фазе. При этом возрастает содержание карбонатов натрия и аммония в жидкой фазе, уменьшается степень карбонизации системы и снижается коэффициент использования ионов натрия маточных растворов, получаемых в реальных аппаратах.
Выбор температуры окончания процесса получения гидрокарбоната натрия в карбонизационных колоннах не является однозначным, эта температура подбирается для каждой карбоколонны, поскольку зависит от конкретных условий и задач данного производства и конструктивных особенностей самой колонны: концентрации питающего колонну диоксида углерода, газовой и жидкостной нагрузок, количества и конструкционных особенностей контактных элементов и т. д.
12. 5. 2. Влияние концентраций ионов на процесс карбонизации
Данные, приведенные в табл. 12. 6, дают основания для вывода о том, что максимальный коэффициент использования ионов натрия наблюдается в первых тройных перитонических растворах. Расчеты показывают, что для получения этих растворов в состав исходной реакционной смеси кроме насыщенного раствора хлорида натрия должен вводиться кристаллический хлорид натрия. Вычисленные составы и плотности насыщенных растворов относительно гидрокарбонатов натрия и аммония при различных температурах, получаемые из рассола, содержащего 305 г/л хлорида натрия, представлены в табл. 12. 7 и изображены на рис. 12. 21.
Коэффициент использования ионов аммония вычислялся по формуле Федотьева:
|
|
|
|
|
|
|
|
|
|
|
150 |
|
|
|
|
||
|
UNH4 + |
= |
100 ([NH4 |
+ |
] −[П.Т.]) , |
|
|
|
(12. 6) |
||||||||
|
|
|
|
|
+ |
] |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
[NH4 |
|
|
|
|
|
|
|
||||
где [П.Т.] (прямой титр) = [HCO3-]+[CO32-]. |
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 12. 7 |
|
Вычисленные составы маточных растворов, получаемых |
||||||||||||||||
|
|
|
|
|
|
из рассола, содержащего 305 г/л NaCl |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Темпе- |
Плот- |
|
|
|
Состав насыщенного раствора, |
|
|
|
|||||||||
ратура, |
ность, |
|
|
|
|
|
|
|
|
н.д. |
|
|
|
|
UNa+, |
UNH4+, |
Твердая |
°С |
г/мл |
|
|
|
Cl- |
NH4+ |
|
|
Na+ |
HCO3- |
CO32- |
% |
% |
фаза |
|||
15 |
1.114 |
|
101.7 |
95.6 |
|
21.5 |
12.2 |
|
3.3 |
78.8 |
83.8 |
NaHCO3+ |
|||||
20 |
1.117 |
101.1 |
100.2 |
20.6 |
14.0 |
|
5.8 |
79.6 |
80.2 |
NH4HCO3 |
|||||||
|
-"- |
||||||||||||||||
25 |
1.121 |
100.2 |
106.2 |
19.2 |
17.9 |
|
7.3 |
80.8 |
76.3 |
-"- |
|||||||
30 |
1.126 |
|
|
99.1 |
114.3 |
19.0 |
16.7 |
|
17.5 |
80.9 |
70.1 |
-"- |
|||||
Рассматривая данные, приведенные в табл. 12. 7, отметим резкое увеличение содержания карбонат-ионов при 30°С и замедление возрастания равновесного коэффициента использования ионов натрия, неуклонное уменьшение коэффициента использования ионов аммония, а также тот факт, что превышение на 15.2 н.д. концентрации ионов аммония по отношению к ионам хлора при 30°С практически не меняет содержания ионов натрия и резко увеличивает содержание карбонатионов. Следует, наверное, сделать вывод, что дальнейшее увеличение температуры и увеличение избытка аммиака по отношению к хлориду натрия нецелесообразно без значительного повышения парциальной упругости диоксида углерода в газовой фазе.
Если мы сравним коэффициенты использования ионов натрия и аммония для растворов, получаемых из рассола хлорида натрия (см. табл. 12. 7), и максимальные значения этих коэффициентов в эвтонических растворах (см. табл. 12. 6), для получения которых необходимо добавление кристаллического хлорида натрия в карбонизационные колонны, то увидим их незначительное отличие. А значит, с технологической точки зрения более актуальны все мероприятия, направленные на уменьшение разбавления исходных растворов на предварительных стадиях и в процессе карбонизации, чем разработка технологических приемов введения кристаллического хлорида натрия в карбонизационные колонны.
Важным фактом, на наш взгляд, является большее содержание ионов натрия по отношению к гидрокарбонат-ионам в маточных растворах. Это превышение оборачивается прямыми потерями ионов натрия, оно зависит от степени карбонизации системы и от качества работы осадительной колонны. Отношение концентраций ионов натрия и гидрокарбонат-ионов в маточной жидкости является очень значимым показателем полезности проводимых изменений условий процесса карбонизации, и идеальным его значением будет 1.
