
С.А. Мазунин, Г.С. Посягин ОСНОВЫ ФИЗИКО-ХИМИЧЕСКОГО АНАЛИЗА Часть 2. 1999г
..pdf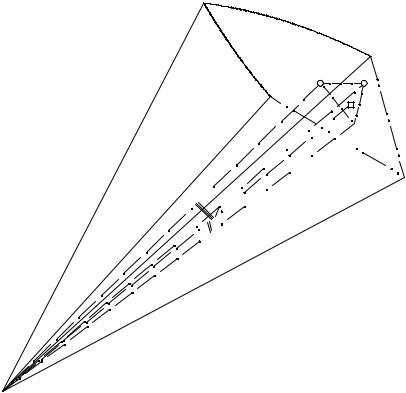
101
ходится солевая проекция исходной смеси. Для решения этой задачи и необходима модель поверхности кристаллизации данной соли.
Перед построением модели поверхности кристаллизации экспериментальные данные по растворимости на линиях моновариантного равновесия и в разрезах целесообразно предварительно подвергнуть сглаживанию и интерполяции методом наименьших квадратов или какой-либо другой процедурой.
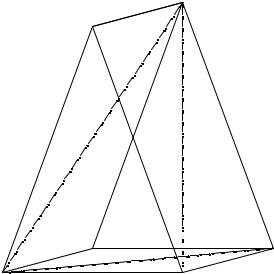
Предлагаемая мозаичная модель поверхности кристаллизации данного компонента построена как совокупность плоскостей, проведенных по трем ближайшим точкам, между которыми проходит нода, соединяющая составы данной исходной реакционной смеси и равновесной твердой фазы (см. рис. 10. 6).
RA
Sk |
EAC |
Sj |
|
EAB |
FL |
|

 Si
Si

 F
F
 E
E
ϕk 
 ϕj
ϕj 
 ϕi
ϕi
A
 FS
FS
Рис. 10. 6. Определение состава насыщенного раствора при использовании мозаичной модели поверхности кристаллизации
Допустим, что искомая фигуративная точка F лежит на солевой проекции в поле кристаллизации компонента A. Прежде всего необходимо из вышеперечисленных точек, лежащих на поверхности кристаллизации компонента A, выделить три ближайших из них, между которыми выходит на поверхность луч кристаллизации твердая фаза - СИРС.
Обозначим множество точек поверхности насыщенных растворов компонентом А через Si: S1, S2, ..., Si, ..., Sn-1, Sn S. В первом приближении задача сводится к нахождению ближайших трех точек поверхности насыщенных растворов от точки состава перспективной проекции данной исходной смеси из вершины соответствующего солевого компонента на поверхность насыщенных растворов.
102
В качестве такого критерия "близости" нами был выбран угол между двумя прямыми в трехмерном пространстве (заданных в виде векторов с соответствующими координатами a={xa; ya; za}, b={xb; yb, zb}), а точнее, косинус этого угла, определяемый по формуле
сos ϕ = |
xa xb + ya yb + za zb |
(10. 5) |
|||||
2 |
2 |
2 |
2 |
2 |
2 . |
||
|
xa + ya |
+ za |
xb |
+ yb |
+ zb |
|
|
При этом один из векторов, допустим, a = ASi , где Si (xS, yS, zS) – рассматриваемая точка поверхности, а A (100, 0, 0) – вершина компонента A. Тогда другой вектор b = AF , где F (x0, y0, z0) – фигуративная точка, соответствующая составу исходной реакционной смеси. Тогда формула (10. 5) преобразуется к виду
сos ϕ = |
(xs −100) (x0 |
−100 ) + yS y0 + zs z0 |
2 . |
(10. 6) |
|||||||||
(xS |
−100) |
2 |
2 |
2 |
(x |
0 −100) |
2 |
+ y |
2 |
+ z |
|||
|
|
+ ys |
+ zs |
|
0 |
0 |
|
||||||
Чем меньше угол между прямыми, т.е. чем ближе значение сos ϕ к 1, тем ближе находится точка поверхности Si к точке пересечения луча кристаллизации (прямая АF), соответствующего СИРС с этой поверхностью. Поэтому первоначально выбираются три точки поверхности с наибольшими значениями сos ϕ, не лежащие на одной прямой.
Кроме того, все точки не должны лежать на одной и той же линии моновариантного равновесия. В случае невыполнения этих условий самая дальняя точка из трех точек заменяется другой, более дальней.
Далее решается задача нахождения точки пересечения прямой AF с плоскостью, заданной тремя ближайшими точками поверхности (Si, Sj и Sk), не лежащими на одной прямой (см. рис. 10. 6) или на одной линии моновариантных равновесий.
Для проверки принадлежности данной фигуративной точки области ненасыщенных растворов определяют соотношение отрезков AF и AFL, где FL – перспективная проекция фигуративной точки F из вершины А на поверхность кристаллизации компонента A. Если AF < AFL, то точка F принадлежит объему кристаллизации компонента A. В этом случае координаты точки FL соответствуют составу равновесной жидкой фазы для СИРС (F). Состав равновесной твердой фазы отвечает чистому компоненту A. Соотношение твердой и жидкой фаз находится по правилу рычага как отношение FFL / AF.
Если длины отрезков AF и AFL равны, то состав исходной реакционной смеси принадлежит поверхности кристаллизации компонента A и твердая фаза отсутствует. При условии, когда AF > AFL, точка F лежит в области ненасыщенных растворов, твердая фаза также отсутствует, состав жидкой фазы равен составу исходной смеси.
Таким образом, для определения фазового состава СИРС, находящегося в поле кристаллизации компонента A, рассматривается объем, оконтуренный плоскостью, построенной по трем ближайшим точкам поверхности, и вершиной компонента A. Объем кристаллизации компонента A представляет собой совокуп-

103
ность таких объемов, а поверхность кристаллизации этой соли – совокупность подобных плоскостей. Чем больше экспериментальных точек на данной поверхности, тем на большее число частичных объемов мы можем разбить объем кристаллизации компонента. Следовательно, тем точнее мы можем определить равновесный состав насыщенного раствора для данной исходной реакционной смеси.
Если СИРС не находится в объеме кристаллизации компонента А, то далее аналогично определяется принадлежность его объемам кристаллизации компонентов B и С. Иначе СИРС принадлежит области ненасыщенных растворов.
10.3.Алгоритмы решения некоторых прикладных задач
Спомощью предложенной модели можно определить состав насыщенного раствора на поверхности кристаллизации компонента по составу любой фигуративной точки на солевой проекции системы. Эта задача решается в несколько этапов:
1.Определяется поле кристаллизации компонента, в котором находится данная фигуративная точка. Определение производится по тому же алгоритму, как и при проверке принадлежности данной фигуративной точки той или иной двухфазной области (см. выше).
2. Для данной точки на солевом основании системы F (x0, y0, z0) находятся три ближайшие точки на поверхности кристаллизации компонента по косинусу угла между прямой H2O - F и H2O - Si по формуле
сos ϕ = |
xs x0 |
+ yS y0 |
+ zs z0 |
, |
(10. 7) |
|||||
2 |
2 |
2 |
x |
2 |
2 |
+ z |
||||
|
2 |
|
||||||||
|
xS |
+ ys + zs |
0 |
+ y0 |
0 |
|
||||
где (xS, yS, zS) – координаты солевого состава исследуемой на степень "близости" точки Si в поле кристаллизации какого-либо компонента к точке F.
3. Определяется точка пересечения прямой, соединяющей точки F и вершину H2O, с плоскостью, заданной тремя ближайшими точками поверхности, не лежащими на одной прямой или на одной линии моновариантных равновесий. Найденная точка соответствует искомому составу насыщенного раствора на поверхности кристаллизации солевого компонента.
С помощью предложенной модели удобно решать и задачи по планированию эксперимента, быстрой обработке экспериментальных данных, проверке корректности проведенных экспериментов, в том числе и по определению оптимального состава исходной реакционной смеси для выделения с максимальным выходом в твердую фазу одного, двух или трех солевых компонентов.
Таким образом, алгоритм построения математических моделей водносолевых систем с использованием мозаичных поверхностей ди- и более вариантных равновесий является универсальным, адекватно отображает физико-химичес- кую природу системы, применим к любым типам водно-солевых систем любого порядка, дает полное описание всех фазовых равновесий, всегда обеспечивает однозначное решение и допускает реализацию на персональных компьютерах.
104
11. РАСТВОРИМОСТЬ В СИСТЕМЕ Nа+, (C2H5)2NH2+ //
НСО3-, Cl- - H2O ПРИ 10 И 25°С
Фазовые равновесия в системе Nа+, (C2H5)2NH2+ // НСО3-, Cl- - H2O иллюстрируют изотермы растворимости четверной взаимной системы, осложненные процессом гидролиза, сопровождаемого потерей системой части диоксида углерода, а также описывают концентрационные условия получения гидрокарбоната натрия из хлорида натрия, диоксида углерода и диэтиламина при 10 и 25°С энергосберегающим методом высаливания.
Процесс получения гидрокарбоната натрия из хлорида натрия, диэтиламина и диоксида углерода в идеале описывается уравнением
NaCl + (C2H5)2NH + CO2 + H2O → NaHCO3↓ + (C2H5)2NH2Cl, (11. 1)
а получающиеся в результате реакции соли образуют следующую четверную взаимную систему: Na+, (C2H5)2NH2+ // HCO3-, Cl- - H2O. Но в результате протекания в системе процесса гидролиза гидрокарбонат-ионов, которые полностью не перешли в твердую фазу в виде гидрокарбоната натрия, в маточном растворе появляются карбонат-ионы:
2HCO3- ↔ CO32- + CO2↑ + H2O. |
(11. 2) |
Возникает вопрос, с каким катионом связать карбонат-ионы при вычислении составов насыщенных растворов, выраженных в солях? Для корректного ответа на этот вопрос проведем триангуляцию пятерной взаимной водно-солевой системы Na+,(C2H5)2NH2+ // HCO3-, CO32-, Cl- - H2O, солевая часть которой изображена на рис. 11. 1.
11. 1. Теоретический анализ
Пятерная взаимная водно-солевая система Na+, (C2H5)2NH2+ // HCO3-, CO32-,
Cl- - H2O содержит три оконтуривающие четверные взаимные системы:
Na+, (C2H5)2NH2+ // HCO3-, Cl- - H2O;
Na+, (C2H5)2NH2+ // CO32-, Cl- - H2O;
Na+, (C2H5)2NH2+ // HCO3-, CO32-, - H2O;
две простые четверные системы:
*Na+ // HCO3-, CO32-, Cl- - H2O;
*(C2H5)2NH2+ // HCO3-, CO32-, Cl- - H2O.
Для проведения триангуляции необходимо знать стабильные пары солей во всех оконтуривающих четверных взаимных водно-солевых системах, которые определяются по произведениям растворимости диагональных пар солей.
Данные о растворимости солей, слагающих пятерную взаимную систему, представлены в табл. 11. 1.
105
NaHCO3
(C2H5)2NH2HCO3
|
|
|
NaCl |
|
|
|
Na2CO3 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(C2H5)2NH2Cl |
[(C2H5)2NH2]2CO3 |
|
|
||||
Рис. 11. 1. Солевая часть пятерной взаимной системы Na+, (C2H5)2NH2+ // |
|||||||||
|
|
|
|
HCO3-, CO32-, Cl- - H2O |
|
Таблица 11. 1 |
|||
|
|
Растворимость солей в воде при 10 и 25°С |
|||||||
|
|
|
|||||||
|
|
|
|
|
|
|
|||
Температура, |
|
Содержание соли в насыщенном растворе, моль/кг |
|||||||
°С |
NaCl |
Et2NH2Cl |
NaHCO3 |
Et2NH2HCO3 |
Na2CO3 |
[Et2NH2]2CO3 |
|||
10 |
4.51 |
6.03 |
|
0.87 |
|
4.25 |
1.05 |
- |
|
25 |
4.51 |
6.37 |
1.09 |
4.78 |
2.14 |
4.05 |
|||
Ниже приведены уравнения реакций, связывающие взаимные солевые пары системы, а также вычисленные значения произведения растворимости (в скобках приведены значения произведений растворимости при 25°С). Уравнения записаны таким образом, что слева находится нестабильная солевая пара, а справа - стабильная:
NaCl + (C2H5)2NH2HCO3 = NaHCO3 + (C2H5)2NH2Cl
4.51·4.25= 19.17 (464.7) |
0.87·6.03= 5.25 (48.2), |
2NaCl + [(C2H5)2NH2]2CO3 = Na2CO3 + 2(C2H5)2NH2Cl |
|
4.514 ·4.053 = 27483.4 (27483.4) |
1.053·6.034 =1530.51 (16136.1), |
2(C2H5)2NH2HCO3 + Na2CO3 = 2NaHCO3 + [(C2H5)2NH2]2CO3 |
|
4.254·1.053= 377.68 (5116) |
0.874·4.053= 38.06 (93.8). |
Стабильные пары солей одинаковы при обеих температурах и на рис. 11. 1 соединены штрихпунктирными линиями. Проведя плоскости через смежные диагонали, соединяющие стабильные солевые пары, и стороны солевой призмы состава, триангулируем пятерную взаимную систему Na+, (C2H5)2NH2+// HCO3-,CO32-, Cl- - H2O на три простые пятерные системы:
1.NaCl - (C2H5)2NH2Cl - NaHCO3 - Na2CO3 - H2O;
2.(C2H5)2NH2Cl - NaHCO3 - Na2CO3 - [(C2H5)2NH2]2CO3 - H2O;
3.(C2H5)2NH2Cl - NaHCO3 - (C2H5)2NH2HCO3 - [(C2H5)2NH2]2CO3 - H2O.
Исследуемая четверная взаимная система Na+, (C2H5)2NH2+ // HCO3-, Cl- -
H2O (I) триангулируется на две простые четверные системы:
106
1.NaCl - (C2H5)2NH2Cl - NaHCO3 - H2O;
2.(C2H5)2NH2Cl - NaHCO3 - (C2H5)2NH2HCO3 - H2O.
Первая четверная система входит в состав первой простой пятерной системы, в которой содержание хлорид-ионов превышает содержание ионов диэтиламмония, вторая четверная система входит в состав третьей пятерной системы, а тройная система (C2H5)2NH2Cl - NaHCO3 - H2O, представляющая диагональный разрез по стабильной паре солей, входит в составы второй и третьей пятерных систем.
Другими словами, при пересчете ионных составов насыщенных растворов исследуемой четверной взаимной системы (I) на солевые компоненты в случае, когда содержание ионов хлора больше, чем содержание ионов диэтиламмония (первая пятерная система), карбонат-ионы должны быть связаны с ионами натрия. Если же содержание ионов хлора меньше содержания ионов диэтиламмония (вторая и третья пятерные системы), то карбонат-ионы должны быть связаны с ионами диэтиламмония. Когда содержание ионов хлора равно содержанию ионов диэтиламмония, карбонат-ионы следует связывать с ионами натрия.
Для изображения результатов исследований в четверной взаимной системе Na+, (C2H5)2NH2+ // HCO3-, Cl- - H2O, а также в оконтуривающих системах и разрезах используем комбинированные проекции. По отношению к карбонату диэтиламмония применим перспективное проецирование, так как наличие в растворе этой соли не изменяет коэффициента использования ионов натрия (см. п. 11. 2-5).
Применение по отношению к карбонату натрия перспективного проецирования уменьшает содержание в растворе солей натрия, а коэффициент использования катионов натрия при этом увеличится. Поэтому карбонат натрия пересчитаем на эквивалентное количество гидрокарбоната натрия, на которое и увеличим содержание последнего в растворе.
Кроме того, для наглядности на проекциях изотерм растворимости систем отобразим содержание примесных компонентов в составах насыщенных растворов: содержание карбоната натрия отложим штрихом вверх от точки проекции, а карбоната диэтиламмония - вниз и размер штриха увеличим.
Для лучшего сочетания интересов теории и практики применим графическое представление изолиний коэффициента использования ионов натрия на изотерме растворимости четверной взаимной системы. Совместное изображение изотермы растворимости и сетки изолиний коэффициента использования ионов натрия позволяет легко графически определить солевые составы насыщенных растворов с максимальным выходом гидрокарбоната натрия в кристаллическом виде.
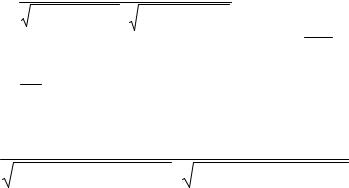
Для вывода зависимости коэффициента использования ионов натрия от состава (U[Na+]) воспользуемся формулой Федотьева (%):
Ошибка!. |
(11. 3) |
В четверной системе (C2H5)2NH2Cl - NaHCO3 - (C2H5)2NH2HCO3 - H2O об-
щее содержание ионов хлора равно молярной концентрации хлорида диэтиламмония, концентрация ионов натрия равна молярной концентрации гидрокарбоната
107
натрия в насыщенном растворе. Формулу для определения коэффициента использования ионов натрия выразим через мольное содержание компонентов:
U[Na+ ](%) = |
[(C2 H5 )2 NH2Cl] −[NaHCO3 ] |
|
100. |
(11. |
4) |
|||
|
[(C2 H5 )2 NH2Cl] |
|||||||
|
|
|
|
|
||||
Из формулы (11. 4) получаем |
|
|
|
|||||
[NaHCO3 ] = |
|
100 −U Na+ |
[(С2 H5 )2 NH2Cl]. |
(11. |
5) |
|||
100 |
||||||||
|
|
|
|
|
|
|||
Из уравнения (11. 5) следует, что изолинии коэффициентов использования ионов натрия представляют собой прямые линии, исходящие из вершины солевого треугольника состава, отвечающей гидрокарбонату диэтиламмония.
Для вывода уравнения изолиний коэффициента использования ионов натрия в четверной системе NaCl - (C2H5)2NH2Cl - NaHCO3 - H2O в формулу (11. 3) подставим содержания ионов натрия и хлора, выраженные через молярные концентрации компонентов:
U[Na+ ](%) = |
[(C2 H5 )2 NH2Cl]+[NaCl]−[NaHCO3 ]−[NaCl] |
|
100 . |
(11. |
6) |
||||||
|
|
|
|||||||||
|
|
|
[NaCl]+[(C2 H5 )2 NH2Cl] |
|
|
|
|||||
Преобразовав уравнение (11. 4), получим |
|
|
|
|
|
|
|||||
[NaHCO3 ] = |
100 |
[(C2 H5 )2 NH2Cl]− |
|
100U Na+ |
|
|
|
||||
|
|
|
|
|
. |
|
|
(11. |
7) |
||
100 −U Na+ |
100 |
|
|
|
|||||||
|
|
−U Na+ |
|
|
|
||||||
Уравнение (11. 7) также отображает линейную зависимость концентрации гидрокарбоната натрия от концентрации хлорида диэтиламмония на изолинии коэффициента использования ионов натрия.
Вразрезе, представленном стабильной парой солей, формулы (11. 5) и (11.
7)идентичны. Следовательно, изолинии коэффициента использования ионов на-
трия в системе NaCl - (C2H5)2NH2Cl - NaHCO3 - H2O выходят из тех же точек на диагонали, в которых заканчиваются в системе (C2H5)2NH2Cl - NaHCO3 -
(C2H5)2NH2HCO3 - H2O.
Основным методом определения составов равновесных твердых фаз являлся видоизмененный метод остатков, составы жидких фаз определяли аналитически. Поскольку в процессе насыщения гидрокарбонаты натрия и диэтиламмония в растворе подвергаются частичной декарбонизации, опыты производили в токе диоксида углерода. Исходную навеску помещали в сосуд, снабженный термостатируемой рубашкой, механической мешалкой и приспособлением для барботирования диоксида углерода.
Установление равновесия определяли по постоянству трех измерений показателя преломления насыщенного раствора, производимых через 30 минут на рефрактометре RL1. Измерения начинали производить после полутора часов от начала опыта. После установления равновесия перемешивание прекращали, давали раствору осветлиться и отбирали образцы жидкой фазы на анализ в мерные
108
колбы с дистиллированной водой.
Плотность насыщенных растворов при 10°С определяли пикнометрическим методом. Разброс экспериментальных значений плотностей насыщенных растворов не превышал 0.003 г/мл. Постоянные значения показателей преломления ( n10D ) и плотностей насыщенных растворов сведены в соответствующие таблицы.
С целью уменьшения затрат времени на определение составов эвтонических растворов, линий моновариантных равновесий на изотермах четверной взаимной системы проводили планирование эксперимента (см. ниже).
Содержание ионов натрия в насыщенных растворах определяли пламеннофотометрическим методом. Определение содержания хлорид-ионов проводили аргентометрическим потенциометрическим титрованием. Содержания карбонат- и гидрокарбонат-ионов определяли прямым потенциометрическим ацидометрическим титрованием.
При вычислениях составов исследуемых жидких фаз использовали уравнение ионного баланса для определения содержания ионов диэтиламмония.
11. 2. Тройные оконтуривающие системы
Система (C2H5)2NH2Cl - (C2H5)2NH2HCO3 - H2O. Данные о растворимости
всистеме (C2H5)2NH2Cl - (C2H5)2NH2HCO3 - H2O при 10°С в доступных литературных источниках не обнаружены. Полученные нами результаты исследований растворимости при 10 и 25°С сведены в табл. 11. 2, 3 и изображены на рис. 11. 2, 3
ввиде комбинированных проекций. Изотермы растворимости имеют простой эвтонический тип.
Таблица 11. 2 Растворимость в системе (C2H5)2NH2Cl - (C2H5)2NH2HCO3 - H2O при 10°С
№ |
Плот- |
n10D |
Состав насыщенного раствора, % мас. |
Твердая |
|||
п/п |
íость, |
|
|||||
|
г/мл |
|
Et2NH2Cl |
Et2NH2HCO3 |
[Et2NH2]2CO3 |
H2O |
фаза |
1 |
1.084 |
1.4127 |
– |
55.4 |
2.0 |
42.6 |
Et2NH2HCO3 |
2 |
1.073 |
1.4225 |
12.4 |
46.3 |
2.8 |
38.5 |
-"- |
3 |
1.064 |
1.4260 |
21.5 |
39.5 |
2.1 |
36.9 |
-"- |
4 |
1.043 |
1.4345 |
36.6 |
31.1 |
1.2 |
31.1 |
-"- |
5 |
1.036 |
1.4401 |
47.9 |
23.4 |
0.5 |
28.2 |
(Et)2NH2HCO3+ |
|
|
|
|
|
|
|
(C2H5)2NH2Cl |
6 |
1.030 |
1.4386 |
54.8 |
14.5 |
0.3 |
30.4 |
(C2H5)2NH2Cl |
7 |
1.023 |
1.4374 |
59.6 |
8.3 |
0.0 |
32.1 |
-"- |
8 |
1.015 |
1.4369 |
66.1 |
– |
– |
33.9 |
-"- |
На ветвях растворимости гидрокарбоната диэтиламмония и в двойных эвтонических растворах отмечено появление существенных количеств карбоната диэтиламмония, которое возрастает при увеличении температуры. Кроме того, при 25°С карбонат диэтиламмония обнаруживается и на ветви кристаллизации хлорида диэтиламмония.
109
Таблица 11. 3 Растворимость в системе (C2H5)2NH2Cl - (C2H5)2NH2HCO3 - H2O при 25°С
№ |
Плот- |
|
|
|
|
|
п/п |
ность, |
Состав насыщенного раствора, % мас. |
Твердая |
|||
|
г/мл |
(Et)2NH2Cl |
(Et)2NH2HCO3 |
[(Et)2NH2]2CO3 |
H2O |
фаза |
1 |
1.088 |
– |
61.0 |
5.2 |
33.8 |
Et2NH2HCO3 |
2 |
1.069 |
13.6 |
48.9 |
6.3 |
31.2 |
-"- |
3 |
– |
19.0 |
40.3 |
11.3 |
29.4 |
-"- |
4 |
1.062 |
27.2 |
37.8 |
5.4 |
29.6 |
-"- |
5 |
1.044 |
40.0 |
30.8 |
3.6 |
25.6 |
-"- |
6 |
1.032 |
48.3 |
22.8 |
5.7 |
23.2 |
(Et)2NH2HCO3+ |
|
|
|
|
|
|
+(C2H5)2NH2Cl |
7 |
– |
48.6 |
17.8 |
9.2 |
24.4 |
(C2H5)2NH2Cl |
8 |
– |
49.9 |
20.8 |
4.2 |
25.1 |
-"- |
9 |
– |
60.3 |
7.0 |
2.4 |
30.3 |
-"- |
10 |
– |
69.8 |
– |
– |
30.2 |
-"- |
|
|
|
|
|
H2O |
|
|
|
|
|
|
|
|
|
|
|
(C2H5)2NH2Cl |
|
|
|
(C2H5)2NH2HCO3 |
e1 |
|
|
||
|
|
|
|
|
(C2H5)2NH2HCO3 + (C2H5)2NH2Cl |
|
||
0 |
|
|
20 |
|
40 |
60 |
80 |
100 |
(C H ) NH HCO |
3 |
% мас. |
|
(C2H5)2NH2Cl |
||||
2 |
5 |
2 |
2 |
|
|
|
|
|
|
|
|
|
H2O |
|
|
|
|
|
|
|
|
(C2H5)2NH2Cl |
|
(C2H5)2NH2HCO3 |
|
|
|
||
|
|
|
(C2H5)2NH2HCO3 + (C2H5)2NH2Cl |
|
||
0 |
|
20 |
40 |
60 |
80 |
100 |
(C H ) NH HCO |
3 |
% мас. |
(C2H5)2NH2Cl |
|||
2 |
5 2 |
2 |
|
|
|
|
Рис. 11. 2. Растворимость в системе |
Рис. 11. 3. Растворимость в системе |
(C2H5)2NH2HCO3 - (C2H5)2NH2Cl - H2O |
(C2H5)2NH2HCO3 - (C2H5)2NH2Cl - H2O |
при 10°С |
при 25°С |
Система (C2H5)2NH2HCO3 - NaHCO3 - H2O. Данные о растворимости в системе в доступных нам литературных источниках отсутствуют.
Полученные нами экспериментальные данные, сведенные в табл. 11. 4, 11. 5 и изображенные на рис. 11. 4, 11. 5 в виде комбинированных проекций, показывают значительное содержание карбоната диэтиламмония в насыщенных растворах системы при 10 и 25°С. Максимальные концентрации карбоната диэтиламмония наблюдаются в насыщенных растворах относительно гидрокарбоната диэтиламмония и в двойных эвтонических растворах, насыщенных относительно гид-
110
рокарбонатов натрия и диэтиламмония. Изотермы растворимости системы имеют простой эвтонический тип.
Таблица 11. 4 Растворимость в системе (C2H5)2NH2HCO3 - NaHCO3 - H2O при 10°С
№ |
Плот- |
n10D |
|
|
Состав насыщенного раствора, % мас. |
|
|
Твердая |
|||||
п/п |
ность, |
|
|
|
|
|
|||||||
|
г/мл |
|
NaHCO3 |
(C2H5)2NH2HCO3 |
[(C2H5)2NH2]2CO3 |
|
H2O |
фаза |
|||||
1 |
1.054 |
1.3438 |
|
7.3 |
|
– |
|
– |
|
|
92.7 |
NaHCO3 |
|
2 |
1.047 |
1.3550 |
|
3.9 |
10.2 |
0.3 |
|
|
85.6 |
-"- |
|||
3 |
1.050 |
1.3690 |
|
1.8 |
20.8 |
0.5 |
|
|
76.9 |
-"- |
|||
4 |
1.061 |
1.3845 |
|
0.7 |
33.8 |
1.0 |
|
|
64.5 |
-"- |
|||
5 |
1.078 |
1.3980 |
|
0.4 |
42.5 |
1.8 |
|
|
55.3 |
-"- |
|||
6 |
1.088 |
1.4128 |
|
0.2 |
55.8 |
1.9 |
|
|
42.1 |
NaHCO3 + |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
Et2NH2HCO3 |
7 |
1.084 |
1.4127 |
|
– |
55.4 |
2.0 |
|
|
42.6 |
Et2NH2HCO3 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 11. 5 |
|
Растворимость в системе (C2H5)2NH2HCO3 - NaHCO3 - H2O при 25°С |
||||||||||||
№ |
Плот- |
|
|
|
|
|
|
|
|
|
|
|
|
п/п |
ность, |
Состав насыщенного раствора (% мас.) |
|
|
Твердая |
||||||||
|
г/мл |
NaHCO3 |
(C2H5)2NH2HCO3 |
[(C2H5)2NH2]2CO3 |
H2O |
|
|
фаза |
|||||
1 |
1.052 |
4.40 |
|
|
12.60 |
1.00 |
82.00 |
|
|
NaHCO3 |
|||
2 |
1.054 |
2.40 |
|
|
23.80 |
0.66 |
73.14 |
|
|
-"- |
|||
3 |
1.063 |
1.10 |
|
|
33.60 |
2.10 |
63.20 |
|
|
-"- |
|||
4 |
1.071 |
0.49 |
|
|
44.60 |
2.00 |
52.91 |
|
|
-"- |
|||
5 |
1.083 |
0.24 |
|
|
62.90 |
3.70 |
33.16 |
|
(C2H5)2NH2HCO3+ |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
+NaHCO3 |
6 |
1.088 |
- |
|
|
61.00 |
5.20 |
33.80 |
|
(C2H5)2NH2HCO3 |
||||
Система NaCl - NaHCO3 - H2O. Данные по растворимость в системе NaCl- - NaHCO3 - H2O при 10°С в доступных литературных источниках не обнаружены. Полученные нами результаты исследований растворимости системы при 10°С сведены в табл. 11. 6 и изображены на рис. 11. 6. Изотерма растворимости системы имеет простой эвтонический тип. Содержание карбонат-ионов в составах насыщенных растворов не выявлено.
Система NaCl - (C2H5)2NH2Cl - H2O. Растворимость в данной системе при 10°С ранее не исследовалась. Полные данные о растворимости в системе при 10 и 25°С приведены в табл. 11. 7, 11. 8 и изображены на рис. 11. 7, 11. 8 соответственно. Изотермы растворимости имеют простой эвтонический тип. При обеих температурах поле кристаллизации хлорида диэтиламмония слабо развито, что свидетельствует о высоком высаливающем действии этой соли на хлорид натрия.
