
С.А. Мазунин, Г.С. Посягин ОСНОВЫ ФИЗИКО-ХИМИЧЕСКОГО АНАЛИЗА Часть 2. 1999г
..pdf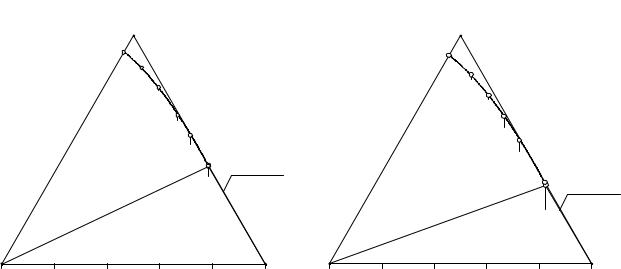
|
|
H2O |
|
|
|
|
|
|
NaHCO3 |
|
e2 |
(C2H5)2NH2HCO3 |
|
|
|
|
|
|||
|
|
|
|
|
||
|
|
NaHCO3+(C2H5)2NH2HCO3 |
|
|||
0 |
20 |
40 |
60 |
|
80 |
100 |
NaHCO3 |
|
% мас. |
|
(C2H5)2NH2HCO3 |
||
111 |
|
|
|
|
|
|
|
H2O |
|
|
|
|
|
NaHCO3 |
|
|
|
|
|
|
|
(C2H5)2NH2HCO3 |
|
|
|
NaHCO3+(C2H5)2NH2HCO3 |
|
||
0 |
20 |
40 |
60 |
80 |
100 |
NaHCO3 |
|
% мас. |
|
(C2H5)2NH2HCO3 |
|
Рис. 11. 4. Растворимость в системе |
Рис. 11. 5. Растворимость в системе |
(C2H5)2NH2HCO3 - NaHCO3 - H2O при 10°С |
(C2H5)2NH2HCO3 - NaHCO3 - H2O при 25°С |
11. 3. Разрезы системы (C2H5)2NH2+, Na+ // HCO3-, Cl- - H2O
Поверхности кристаллизации гидрокарбоната натрия при 10 и 25°С исследованы путем построения разрезов системы (C2H5)2NH2+, Na+ // HCO3-, Cl- - H2O через вершину NaHCO3. Данные о растворимости в разрезах системы сведены в табл. 11. 9 - 11. 14.
Таблица 11. 6 Растворимость в системе NаСl - NаНСО3 - Н2О при 10°C
№ |
Плотность, |
Состав насыщенного раствора, |
|
||
п/п |
г/мл |
|
% мас. |
|
Твердая |
|
|
NaCl |
NaHCO3 |
H2O |
фаза |
1 |
1.054 |
– |
7.3 |
92.7 |
NaHCO3 |
2 |
1.062 |
3.5 |
5.3 |
91.2 |
-"- |
3 |
1.080 |
8.5 |
3.1 |
88.4 |
-"- |
4 |
1.105 |
12.8 |
2.0 |
85.2 |
-"- |
5 |
1.136 |
16.6 |
1.5 |
81.9 |
-"- |
6 |
1.152 |
19.1 |
1.2 |
79.7 |
-"- |
7 |
1.171 |
21.7 |
1.0 |
77.3 |
-"- |
8 |
1.206 |
26.0 |
0.7 |
73.3 |
NaCl+NaHCO3 |
9 |
1.204 |
26.4 |
– |
73.6 |
NaCl |
|
|
|
|
|
|
|
|
|
H2O |
|
|
|
|
|
e3 |
NaCl |
|
|
|
NaHCO3 |
|
|
|
|
|
|
NaHCO3 + NaCl |
|
|
0 |
20 |
40 |
60 |
80 |
100 |
NaHCO3 |
|
% мас. |
|
NaCl |
|
|
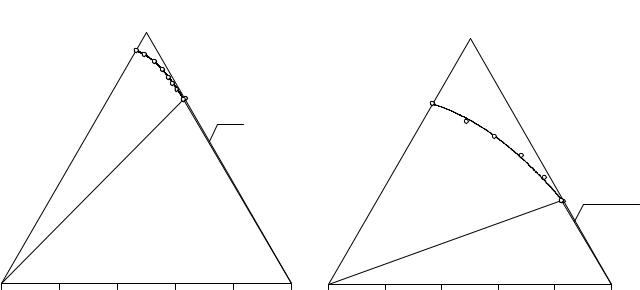
Рис. 11. 6. Растворимость в системе |
||||
|
NаСl - NаНСО3 - Н2О при 10°C |
||||
112 |
|
|
|
|
|
|
|
|
H2O |
|
|
|
|
NaCl |
|
(C2H5)2NH2Cl |
|
|
|
|
|
e4 |
|
|
|
|
|
|
|
|
|
|
NaCl + (C2H5)2NH2Cl |
|
|
0 |
20 |
40 |
60 |
80 |
100 |
NaCl |
|
|
% мас. |
(C2H5)2NH2Cl |
|
Рис. 11. 7. Растворимость в системе
NaCl - (C2H5)2NH2Cl - H2O при 10°С
Таблица 11. 7 Растворимость в системе NaCl - (C2H5)2NH2Cl - H2O при 10°С
№ |
Плот- |
n10D |
Состав насыщенного раствора, |
Твердая |
||
п/п |
ность, |
|
|
% мас. |
|
|
|
г/мл |
|
NaCl |
(C2H5)2NH2Cl |
H2O |
фаза |
1 |
1.204 |
1.3812 |
26.4 |
– |
73.6 |
NaCl |
2 |
1.140 |
1.3889 |
18.2 |
15.7 |
66.1 |
-"- |
3 |
1.090 |
1.3989 |
11.3 |
28.6 |
60.1 |
-"- |
4 |
1.053 |
1.4105 |
5.6 |
42.0 |
52.4 |
-"- |
5 |
1.029 |
1.4234 |
2.0 |
54.6 |
43.4 |
-"- |
6 |
1.019 |
1.4362 |
0.50 |
65.5 |
34.0 |
NaCl + (C2H5)2NH2Cl |
7 |
1.015 |
1.4369 |
– |
66.1 |
33.9 |
(C2H5)2NH2Cl |
Разрез (C2H5)2NH2Cl - NaHCO3 - H2O является стабильной диагональю четверной взаимной системы (C2H5)2NH2+, Na+ // HCO3-, Cl- - H2O. Результаты исследований растворимости при 10 и 25°Ñ представлены в табл. 11. 9, 11.10 и изображены на рис. 11. 9, 11.10 соответственно. Карбонат-ионы в насыщенных растворах системы не обнаружены. Изотерма растворимости имеет простой эвтонический тип. Выявлено значительное высаливающее действие хлорида диэтиламмония на гидрокарбонат натрия.
Исследование изотерм растворимости тройной системы позволило положительно ответить на вопрос о стабильном характере диагонального разреза четверной взаимной системы при 10 и 25°С и рассчитать равновесные коэффициенты использования ионов натрия при получении гидрокарбоната натрия со стехиометрическим соотношением исходных компонентов и различных способах синтеза и температурах.

113
|
|
|
|
|
|
Таблица 11. 8 |
|
Растворимость в системе NaCl - (C2H5)2NH2Cl - H2O при 25°С |
|||||
№ |
|
Состав насыщенного раствора, |
|
|
||
п/п |
|
|
% мас. |
|
Твердая |
|
|
NaCl |
|
(C2H5)2NH2Cl |
|
H2O |
фаза |
1 |
26.50 |
|
- |
|
73.50 |
NaCl |
2 |
19.00 |
12.20 |
|
68.80 |
-"- |
|
3 |
15.50 |
21.10 |
|
63.40 |
-"- |
|
4 |
13.00 |
26.10 |
|
60.90 |
-"- |
|
5 |
8.00 |
36.80 |
|
55.20 |
-"- |
|
6 |
5.00 |
52.50 |
|
42.50 |
-"- |
|
7 |
2.60 |
63.20 |
|
34.20 |
-"- |
|
8 |
0.51 |
66.00 |
|
33.49 |
-"- |
|
9 |
0.38 |
68.20 |
|
31.42 |
NaCl + (C2H5)2NH2Cl |
|
10 |
- |
69.80 |
|
30.20 |
(C2H5)2NH2Cl |
|
|
|
|
H2O |
|
|
|
|
NaCl |
|
|
(C2H5)2NH2Cl |
|
|
|
|
|
|
|
|
|
NaCl + (C2H5)2NH2Cl |
|
|
0 |
20 |
40 |
60 |
80 |
100 |
NaCl |
% мас. |
(C2H5)2NH2Cl |
|||
|
Рис. 11. 8. Растворимость в системе |
||||
|
NaCl - (C2H5)2NH2Cl - H2O при 25°С |
||||
|
|
|
H2O |
|
|
|
|
NaHCO3 |
|
(C2H5)2NH2Cl |
|
|
|
|
|
e5 |
|
|
|
|
|
|
|
|
|
|
NaHCO3 + (C2H5)2NH2Cl |
|
|
0 |
20 |
40 |
60 |
80 |
100 |
NaHCO |
|
% мас. |
(C2H5)2NH2Cl |
||
|
3 |
|
|
|
|
|
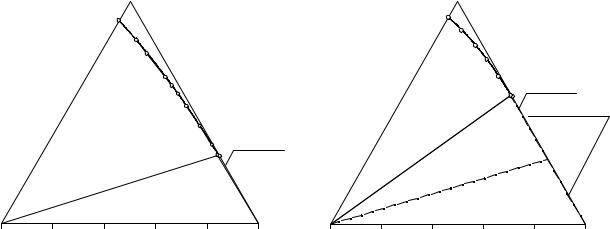
Рис. 11. 9. Растворимость в системе |
||||
|
(C2H5)2NH2Cl - NaHCO3 - H2O при 10°С |
||||
На рис. 11.11 приведена изотерма растворимости разреза S1 (78.4 % мас. (C2H5)2NH2Cl, 21.6 % мас. NaCl) - NaHCO3 - H2O при 10°С (см. табл. 11.11). Точка
A, представляющая собой пересечение линии двойного насыщения относительно хлорида и гидрокарбоната натрия четверной взаимной системы с плоскостью разреза, получена в результате интерполяции данных табл. 11.15. Аналогично получен и состав точки B – пересечение ветви растворимости хлорида натрия системы NaCl – (C2H5)2NH2Cl - H2O с плоскостью разреза.
Точки на линиях AC и CD получены в результате пересечения плоскости разреза с нодами, проходящими из вершины хлорида натрия к экспериментальным точкам на линиях двойного насыщения относительно хлорида и гидрокарбоната натрия, а также относительно хлоридов натрия и диэтиламмония соответст-
114
венно. Эти точки на рис. 11.11 изображены крестиками. Точки C и D имеют близкий состав и на рис. 11. 11 практически сливаются.
Таблица 11. 9 Растворимость в системе (C2H5)2NH2Cl - NaHCO3 - H2O при 10°С
№ |
Плот- |
n10D |
Состав насыщенного раствора, |
Твердая |
|||
п/п |
ность, |
|
|
% мас. |
|
||
|
г/мл |
|
(C2H5)2NH2Cl |
NaHCO3 |
H2O |
фаза |
|
1 |
1.054 |
1.3438 |
– |
|
7.3 |
92.7 |
NaHCO3 |
2 |
1.045 |
1.3632 |
14.9 |
4.9 |
80.2 |
-"- |
|
3 |
1.032 |
1.3858 |
30.8 |
2.7 |
66.5 |
-"- |
|
4 |
1.030 |
1.3959 |
37.8 |
1.8 |
60.4 |
-"- |
|
5 |
1.027 |
1.4083 |
45.2 |
1.3 |
53.5 |
-"- |
|
6 |
1.017 |
1.3731 |
64.9 |
0.6 |
34.5 |
NaHCO3+(C2H5)2NH2Cl |
|
7 |
1.015 |
1.4369 |
66.1 |
|
– |
33.9 |
(C2H5)2NH2Cl |
|
|
|
|
|
Таблица 11.10 |
|
Растворимость в системе (C2H5)2NH2Cl - NaHCO3 - H2O при 25°С |
||||
№ |
Состав насыщенного раствора, % мас. |
Твердая |
|||
п/п |
(C2H5)2NH2Cl |
NaHCO3 |
Na2CO3 |
H2O |
фаза |
1 |
0.00 |
8.70 |
0.30 |
91.00 |
NaHCO3 |
2 |
11.10 |
6.40 |
0.45 |
82.05 |
-"- |
3 |
18.30 |
5.30 |
0.35 |
76.05 |
-"- |
4 |
30.80 |
3.40 |
0.21 |
65.59 |
-"- |
5 |
35.10 |
2.80 |
0.16 |
61.94 |
-"- |
6 |
39.40 |
2.20 |
0.14 |
58.26 |
-"- |
7 |
45.50 |
1.70 |
0.08 |
52.72 |
-"- |
8 |
55.10 |
1.00 |
0.16 |
43.74 |
-"- |
9 |
64.10 |
0.52 |
0.12 |
35.26 |
-"- |
10 |
68.80 |
0.54 |
0.03 |
30.63 |
NaHCO3+(C2H5)2NH2Cl |
11 |
69.80 |
0.00 |
0.00 |
30.20 |
(C2H5)2NH2Cl |
На изотерме растворимости разреза выявлены следующие поля и фазовые области:
1)поле ненасыщенных растворов H2O-R-A-B-H2O;
2)поле кристаллизации гидрокарбоната натрия NaHCO3-R-A-NaHCO3;
3)область кристаллизации хлорида натрия A-B-D-C-A;
4)трехфазная область совместного существования насыщенного раствора
икристаллов хлорида и гидрокарбоната натрия NaHCO3-A-C-NaHCO3;
5)область совместной кристаллизации хлоридов натрия и диэтиламмония
S1-C-D-S1;
6) четырехфазная область совместного существования тройного эвтонического раствора (Е1, рис. 11. 16), кристаллов гидрокарбоната натрия, хлоридов натрия и диэтиламмония NaHCO3-С-S1-NaHCO3.
115
Таблица 11.11
Растворимость в разрезе S1 ( 78.4 % мас. (C2H5)2NH2Cl, 21.6 % мас. NaCl) - - NaHCO3 - H2O при 10°С
№ |
|
Плот- |
n10D |
|
Состав насыщенного раствора, % мас. |
Твердая |
|||||||||
п/п |
|
ность, |
|
|
|||||||||||
|
|
г/мл |
|
|
NaCl |
(C2H5)2NH2Cl |
NaHCO3 |
|
H2O |
фаза |
|||||
1 |
|
1.054 |
1.3438 |
|
– |
|
– |
7.3 |
|
92.7 |
|
NaHCO3 |
|||
2 |
1.051 |
1.3532 |
1.8 |
6.4 |
|
5.1 |
|
86.7 |
|
-"- |
|||||
3 |
1.053 |
1.3648 |
3.6 |
13.2 |
|
2.9 |
|
80.3 |
|
-"- |
|||||
4 |
1.056 |
1.3767 |
5.3 |
19.2 |
|
1.6 |
|
73.9 |
|
-"- |
|||||
5 |
1.064 |
1.3889 |
7.1 |
25.8 |
|
0.8 |
|
66.3 |
|
-"- |
|||||
6 |
1.081 |
1.4020 |
9.1 |
33.0 |
|
0.3 |
|
57.6 |
|
NaHCO3+NaCl |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 11.12 |
Растворимость в разрезе S2 ( 66 % мас. (C2H5)2NH2Cl; 34 % мас. (C2H5)2NH2HCO3) - - |
|||||||||||||||
|
|
|
|
|
|
|
|
NaHCO3 -H2O при 10°С |
|
|
|
|
|||
№ |
|
n10D |
|
Состав насыщенного раствора, % мас. |
|
|
|
Твердая |
|||||||
п/п |
|
|
Et2NH2Cl |
NaHCO3 |
|
Et2NH2HCO3 |
[Et2NH2]2HCO3 |
H2O |
|
фаза |
|||||
1 |
1.3438 |
|
– |
|
7.3 |
|
– |
|
– |
|
92.7 |
|
NaHCO3 |
||
2 |
1.3600 |
|
9.0 |
4.2 |
4.9 |
|
0.0 |
|
81.9 |
|
-"- |
||||
3 |
1.3790 |
|
18.6 |
1.7 |
9.8 |
|
0.0 |
|
69.9 |
|
-"- |
||||
4 |
1.3988 |
|
28.3 |
0.5 |
13.3 |
|
0.8 |
|
57.1 |
|
-"- |
||||
5 |
1.4203 |
|
37.3 |
0.2 |
18.3 |
|
0.8 |
|
43.4 |
|
-"- |
||||
6 |
1.4398 |
|
46.9 |
0.1 |
22.4 |
|
1.3 |
|
29.3 |
|
NaHCO3+Et2NH2Cl+ |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+Et2NH2HCO3 |
|
|
|
H2O |
|
|
|
|
NaHCO3 |
|
(C2H5)2NH2Cl |
|
|
|
|
|
|
|
|
|
|
NaHCO3 + (C2H5)2NH2Cl |
|
|
0 |
20 |
40 |
60 |
80 |
100 |
NaHCO |
|
% мас. |
(C2H5)2NH2Cl |
||
|
3 |
|
|
|
|
|
Рис. 11.10. Растворимость в системе |
||||
(C2H5)2NH2Cl - NaHCO3 - H2O при 25°С |
|||||
|
|
|
H2O |
|
|
|
|
|
R |
(1) |
|
|
|
|
|
NaHCO3 (2) |
|
NaCl (3) |
||
|
|
|
A |
B |
||
|
|
|
|
|
||
|
|
|
|
|
NaCl + (C2H5)2NH2Cl (5) |
|
|
|
|
|
+ |
|
|
|
|
NaCl + NaHCO (4) |
|
C + D |
|
|
|
|
|
3 |
|
|
|
|
|
(C2H5)2NH2Cl + NaCl + NaHCO3 (6) |
|
|||
0 |
20 |
40 |
60 |
|
80 |
100 |
NaHCO |
% мас. |
|
|
S1 |
||
|
3 |
|
|
|
|
|
|
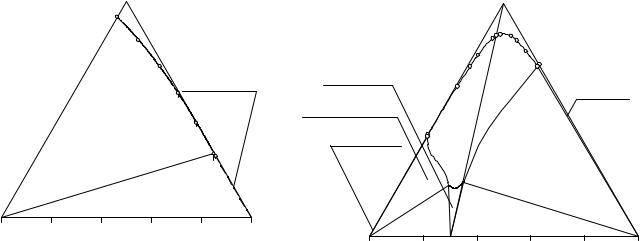
Рис. 11.11. Растворимость в разрезе |
|||||
NaHCO3 - S1 ( 78.4 % мас. (C2H5)2NH2Cl, |
||||||
|
21.6 % мас. NaCl) - H2O при 10°С |
|||||
Поля 1 и 2 отличаются от фазовых областей 3-6 тем, что в этих полях по диаграмме разреза можно непосредственно определить составы равновесных фаз для любой фигуративной точки исходной реакционной смеси. Для точек же, на-
116
ходящихся внутри какой-либо из фазовых областей 3-6, по диаграмме можно лишь судить о том, какие фазы возникнут из данной реакционной смеси, но невозможно определить составы этих фаз, так как они не находятся в плоскости данного разреза. Области 3-6 можно назвать "квазиполями".
|
|
|
H2O |
|
|
|
|
R |
(1) |
|
|
|
|
|
|
(C2H5)2NH2Cl + |
|
|
|
|
|
+ (C2H5)2NH2HCO3 (3) |
|
|
|
NaHCO3 (2) |
|
|
|
|
|
|
|
E2 |
e |
|
|
|
|
|
1 |
|
(C2H5)2NH2Cl + (C2H5)2NH2HCO3 + NaHCO3 (4) |
||||
0 |
20 |
40 |
60 |
80 |
100 |
NaHCO3 |
|
% мас. |
|
S2 |
|
Рис. 11.12. Растворимость в разрезе
NaHCO3 - S2 ( 66 % мас. (C2H5)2NH2Cl; 34 % мас. (C2H5)2NH2HCO3) - H2O при 10°С
|
|
|
|
|
|
|
H2O |
|
|
|
|
|
|
|
|
|
|
(1) |
|
|
|
|
|
|
|
|
|
|
G |
R2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Et2NH2Cl+NaHCO3 (6) |
|
|
NaHCO3 |
|
|
||||
|
|
|
(4) |
D |
|
NaCl (3) |
||||
|
|
|
|
|
|
|
|
|
|
|
Et NH HCO +NaHCO |
(5) |
|
|
++ |
|
|
|
|||
2 |
2 |
3 |
3 |
|
R1 |
|
|
|
|
|
|
(C2H5)2NH2HCO3 (2) |
A |
+ |
|
|
|
||||
|
|
+ |
|
|
|
|||||
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
NaCl + NaHCO3 (7) |
|
|
|
|
|
|
|
|
|
++B |
|
|
||
|
|
|
|
|
|
+ + |
+ |
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
NaHCO3+ |
|
|
|
|
|
|
|
|
|
|
+Et2NH2Cl+ |
|
|
|
|
|
|
|
|
|
+Et2NH2HCO3 (9) (C2H5)2NH2Cl + NaCl + NaHCO3(8) |
|
|||||
|
|
|
0 |
|
20 |
F |
40 |
60 |
80 |
100 |
|
|
|
|
|
||||||
|
|
|
(C2H5)2NH2HCO3 |
% мас. |
|
|
NaCl |
|||
|
|
Рис. 11. 13. Растворимость в разрезе NaCl - |
||||||||
|
|
(C2H5)2NH2HCO3 - H2O при 10°С |
|
|
||||||
На рис. 11.12 приведена изотерма растворимости разреза NaHCO3-S2 (66 %
мас. (C2H5)2NH2Cl, 34 % мас. (C2H5)2NH2HCO3 ) - H2O при 10°С (см. табл. 11.12).
Данный разрез проходит через составы тройного эвтонического раствора, насыщенного относительно хлорида диэтиламмония, гидрокарбонатов натрия и диэтиламмония (E2), и двойного эвтонического раствора, насыщенного относительно гидрокарбоната и хлорида диэтиламмония (e1).
На изотерме растворимости разреза выявлены следующие фазовые облас-
ти:
1)поле ненасыщенных растворов H2O-R-E2-e1-H2O;
2)поле кристаллизации гидрокарбоната натрия NaHCO3-R-E2-NaHCO3;
3)трехфазная область ("квазиполе") совместного существования насыщенного раствора и кристаллов хлорида и гидрокарбоната диэтиламмония S2-E2-e1-S5;
4)четырехфазная область ("квазиполе") совместного существования трой-
ного эвтонического раствора (E2), кристаллов хлорида диэтиламмония, гидрокарбонатов натрия и диэтиламмония NaHCO3-E2-S2-NaHCO3.
На рис. 11.11 и 11.12 границы полей проведены сплошными, а квазиполей
–пунктирными линиями.
На рис. 11.13 изображена растворимость в нестабильном диагональном разрезе NaCl - (C2H5)2NH2HCO3 - H2O. Комбинированная проекция разреза построена по данным о растворимости в оконтуривающих тройных системах, разрезах и в четверной взаимной системе при 10°С. Точки пересечения плоскости раз-
117
реза с поверхностями кристаллизации индивидуальных солей и линиями двойного насыщения системы (C2H5)2NH2+, Na+ // HCO3-, Cl- - H2O изображены кружками, а точки пересечения нод, проходящих в вершину NaHCO3, – крестиками.
Линия F-H2O является пересечением плоскости данного разреза с плоскостью стабильного диагонального разреза NaHCO3 - (C2H5)2NH2Cl - H2O, это линия эквимолярных соотношений хлорида натрия и гидрокарбоната диэтиламмония.
На изотерме растворимости нестабильного диагонального разреза NaCl - (C2H5)2NH2HCO3 -H2O выявлены следующие фазовые области:
1)поле ненасыщенных растворов H2O-R1-A-G-D-R2-H2O;
2)поле кристаллизации гидрокарбоната диэтиламмония (C2H5)2NH2HCO3 -
R1-A-(C2H5)2NH2HCO3;
3)поле кристаллизации хлорида натрия NaCl-R2-D-NaCl;
4)квазиполе кристаллизации гидрокарбоната натрия A-B-C-D-G-A;
5)трехфазная область (квазиполе) совместного существования насыщенного раствора и кристаллов гидрокарбонатов натрия и диэтиламмония
(C2H5)2NH2HCO3-A-B-(C2H5)2NH2HCO3;
6)квазиполе кристаллизации хлорида диэтиламмония и гидрокарбоната натрия F-B-C-F;
7)трехфазная область (квазиполе) совместного существования насыщенного раствора и кристаллов гидрокарбоната и хлорида натрия NaCl-C-D- NaCl;
8)четырехфазная область (квазиполе) совместного существования тройно-
го эвтонического раствора (E1), кристаллов гидрокарбоната натрия, хлоридов натрия и диэтиламмония F-C-NaCl-F;
9)четырехфазная область (квазиполе) совместного существования тройно-
го эвтонического раствора (E2), кристаллов хлорида диэтиламмония, гидрокарбонатов натрия и диэтиламмония F-B-(C2H5)2NH2HCO3-F.
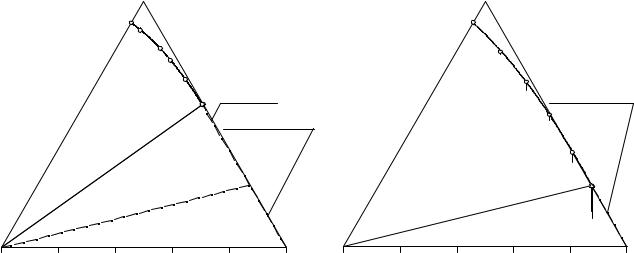
Все разрезы с избытком хлорида натрия при 25°С (см. табл. 11.13) имеют одинаковую структуру. На рис. 11.14 для примера приведена изотерма раствори-
мости разреза NaHCO3- S3(75 % (C2H5)2NH2Cl, 25 % NaCl) - H2O. Точка A, пред-
ставляющая собой пересечение линии двойного насыщения относительно хлорида
игидрокарбоната натрия четверной взаимной системы с плоскостью разреза, получена в результате интерполяции данных табл. 11.16. Аналогично получен и состав точки B – пересечение линии насыщения относительно хлорида натрия сис-
темы NaCl – (C2H5)2NH2Cl - H2O с плоскостью разреза.
Точки на линиях AC и CD получены в результате пересечения плоскости разреза с нодами, проходящими из вершины хлорида натрия к экспериментальным точкам на линиях двойного насыщения относительно хлорида и гидрокарбоната натрия, а также относительно хлоридов натрия и диэтиламмония соответственно. Эти точки на рис. 11.14 изображены крестиками. Точки C и D имеют близкий состав и на рис. 11.14 практически сливаются.
|
|
|
|
|
|
|
|
118 |
|
|
|
|
|
|
|
|
|
H2O |
|
|
|
|
|
|
|
H2O |
|
|
|
|
|
R |
(1) |
|
|
|
|
|
|
R |
(1) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NaHCO3(2) |
B |
NaCl(3) |
|
|
|
|
|
(С2H5)2NH2HCO3+ |
||||
|
|
|
|
|
|
|
|
|
+(С2H5)2NH2Cl(3) |
|||||
|
|
|
|
A + |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+NaCl+(C2H5)2NH2Cl(5) |
|
|
|
|
|
|
||||
|
|
|
|
|
+ |
|
|
|
|
NaHCO3(2) |
|
|
|
|
|
|
NaCl + NaHCO3(4) |
C |
+ |
D |
|
|
|
|
|
E2 |
e |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
(C2H5)2NH2Cl+NaCl+NaHCO3(6) |
|
|
|
|
(C2H5)2NH2Cl+(C2H5)2NH2HCO3+NaHCO3(4) |
|||||||
0 |
20 |
40 |
|
60 |
80 |
|
100 |
0 |
20 |
40 |
|
60 |
80 |
100 |
NaHCO |
% мас. |
|
|
|
S3 |
NaHCO |
3 |
% мас. |
|
|
S5 |
|||
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 11. 14. Растворимость в разрезе |
Рис. 11. 15. Растворимость в разрезе |
||||||||||||
|
S3 (75 % (C2H5)2NH2Cl, 25 % NaCl) - |
|
S5 (62% (C2H5)2NH2Cl, 38 % |
|||||||||||
|
|
- NaHCO3 - H2O при 25°С |
|
(C2H5)2NH2HCO3 ) - NaHCO3 - H2O при 25°С |
||||||||||
На изотерме растворимости разреза выявлены следующие поля и фазовые области:
1)поле ненасыщенных растворов H2O-R-A-B-H2O;
2)поле кристаллизации гидрокарбоната натрия NaHCO3-R-A-NaHCO3;
3)область кристаллизации хлорида натрия A-B-D-C-A;
4)трехфазная область совместного существования насыщенного раствора
икристаллов хлорида и гидрокарбоната натрия NaHCO3-A-C-NaHCO3;
5)область совместной кристаллизации хлоридов натрия и диэтиламмония
S3-C-D-S3;
6) четырехфазная область совместного существования тройного эвтонического раствора (Е1, рис. 11. 17), кристаллов гидрокарбоната натрия, хлоридов натрия и диэтиламмония NaHCO3-С-S3-NaHCO3.
Поля 1 и 2 отличаются от фазовых областей 3-6 тем, что в этих полях по диаграмме разреза можно непосредственно определить составы равновесных фаз для любой фигуративной точки исходной реакционной смеси. Для точек же, находящихся внутри какой-либо из фазовых областей 3-6 по диаграмме можно лишь судить о том, какие фазы возникнут из данной реакционной смеси, но невозможно определить составы этих фаз, так как они не находятся в плоскости данного разреза.
На рис. 11. 15 приведена изотерма растворимости разреза NaHCO3-S5 (62% (C2H5)2NH2Cl, 38 % (C2H5)2NH2HCO3 ) - H2O (см. табл. 11. 14) при 25°С. Данный разрез проходит через составы тройного эвтонического раствора, насыщенного относительно хлорида диэтиламмония, гидрокарбонатов натрия и диэтиламмония (E2), и двойного эвтонического раствора, насыщенного относительно гидрокарбоната и хлорида диэтиламмония (e4).
119
Таблица 11. 13 Растворимость в разрезах системы (C2H5)2NH2+, Na+ // HCO3-, Cl- - H2O
при 25°С с избытком хлорида натрия
№ |
|
Состав насыщенного раствора, % мас. |
|
Твердая |
||||
п/п |
NaCl |
|
(C2H5)2NH2Cl |
NaHCO3 |
Na2CO3 |
|
H2O |
фаза |
|
|
Разрез NaHCO3 - S1 ( 25 % (C2H5)2NH2Cl, 75 % NaCl) - H2O |
||||||
1 |
0.00 |
0.00 |
8.70 |
0.30 |
|
91.00 |
NaHCO3 |
|
2 |
2.70 |
0.90 |
6.20 |
0.76 |
|
89.44 |
-"- |
|
3 |
7.40 |
2.50 |
3.30 |
0.60 |
|
86.20 |
-"- |
|
4 |
9.50 |
3.20 |
2.90 |
0.57 |
|
83.83 |
-"- |
|
5 |
14.00 |
4.70 |
1.80 |
0.26 |
|
79.24 |
-"- |
|
6 |
17.70 |
5.90 |
0.49 |
0.25 |
|
75.66 |
-"- |
|
7* |
20.80 |
6.90 |
0.82 |
0.00 |
|
71.48 |
NaHCO3+NaCl |
|
|
|
Разрез NaHCO3 - S2 ( 50 % (C2H5)2NH2Cl, 50 % NaCl) - H2O |
||||||
8 |
2.80 |
2.80 |
5.00 |
1.10 |
|
88.30 |
NaHCO3 |
|
9 |
6.40 |
6.40 |
3.60 |
0.53 |
|
83.07 |
-"- |
|
10 |
9.40 |
9.40 |
2.20 |
0.28 |
|
78.72 |
-"- |
|
11 |
13.00 |
13.00 |
1.20 |
0.12 |
|
72.68 |
-"- |
|
12 |
15.20 |
15.20 |
0.79 |
0.13 |
|
68.68 |
-"- |
|
13* |
17.20 |
17.20 |
0.66 |
0.00 |
|
64.94 |
NaHCO3+NaCl |
|
|
|
Разрез NaHCO3 - S3 ( 75 % (C2H5)2NH2Cl, 25 % NaCl) - H2O |
||||||
14 |
1.10 |
3.40 |
7.20 |
0.56 |
|
87.74 |
NaHCO3 |
|
15 |
3.80 |
11.40 |
3.90 |
0.35 |
|
80.55 |
-"- |
|
16 |
5.30 |
16.00 |
2.60 |
0.24 |
|
75.86 |
-"- |
|
17 |
7.60 |
22.90 |
1.30 |
0.16 |
|
68.04 |
-"- |
|
18* |
10.30 |
31.00 |
0.57 |
0.00 |
|
58.13 |
NaHCO3+NaCl |
|
|
|
Разрез NaHCO3 - S4 ( 90 % (C2H5)2NH2Cl, 10 % NaCl) - H2O |
||||||
19 |
0.56 |
5.00 |
7.00 |
0.91 |
|
86.53 |
NaHCO3 |
|
20 |
1.40 |
12.80 |
5.80 |
0.54 |
|
79.46 |
-"- |
|
21 |
2.10 |
18.90 |
3.80 |
0.00 |
|
75.20 |
-"- |
|
22 |
2.90 |
25.70 |
2.70 |
0.00 |
|
68.70 |
-"- |
|
23 |
4.40 |
39.80 |
0.44 |
0.00 |
|
55.36 |
-"- |
|
24 |
4.70 |
42.10 |
0.50 |
0.00 |
|
52.70 |
-"- |
|
25* |
4.80 |
43.10 |
0.50 |
0.00 |
|
51.60 |
NaHCO3+NaCl |
|
* – составы вычислены по экспериментальным точкам на линии двойного насыщения относительно хлорида и гидрокарбоната натрия.
На изотерме растворимости разреза выявлены следующие поля и фазовые области:
Таблица 11. 14.
120
Растворимость в разрезе S5 ( 62 % (C2H5)2NH2Cl; 38 % (C2H5)2NH2HCO3) - - NaHCO3 - H2O при 25°С
№ |
|
Состав насыщенного раствора, % мас. |
|
Твердая |
|||
п/п |
(Et)2NH2Cl |
NaHCO3 |
(Et)2NH2HCO3 |
[(Et)2NH2]2HCO3 |
H2O |
фаза |
|
1 |
10.00 |
|
4.80 |
5.60 |
0.50 |
79.10 |
NaHCO3 |
2 |
19.90 |
1.80 |
10.60 |
1.50 |
66.20 |
-"- |
|
3 |
28.80 |
0.55 |
16.40 |
1.00 |
53.25 |
-"- |
|
4 |
39.10 |
0.12 |
21.50 |
1.60 |
37.68 |
-"- |
|
5 |
48.10 |
0.03 |
23.70 |
4.50 |
23.67 |
NaHCO3+Et2NH2Cl+ |
|
|
|
|
|
|
|
|
+(C2H5)2NH2HCO3 |
1)поле ненасыщенных растворов H2O-R-E2-e4-H2O;
2)поле кристаллизации гидрокарбоната натрия NaHCO3-R-E2-NaHCO3;
3)трехфазная область совместного существования насыщенного раствора
икристаллов хлорида и гидрокарбоната диэтиламмония S5-E2-e4-S5;
4)четырехфазная область совместного существования тройного эвтонического раствора (E2), кристаллов хлорида диэтиламмония, гидрокарбонатов натрия
идиэтиламмония NaHCO3-E2-S5-NaHCO3.
Поля 1 и 2 отличаются от фазовых областей 3 и 4 (квазиполей) тем, что в этих полях по диаграмме разреза можно непосредственно определить составы равновесных фаз для любой фигуративной точки исходной реакционной смеси.
На рис. 11.14 и 11.15 границы полей 1 и 2 проведены сплошными, а квазиполей – пунктирными линиями.
11.4. Четверная взаимная система (C2H5)2NH2+, Na+ // HCO3-, Cl- - H2O
Всоставах насыщенных растворов четверной взаимной системы имеются карбонат-ионы, содержание которых, в полном соответствии с теорией, возрастает в присутствии гидрокарбоната диэтиламмония - соли, образованной слабым основанием и слабой кислотой, и уменьшается в присутствии хлорида натрия - соли, образованной сильным основанием и сильной кислотой.
Наличие карбонат-ионов в насыщенных растворах увеличивает вариант-
ность всех фазовых равновесий на единицу, а система становится пятерной взаимной: (C2H5)2NH2+, Na+ // HCO3-, CO32-, Cl- - H2O. Увеличение вариантности фазовых равновесий делает необходимым приведение в итоговой таблице в качестве составов эвтонических растворов не средних, а экспериментально полученных составов с минимальным содержанием карбонат-ионов. Повышенный разброс экспериментальных данных на линиях моновариантного равновесия также объясняется увеличением вариантности равновесий.
Цифровой материал по растворимости в четверной взаимной системе при 10°С сведен в табл. 11. 15. Изотерма растворимости системы совместно с изолиниями коэффициента использования ионов натрия представлены на рис. 11. 16 в виде комбинированной проекции.
Таблица 11. 15
