
С.А. Мазунин, Г.С. Посягин ОСНОВЫ ФИЗИКО-ХИМИЧЕСКОГО АНАЛИЗА Часть 2. 1999г
..pdf121
Растворимость в системе (C2H5)2NH2+, Na+ // HCO3-, Cl- - H2O при 10°С
№ |
Плот- |
10 |
|
|
|
|
|
|
|
п/п |
ность, |
nD |
|
Состав насыщенного раствора, % мас |
|
Твердая |
|||
|
г/мл |
|
NaCl |
Et2NH2Cl |
NaHCO3 |
Et2NH2HCO |
[Et2NH2]2CO |
H2O |
фаза |
|
|
|
|
|
|
3 |
3 |
|
|
1 |
1.206 |
1.3815 |
26.0 |
– |
0.7 |
– |
– |
73.3 |
NaCl + NaHCO3 |
2 |
1.131 |
1.3915 |
16.1 |
18.5 |
0.5 |
– |
– |
64.9 |
-"- |
3 |
1.107 |
1.3955 |
14.2 |
22.5 |
0.5 |
– |
– |
62.8 |
-"- |
4 |
1.081 |
1.4020 |
9.1 |
33.0 |
0.3 |
– |
– |
57.6 |
-"- |
5 |
1.051 |
1.4125 |
4.9 |
43.4 |
0.3 |
– |
– |
51.4 |
-"- |
6 |
1.019 |
1.4362 |
0.5 |
65.5 |
– |
– |
– |
34.0 |
NaCl + Et2NH2Cl |
7 |
1.019 |
1.4364 |
0.3 |
65.1 |
0.3 |
– |
– |
34.3 |
NaCl + NaHCO3+ |
|
|
|
|
|
|
|
|
|
+ Et2NH2Cl |
8 |
1.017 |
1.3731 |
– |
64.9 |
0.6 |
– |
– |
34.5 |
NaHCO3 + Et2NH2Cl |
9 |
1.026 |
1.4385 |
– |
59.5 |
0.10 |
10.1 |
0.6 |
29.7 |
-"- |
10 |
1.041 |
1.4398 |
– |
46.9 |
0.1 |
22.4 |
1.3 |
29.3 |
Et2NH2Cl+NaHCO3+ |
|
|
|
|
|
|
|
|
|
+ Et2NH2HCO3 |
11 |
1.047 |
1.4350 |
– |
37.5 |
0.1 |
28.6 |
1.9 |
31.9 |
NaHCO3 +Et2NH2HCO3 |
12 |
1.052 |
1.4348 |
– |
32.3 |
0.1 |
31.5 |
2.3 |
33.8 |
-"- |
13 |
1.063 |
1.4260 |
– |
23.1 |
0.1 |
39.0 |
1.7 |
36.1 |
-"- |
14 |
1.076 |
1.4182 |
– |
11.5 |
0.2 |
49.9 |
1.0 |
37.4 |
-"- |
15 |
1.088 |
1.4128 |
– |
– |
0.2 |
55.8 |
1.9 |
42.1 |
-"- |
16 |
1.036 |
1.4401 |
– |
47.9 |
– |
23.4 |
0.5 |
28.2 |
Et2NH2Cl+Et2NH2HCO3 |
Практически всю площадь солевой части диаграммы состава занимает поле кристаллизации гидрокарбоната натрия, поля кристаллизации хлорида и гидрокарбоната диэтиламмония вырождены в линии, что свидетельствует о значительном высаливающем действии солей диэтиламмония на хлорид и гидрокарбонат натрия.
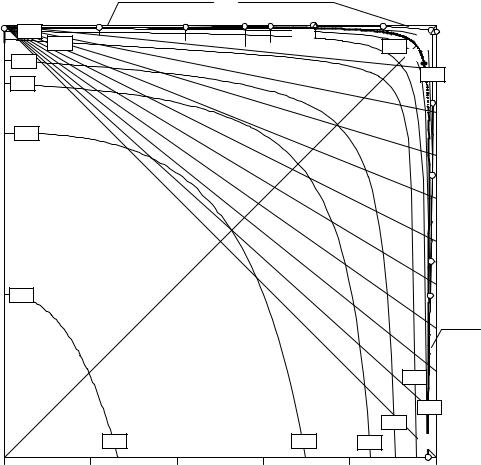
Интерполяция экспериментальных данных (см. табл. 11. 2, 11. 4, 11. 6-11. 8, 11.10-11.12, 11.15) методом наименьших квадратов позволила построить изогидрические линии на комбинированной проекции изотермы растворимости сис-
темы (C2H5)2NH2+, Na+ // HCO3-, Cl- - H2O (рис. 11. 16). Содержание воды на изо-
гидрических линиях (% моль) приведено на рис. 11. 16 в квадратных рамках. Ограниченный объем пособия не позволяет полностью привести промежу-
точные результаты построения изогидрических линий на изотерме растворимости четверной взаимной системы, но дает возможность описать алгоритм этих действий.
Прежде всего, данные, приведенные в табл. 11. 2-11.15, были пересчитаны в мольные проценты. Далее во всех оконтуривающих системах и разрезах при помощи метода наименьших квадратов строились функциональные зависимости вида [NaHCO3] = F[H2O], содержание третьего солевого компонента или смеси определяется разностью 100 - [NaHCO3] - [H2O]. Вычисляли содержание солевых компонентов в оконтуривающих системах и разрезах при интересующих количе-
|
|
|
|
|
122 |
|
|
|
|
ствах воды (98, 97 и т.д., значения, приведенные на рис. 11.16 в прямоугольных |
|||||||||
рамках), солевой состав всех полученных точек для каждой изогидрической ли- |
|||||||||
нии вновь обрабатывали методом наименьших квадратов и полученную функцию |
|||||||||
изображали на солевом квадрате состава. |
|
|
|
|
|||||
|
|
|
(Et)2NH2HCO3 |
(Et)2NH2Cl |
(Et)2NH2Cl |
||||
(Et)2NH2HCO |
F |
|
e1 |
||||||
e |
|
91 |
3 |
|
|
|
e4 |
||
|
93 |
· |
E2 |
|
E1 |
||||
2 |
|
|
|
UNa+ |
|||||
|
|
95 |
|
|
89 G |
||||
|
|
96 |
|
|
|
|
90 |
·87 90 |
|
|
|
97 |
|
|
|
|
80 |
|
80 |
|
|
|
|
|
|
70 |
|
70 |
|
|
|
|
|
|
|
60 |
|
|
|
|
|
|
|
|
|
50 |
|
|
60 |
|
|
|
|
|
40 |
|
|
|
|
|
|
|
NaHCO3 |
|
30 |
|
|
|
|
|
|
|
UNa+ |
20 |
|
|
|
50 |
|
|
|
|
|
10 |
|
|
|
||
|
|
|
|
|
0 |
|
|
|
|
|
|
98 |
|
|
|
|
|
|
40 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NaCl |
|
|
|
|
NaHCO3 |
|
|
93 |
20 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
95 |
91 |
10 |
|
|
|
98 |
|
|
97 |
H |
|
|
|
|
|
|
|
96 |
0 |
|||
|
|
|
|
|
|
|
|
|
|
|
0 |
|
20 |
40 |
60 |
|
80 |
e3 100 |
|
NaHCO3 |
% мол. |
|
|
NaCl |
|||||
Рис. 11. |
16. Комбинированная проекция изотермы растворимости четверной |
||||||||
взаимной системы (C2H5)2NH2+, Na+ // HCO3-, Cl- - H2O при 10°С |
|||||||||
Цифровой материал по растворимости в четверной взаимной системе при 25°С сведен в табл. 11.16. Изотерма растворимости системы совместно с изолиниями коэффициента использования ионов натрия представлены на рис. 11.17 в виде комбинированной проекции.
Практически всю площадь солевой части диаграммы состава занимает поле кристаллизации гидрокарбоната натрия, поля кристаллизации хлорида и гидрокарбоната диэтиламмония вырождены в линии, что свидетельствует о значительном высаливающем действии солей диэтиламмония на хлорид и гидрокарбонат натрия.
Таблица 11. 16.
123
Растворимость в системе (C2H5)2NH2+, Na+ // HCO3-, Cl- - H2O при 25°С
№ |
Плот- |
|
|
|
|
|
|
|
п/п |
ность, |
|
Состав насыщенного раствора, % мас |
|
Твердая |
|||
|
г/мл |
NaCl |
(Et)2NH2Cl |
NaHCO3 |
(Et)2NH2HCO3 |
[(Et)2NH2]2CO3 |
H2O |
фаза |
1 |
– |
20.3 |
10.6 |
0.80 |
– |
– |
68.30 |
NaHCO3 + NaС1 |
2 |
– |
18.1 |
13.9 |
0.70 |
– |
– |
67.30 |
-"- |
3 |
– |
16.8 |
18.2 |
0.62 |
– |
– |
64.38 |
-"- |
4 |
– |
9.2 |
33.3 |
0.53 |
– |
– |
56.97 |
-"- |
5 |
– |
5.9 |
40.1 |
0.57 |
– |
– |
53.43 |
-"- |
6 |
– |
2.9 |
51.7 |
0.40 |
– |
– |
45.00 |
-"- |
7 |
1.010 |
0.38 |
68.5 |
0.04 |
– |
– |
31.08 |
NaCl+NaHCO3+ |
|
|
|
|
|
|
|
|
+(Et)2NH2Cl |
8 |
– |
0.38 |
68.2 |
– |
– |
– |
31.42 NaCl+(Et)2NH2Cl |
|
9 |
1.009 |
– |
68.8 |
0.54 |
– |
– |
30.66 |
NaHCO3+ |
10 |
1.022 |
– |
55.2 |
0.04 |
15.6 |
2.3 |
26.86 |
+(Et)2NH2Cl |
-"- |
||||||||
11 |
1.032 |
– |
48.1 |
0.03 |
23.7 |
4.5 |
23.67 |
NaHCO3+ |
|
|
|
|
|
|
|
|
+ (Et)2NH2Cl + |
|
|
|
|
|
|
|
|
+ (Et)2NH2HCO3 |
12 |
1.044 |
– |
39.8 |
0.04 |
29.6 |
4.3 |
26.26 |
NaHCO3 + |
13 |
1.055 |
– |
26.1 |
0.05 |
39.9 |
4.2 |
29.75 |
+ (Et)2NH2HCO3 |
-"- |
||||||||
14 |
1.066 |
– |
19.2 |
0.06 |
47.1 |
3.2 |
30.44 |
-"- |
15 |
1.074 |
– |
9.7 |
0.10 |
52.7 |
4.9 |
32.60 |
-"- |
16 |
1.083 |
– |
– |
0.24 |
62.9 |
3.7 |
33.16 |
-"- |
17 |
1.032 |
– |
48.3 |
– |
22.8 |
5.7 |
23.20 |
(Et)2NH2Cl + |
|
|
|
|
|
|
|
|
+ (Et)2NH2HCO3 |
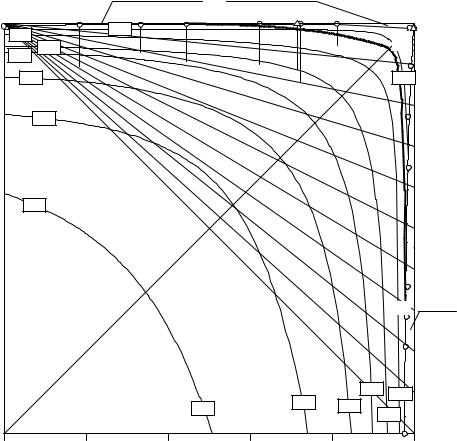
Интерполяция экспериментальных данных (см. табл. 11. 3, 11. 5, 11. 8, 11.10, 11.13-11.14, 11.16) методом наименьших квадратов позволила построить изогидрические линии на комбинированной проекции изотермы растворимости системы (C2H5)2NH2+, Na+ // HCO3-, Cl- - H2O (см. рис. 11. 17). Содержание воды на изогидрических линиях (% моль) приведено на рис. 11. 17 в квадратных рамках.
11. 5. Использование данных о растворимости в четверной взаимной системе (C2H5)2NH2+, Na+ // HCO3-, Cl- - H2O для технологических расчетов
Растворимость в четверной взаимной системе (C2H5)2NH2+, Na+//HCO3-, Cl- - -H2O моделирует процесс получения гидрокарбоната натрия из хлорида натрия, воды, диэтиламина и диоксида углерода в равновесных условиях. Коэффициенты использования ионов натрия можно рассчитать по формуле (11. 3), а диэтиламмония - по следующей формуле (%):
Ошибка!. |
(11. 8) |
|
|
|
|
124 |
|
|
|
|
|
(Et)2NH2HCO3 |
(Et)2NH2HCO3 |
(Et)2NH2Cl |
|
(Et)2NH2Cl |
|||
|
F |
e4 |
|
|||||
|
e3 |
91 |
87 |
E2 |
|
G |
E |
e2 |
|
|
94 93 |
|
|
|
1 |
UNa+ |
|
|
|
95 |
|
|
|
90·87 |
90 |
|
|
|
96 |
|
|
80 |
|
|
80 |
|
|
|
|
70 |
|
|
|
|
|
|
|
|
|
|
|
70 |
|
|
|
|
|
60 |
|
|
|
|
|
|
NaHCO3 |
50 |
|
|
|
60 |
|
|
|
40 |
|
|
|
|||
|
|
97 |
|
30 |
|
|
|
|
|
|
|
UNa+ |
1020 |
|
|
|
50 |
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
40 |
|
|
|
|
|
|
|
H NaCl |
|
|
|
|
NaHCO3 |
|
|
|
20 |
|
|
|
|
|
|
|
|
|
|
|
|
|
97 |
96 |
95 |
94 |
91 |
10 |
|
|
|
93 |
|
||||
|
|
|
|
|
|
0 |
||
|
|
|
|
|
|
|
|
|
|
0 |
20 |
40 |
60 |
80 |
|
e1 100 |
|
|
NaHCO3 |
% мол. |
|
|
NaCl |
|||
Рис. 11. |
17. Комбинированная проекция изотермы растворимости четверной |
|||||||
взаимной системы (C2H5)2NH2+, Na+ // HCO3-, Cl- - H2O при 25°С |
||||||||
Ионные составы растворов, насыщенных относительно гидрокарбоната натрия четверной взаимной системы (C2H5)2NH2+, Na+ // HCO3-, Cl- - H2O при 10°С, и коэффициенты использования ионов натрия и диэтиламмония этих растворов приведены в табл. 11. 17.
Анализ данных, приведенных в табл. 11. 17, показывает, что наибольший коэффициент использования ионов натрия имеет второй тройной эвтонический раствор, насыщенный относительно хлорида диэтиламмония, гидрокарбонатов натрия и диэтиламмония (U[Na+] = 99.86 %, U[Et2NH2+] = 70.43 %). Максималь-
ный коэффициент использования диэтиламмония наблюдается в первом тройном эвтоническом растворе, насыщенном относительно гидрокарбоната натрия, хло-
ридов натрия и диэтиламмония (U[Na+] = 98.45 %, U[(Et)2NH2+] = 99.34 %). Коэф-
фициент использования ионов диэтиламмония больше в первом тройном эвтоническом растворе, чем во втором на 28.91 %, в то время как коэффициент использования ионов натрия меньше всего лишь на 1.41%.
Таким образом, наиболее технологичным является проведение процесса синтеза гидрокарбоната натрия при соотношениях хлорида натрия к диэтиламину
125
в исходной реакционной смеси близких к стехиометрическим. Однако достичь максимальных коэффициентов использования ионов натрия и диэтиламмония можно только путем добавления к исходному насыщенному раствору хлорида натрия дополнительного количества кристаллического хлорида натрия.
Таблица 11. 17 Ионный состав и коэффициенты использования ионов натрия и диэтиламмония
растворов системы (C2H5)2NH2+, Na+ // HCO3-, Cl- - H2O при 10°С
|
|
Состав насыщенного |
Коэффициенты |
|
||||
|
Плот- |
раствора, моль/кг |
использования |
Твердая |
||||
№ |
ность, |
|
|
|
|
ионов, % |
||
п/п |
г/мл |
Na+ |
HCO3- |
CO32- |
Cl- |
U[Na+] |
U[(Et)2NH2+] |
фаза |
1 |
1.131 |
2.8152 |
0.0585 |
0.0000 |
4.4422 |
36.63 |
96.53 |
NaHCO3 + NaС1 |
2 |
1.107 |
2.4754 0.0531 0.0000 4.4764 |
44.70 |
97.41 |
-"- |
|||
3 |
1.081 |
1.5928 0.0395 0.0000 4.5610 |
65.08 |
98.69 |
-"- |
|||
4 |
1.051 |
0.8657 0.0358 0.0000 4.7861 |
81.91 |
99.10 |
-"- |
|||
5 |
1.019 |
0.0927 0.0391 0.0000 5.9927 |
98.45 |
99.34 |
NaCl+NaHCO3+Et2NH2Cl |
|||
6 |
1.017 |
0.0652 0.0652 0.0000 5.9171 |
98.90 |
98.90 |
NaHCO3 + (Et)2NH2Cl |
|||
7 |
1.026 |
0.0124 0.7562 0.0281 5.4307 |
99.77 |
86.96 |
-"- |
|||
8 |
1.041 |
0.0062 1.6663 0.0640 4.2795 |
99.86 |
70.43 |
NaHCO3 + Et2NH2Cl + |
|||
|
|
|
|
|
|
|
|
+ Et2NH2HCO3 |
9 |
1.047 |
0.0082 2.1269 0.0891 3.4195 |
99.76 |
59.68 |
NaHCO3 + (Et)2NH2HCO3 |
|||
10 |
1.052 |
0.0103 2.3424 0.1093 2.9514 |
99.65 |
53.46 |
-"- |
|||
11 |
1.063 |
0.0154 2.9035 0.0805 2.1049 |
99.27 |
40.54 |
-"- |
|||
В табл. 11.18 приведены вычисленные составы насыщенных растворов, получаемых из рассола хлорида натрия (305 г/л), диэтиламина и диоксида углерода, а также коэффициенты использования ионов натрия и диэтиламмония этих растворов. На комбинированной проекции изотермы растворимости системы (рис. 11. 16) эти составы соединены линией FGH. Данная кривая не пересекает линию двояконасыщенных растворов относительно хлорида и гидрокарбоната натрия и заканчивается на нестабильной диагонали, так как далее теряет химический смысл.
Нестабильная диагональ разделяет солевой квадрат четверной взаимной системы на два треугольника - с избытком хлорида диэтиламмония и с избытком гидрокарбоната натрия. Солевые составы насыщенных растворов, находящиеся в треугольнике с избытком хлорида диэтиламмония, могут быть получены синтетически из хлорида натрия, диэтиламина и диоксида углерода, а в солевые составы насыщенных растворов, находящиеся в треугольнике с избытком гидрокарбоната натрия, не могут быть получены из нестабильных солевых компонентов системы и требуют добавления избытка гидрокарбоната натрия, что не имеет химического смыла.
Если сравнить эту линию с аналогичной на изотерме растворимости системы (C2H5)2NH2+, Na+ // HCO3-, Cl- - H2O при 25°С (см. ниже), то можно заметить,
126
что при 10°С она ближе подходит к линиям двойного насыщения и эвтоническим растворам, а следовательно, для достижения максимальных коэффициентов использования ионов натрия и диэтиламмония потребуется добавление меньших количеств хлорида натрия к его концентрированному раствору (305 г/л), но больших энергетических затрат на охлаждение реакционной смеси.
Анализ данных, приведенных в табл. 11. 17, показывает, что коэффициент использования ионов натрия на линии FGH увеличивается с ростом соотношения амин / хлорид натрия и принимает максимальное значение 99.52 (точка F) при соотношении 2.07. Дальнейшее увеличение данного соотношения будет приводить к выпадению в осадок гидрокарбоната диэтиламмония.
Таблица 11. 18 Коэффициенты использования ионов натрия и диэтиламмония вычисленных рас-
творов, получаемых из раствора хлорида натрия (305 г/л) при 10°С
№ |
Соотношение |
Состав насыщенного |
Коэффициенты |
|
|
|
Ошибка! |
раствора, моль/кг |
использования |
Твердая |
|
|
|
|
ионов, % |
||
п/п |
в исходной |
Na+ HCO3- CO32- Cl- |
U[Na+] U[(Et)2NH2+] |
фаза |
|
|
реакционной |
|
|
|
|
|
смеси |
|
|
|
|
1 |
0.66 |
1.4190 0.0649 0.0000 3.9761 |
64.31 |
97.53 |
NaHCO3 |
2 |
1.00 |
0.1783 0.1783 0.0000 3.7686 |
95.27 |
95.27 |
-"- |
3 |
1.42 |
0.0238 1.2865 0.0423 3.2124 |
99.26 |
69.93 |
-"- |
4 |
2.07 |
0.0123 2.5673 0.1020 2.5850 |
99.52 |
48.14 |
NaHCO3 + |
+ Et2NH2HCO3
Максимальное значение (97.53 %) коэффициента использования иона диэтиламмония на линии FGH наблюдается при соотношении амин / хлорид натрия, равном 0.66, а затем уменьшается при увеличении этого соотношения. Причем при увеличении соотношения от 0.66 до 1.0 коэффициент использования диэтиламмония уменьшается на 2.26%, а коэффициент использования ионов натрия возрастает на 30.96 %. Дальнейшее увеличение соотношения амин / хлорид натрия приводит к резкому уменьшению коэффициента использования ионов диэтиламмония и росту потерь диэтиламина из-за испарения, что, на наш взгляд, является нецелесообразным.
Ионные составы растворов, насыщенных относительно гидрокарбоната натрия, и коэффициенты использования ионов натрия и диэтиламмония этих растворов при 25°С приведены в табл. 11. 19.
Анализ данных, приведенных в табл. 11. 19, показывает, что наибольший коэффициент использования ионов натрия имеет второй тройной эвтонический раствор, насыщенный относительно хлорида диэтиламмония, гидрокарбонатов натрия и диэтиламмония (U[Na+] = 99.91 %, U[(Et)2NH2+] = 66.73 %). Максималь-
ный коэффициент использования диэтиламмония наблюдается в первом тройном эвтоническом растворе, насыщенном относительно гидрокарбоната натрия, хло-
ридов натрия и диэтиламмония (U[Na+] = 98.89 %, U[(Et)2NH2+] = 99.92 %). Коэф-
127
фициент использования ионов диэтиламмония больше в первом тройном эвтоническом растворе, чем во втором на 33.19 %, в то время как коэффициент использования ионов натрия меньше всего лишь на 1.12%. Следовательно, наиболее технологичным является проведение процесса синтеза гидрокарбоната натрия при соотношениях хлорида натрия к диэтиламину в исходной реакционной смеси близких к стехиометрическим. Однако достичь этого можно только при добавлении к раствору хлорида натрия дополнительного количества кристаллического хлорида натрия.
Таблица 11. 19 Ионный состав и коэффициенты использования ионов натрия и диэтиламмония
растворов системы (C2H5)2NH2+, Na+ // HCO3-, Cl- - H2O при 25°С
№ |
Плот- |
Состав насыщенного |
Коэффициенты |
Твердая |
||||
п/п |
ность |
раствора, моль/кг |
использования |
фаза |
||||
|
, г/мл |
|
|
|
|
ионов, % |
|
|
|
|
Na+ |
HCO3- |
CO32- |
Cl- |
U[Na+] |
U[(Et)2NH2+ |
|
|
|
|
|
|
|
|
] |
|
1 |
– |
3.5672 |
0.0952 |
0.0000 |
4.4345 |
19.56 |
90.11 |
NaHCO3 + NaС1 |
2 |
– |
3.1857 |
0.0833 0.0000 4.3706 |
27.11 |
93.43 |
-"- |
||
3 |
– |
2.9554 |
0.0738 0.0000 4.5394 |
34.90 |
95.55 |
-"- |
||
4 |
– |
1.6356 |
0.0631 0.0000 4.6072 |
64.50 |
97.92 |
-"- |
||
5 |
– |
1.0689 |
0.0678 0.0000 4.6561 |
77.04 |
98.14 |
-"- |
||
6 |
– |
0.5438 |
0.0476 0.0000 5.2134 |
89.57 |
98.99 |
-"- |
||
7 |
1.010 |
0.0698 |
0.0048 0.0000 6.3114 |
98.89 |
99.92 |
NaCl+NaHCO3+ |
||
|
|
|
|
|
|
|
|
+(Et)2NH2Cl |
8 |
1.009 |
0.0691 |
0.0643 0.0024 6.2728 |
98.90 |
98.90 |
NaHCO3 + (Et)2NH2Cl |
||
9 |
1.022 |
0.0051 |
1.1623 0.1114 5.0400 |
99.90 |
78.43 |
-"- |
||
10 |
1.032 |
0.0038 |
1.7571 0.2153 4.3915 |
99.91 |
66.73 |
NaHCO3+(Et)2NH2Cl+ |
||
|
|
|
|
|
|
|
|
+(Et)2NH2HCO3 |
11 |
1.044 |
0.0047 |
2.1975 0.2049 3.6340 |
99.87 |
58.19 |
NaHCO3 + |
||
12 |
1.055 |
0.0055 |
2.9599 0.2009 2.3796 |
99.77 |
41.39 |
+(Et)2NH2HCO3 |
||
-"- |
||||||||
13 |
1.066 |
0.0075 |
3.4903 0.1531 1.7470 |
99.57 |
31.42 |
-"- |
||
14 |
1.074 |
0.0117 |
3.9129 0.2335 0.8853 |
98.68 |
16.63 |
-"- |
||
В табл. 11. 20 приведены вычисленные составы насыщенных растворов, получаемых из рассола хлорида натрия (305 г/л), диэтиламина и диоксида углерода, а также коэффициенты использования ионов натрия и диэтиламмония этих растворов. На комбинированной проекции изотермы растворимости системы при 25°С (рис. 11. 17) эти составы соединены линией FGH.
Анализ данных, приведенных в табл. 11. 20, показывает, что равновесный коэффициент использования ионов натрия увеличивается с ростом соотношения амин / хлорид натрия и принимает максимальное значение 99.7 при соотношении 2.49. Дальнейшее увеличение данного соотношения будет приводить к выпадению в осадок гидрокарбоната диэтиламмония. Значение коэффициента использо-

128
вания иона диэтиламмония сначала возрастает до 96.11 при соотношении амин / хлорид натрия, равном 0.82, а затем уменьшается. Причем при увеличении этого соотношения от 0.82 до стехиометрического коэффициент использования диэтиламмония уменьшается на 3.5%, а коэффициент использования ионов натрия возрастает на 13.41 %. Дальнейшее увеличение соотношения приводит к резкому уменьшению коэффициента использования ионов диэтиламмония и росту потерь диэтиламина из-за испарения, т.е. при уменьшении температуры максимальные равновесные коэффициенты использования ионов натрия тройных эвтонических растворов уменьшаются, что связано с падением растворимости хлорида диэтиламмония, образующегося в результате реакции эквимолярно гидрокарбонату натрия - целевого продукта.
Таблица 11. 20 Коэффициенты использования ионов натрия и диэтиламмония вычисленных составов растворов, получаемых из раствора хлорида натрия (305 г/л) при 25°С
|
Соотношение |
Состав насыщенного |
Коэффициенты |
|
||||
|
Ошибка! |
раствора, моль/кг |
использования |
Твердая |
||||
№ |
|
|
|
|
|
ионов, % |
||
п/п |
в исходной |
Na+ |
HCO3- |
CO32- |
Cl- |
U[Na+] |
U[(Et)2NH2+ |
фаза |
|
реакционной |
|
|
|
|
|
] |
|
|
смеси |
|
|
|
|
|
|
|
1 |
0.22 |
3.5672 |
0.0952 |
0.0000 |
4.4345 |
19.56 |
90.11 |
NaHCO3+ |
|
|
|
|
|
|
|
|
+NaС1 |
2 |
0.35 |
2.8058 |
0.0869 |
0.0104 |
4.1321 |
32.10 |
92.49 |
NaHCO3 |
3 |
0.62 |
1.6436 |
0.0999 |
0.0057 |
3.9837 |
58.74 |
95.46 |
-"- |
4 |
0.82 |
0.8086 |
0.1246 |
0.0000 |
3.8892 |
79.21 |
96.11 |
-"- |
5 |
1.00 |
0.2760 |
0.2509 |
0.0126 |
3.7375 |
92.61 |
92.61 |
-"- |
6 |
1.49 |
0.0303 |
1.4633 |
0.0519 |
3.1268 |
99.03 |
66.40 |
-"- |
7 |
2.49 |
0.0059 |
3.0282 |
0.1946 |
2.2949 |
99.74 |
40.11 |
NaHCO3 + |
+(Et)2NH2HCO3
Однако при уменьшении температуры коэффициенты использования ионов натрия растворов, образующихся при получении гидрокарбоната натрия из рассола хлорида натрия (305 г/л) и различных соотношений амин / хлорид натрия, возрастают, что связано с уменьшением растворимости гидрокарбоната натрия и со снижением концентрации карбоната натрия в насыщенных растворах. Например, равновесный коэффициент использования ионов натрия при получении гидрокарбоната натрия из раствора хлорида натрия при стехиометрическом соотношении гидрокарбоната диэтиламмония и хлорида натрия при 10°С составляет
95.3%, а при 25°С – 92.6%.
Таким образом, изучение растворимости в четверной взаимной системе Nа+, (C2H5)2NH2+ // НСО3-, Cl- - H2O и во всех оконтуривающих системах при 10 и 25°С показало, что система имеет стабильную диагональ, делящую четверную взаимную систему на две простые четверные системы: NaCl - (C2H5)2NH2Cl -
129
NaHCO3 - H2O (1); (C2H5)2NH2Cl - NaHCO3 - (C2H5)2NH2HCO3 - H2O (2), что наи-
более технологичным является получение гидрокарбоната натрия при стехиометрическом соотношении диэтиламина и хлорида натрия в исходной реакционной с получением приемлемых коэффициентов использования ионов натрия и диэтиламмония, которые совпадают и равны 98.9 %. Максимальный равновесный коэффициент использования ионов натрия при получении гидрокарбоната натрия из концентрированного рассола хлорида натрия (305 г/л) при стехиометрическом соотношении компонентов составляет 95.3% при 10°С.
Температура противоречиво влияет на коэффициент использования ионов натрия растворов, получаемых из хлорида натрия, диэтиламина и диоксида углерода в равновесных условиях. При уменьшении температуры равновесные коэффициенты использования ионов натрия растворов, находящихся на линиях двойного насыщения и в тройных эвтонических точках, уменьшаются, а растворов, образующихся при получении гидрокарбоната натрия из рассола хлорида натрия (305 г/л), возрастают.
12. СИСТЕМА Na+, NH4+ // HCO3-, Cl- - H2O ПРИ 15, 20, 25 И 30°С
Фазовые равновесия в четверной взаимной системе Na+, NH4+ // HCO3-, Cl- - H2O при различных температурах описывают физико-химические основы амми- ачно-содового процесса, известного в России с начала века как метод Сольве (Solvey). Кроме большого практического значения данные изотермы растворимости интересны с научной точки зрения тем, что они не имеют стабильных диагоналей и в них протекает процесс гидролиза, сопровождающийся потерей системой части диоксида углерода (процесс декарбонизации).
Изучением растворимости в этой четверной взаимной системе занимались Шрайб (Schreib), Тедеско (Tedesco), Федотьев, Ле-Шателье и Топореску (Le Chatelier et Toporescu), Нейман и Домке (Neumann u. Domke).
Шрайб исследовал процесс карбонизации аммиачно-солевых растворов при 18°С и атмосферном давлении диоксида углерода. Он впервые показал, что растворимость хлорида натрия в присутствии аммиака сильно понижается, нашел, что добавление хлорида натрия к фильтровой жидкости приводит к выделению в осадок хлорида аммония и растворению хлорида натрия, что при аммонизации и карбонизации полученного раствора, а также при его охлаждении происходит дальнейшее выделение в осадок хлорида аммония и растворение хлорида натрия.
Тедеско изучал процесс карбонизации аммонизированных растворов каменной соли при 30°С и увеличенном в 1.8 раза давлении диоксида углерода по отношению к атмосферному. Сведения о растворимости в системе, приводимые в работе, неполны и отрывочны.
Федотьев впервые осуществил основательную проработку процесса карбонизации с точки зрения правила фаз и в своем исследовании, ставшем классическим для аммиачно-содового метода, он не только изучил равновесия в четверной взаимной системе при 0 и 15°С, но и определил в общих чертах рабочую программу для всех последователей. Он заметил, что в системе протекает процесс де-
130
карбонизации, использовал составы насыщенных растворов и исходных реакционных смесей для вычисления составов равновесных твердых фаз.
Замечания Федотьева о том, что "изучение какого-либо технического процесса сводится вообще к определению наивыгоднейших условий для получения максимального выхода продукта; затем к изучению влияния различных факторов на этот выход: концентрации растворов, температуры, давления", что "реакцию обменного разложения ... можно изучать и в прямом, и в обратном направлении, и последнее ... оказывается гораздо более удобным", что "одно из существенных вспомогательных средств, при изучении реакций обменного разложения ... представляет графическое изображение экспериментальных данных", что при изучении растворимости в данной системе необходимо "пользоваться наиболее быстро выполнимыми способами (анализа), так как ... склянка, при раскупоривании не обладающая почти никаким запахом, через 15-20 минут обнаруживает резкий запах аммиака", не потеряли своей актуальности и в настоящее время.
Ле-Шателье и Топореску также исследовали метод с точки зрения правила фаз и графически представили свои результаты в четырехугольной диаграмме. Они еще раз исследовали диаграмму, построенную Федотьевым при 15°С, хотя менее основательно, чем последний. Опыты производились также при 35 и 50°С.
Нейман и Домке изучили растворимость в четверной взаимной системе при давлении диоксида углерода превышающем атмосферное в 1.2 раза. Кроме того, определили составы тройных эвтонических растворов при повышенном в 2.5 раза давлении диоксида углерода и температурах 20, 30 и 40°С.
Все цитируемые выше работы можно с уверенностью отнести к классическим. Экспериментальные данные, приведенные в этих работах, вошли в справочники по растворимости. К сожалению, содержание карбонат-ионов в насыщенных растворах в статьях не определялось и в справочниках не приводится. Приводимые ниже данные во многом заполняют этот существенный экспериментальный пробел.
12. 1. Теоретический анализ
При получении гидрокарбоната натрия из хлорида натрия, аммиака и диоксида углерода соли в идеале образуют следующую четверную взаимную систему: Na+, NH4+ // HCO3-, Cl- - H2O. В результате протекания в системе процесса декарбонизации в составах насыщенных растворов присутствуют карбонат-ионы. Возникает вопрос, с каким катионом связать карбонат-ионы при вычислении составов насыщенных растворов, выраженных в солях? Для корректного ответа на этот вопрос нужно провести триангуляцию пятерной взаимной водно-солевой системы Na+, NH4+ // HCO3-, CO32-, Cl- - H2O.
Пятерная взаимная водно-солевая система Na+, NH4+//HCO3-,CO32-,Cl- - H2O содержит три оконтуривающие четверные взаимные системы:
Na+, NH4+ // HCO3-, Cl- - H2O; Na+, NH4+ // CO32-, Cl- - H2O; Na+, NH4+ // HCO3-, CO32-, - H2O;
