
ХФ ВМС; Учебное пособие
.pdf
2.7.1.Эффект сопряжения двойной связи с заместителем
Ввинильных мономерах между двойной связью и заместителем возможны π−π, π−n и π−σ сопряжения. Это приводит к снижению взаимного
перекрвтия С-атомов π-электронами, снижению Еакт раскрытия двойной связи, а следовательно – к возрастанию способности присоединять радикал по Сβ-атому. Наиболее выражены π−π и π−n сопряжения:
.
Мерой эффекта сопряжения служит термохимический эффект сопряжения – разность энергий активации гидрирования незамещённого и замещённого этилена. Для некоторых мономеров эта величина, кДж/моль, имеет такие значения: пропилен – 4,58; метилметакрилат – 10,0; стирол – 15,31; бутадиен – 20,4; изопрен – 30,85.
В той же степени, в какой сопряжение повышает активность мономеров, оно повышает стабильность их радикалов.
2.7.2. Стерический эффект заместителей
Наличие и величина этого эффекта зависит от размеров, количества и расположения заместителей относительно двойной связи.
Мономеры с 1,1-заместителями активнее, чем с 1,2-заместителями. 1,1- замещённые этилена не полимеризуются только в случае очень объемных заместителей. Например, если изобутилен и 1,1-этилидендихлорид полимеризуются по радикальному механизму, α-метилстирол и 1,1- дифенилэтилен – по ионному механизму, то 1,2-дихлорэтилен и стильбен не полимеризуются.
2.7.3. Полярный эффект заместителей
Как электронодонорные, так и электроноакцепторные заместители, смещая π-электронную плотность непредельной двойной связи, способствуют росту реакционной способности мономеров. Реакционная способность симбатна дипольному моменту мономера.
2.7.4. Прочие факторы
Среди прочих факторов, влияющих на реакционную способность полимеризационных мономеров, следует отметить, прежде всего, те, что изменяют влияние заместителей на двойную связь. В первую очередь, к таким фактором относятся сольватационные эффекты: в зависимости от природы заместителя и растворителя, может иметь место как усиление, так и ослабление активности мономера.
41
На реакционную способность мономеров оказывают влияние различного рода взаимодействия: координационные, диполь-дипольные, электростатические, образование водородных связей.
Особенно перечисленные факторы характерны для акриловых и ионогенных мономеров.
2.8. Способы проведения радикальной полимеризации
Выбор способа радикальной полимеризации обусловлен свойствами получаемого полимера, требованиями к нему и его назначением. Наиболее распространенными способами радикальной полимеризации являются:
-полимеризация в массе (в блоке);
-суспензионная полимеризация;
-эмульсионная полимеризация;
-полимеризация в растворе.
2.8.1. Полимеризация в массе
Данный способ полимеризации относится к гомофазным гомогенным процессам. Смесь мономеров, инициатора (при необходимости) и других добавок нагревают до необходимой температуры в реакторе-полимеризаторе. По достижении требуемой степени превращения мономера полученный расплав формуют или гранулируют. Способ применяют в основном для получения блочного полистирола и полиметилметакрилата.
Достоинства: экологичность (практическое отсутствие отходов и побочных продуктов); высокая чистота получаемого полимера.
Недостатки: сложность технологического контроля и управления процессом. В значительной степени это компенсируется проведением процесса в 2 стадии с неполной конверсией мономера.
2.8.2. Суспензионная полимеризация
Полимеризация в суспензии – гетерофазный гомогенный процесс. Реакционная масса в виде дисперсной фазы (ДФ) диспергируется в дисперсионной среде (ДС). Как правило, ДС – водные растворы, содержащие диспергаторы, стабилизаторы дисперсии, регуляторы рН среды, ионной силы, плотности и др.
В качестве диспергаторов используют полимерные слабоактивные ПАВ (эфиры целлюлозы, ПВС, акриловые полимеры…). Эти же полимерные вещёства выполняют функцию стабилизаторов. Так же в качестве стабилизаторов ДФ используют водорастворимые полисахариды, а также тонкодисперсные минеральные вещёства, не растворимые в воде – т.н. защитные коллоиды.
42
Достоинства: возможность устранения недостатков полимеризации в блоке, высокая степень готовности продукта к дальнейшей переработке.
Недостатки: образование маточных вод, требующих затрат на утилизацию.
2.8.3. Эмульсионная полимеризация
Данный процесс следует отнести к гетерофазному гетерогенногомогенному. По ряду формальных признаков данный способ напоминает суспензионную полимеризацию, но имеет существенные отличия. Прежде всего, это касается ДС, которая содержит активные ПАВ – мыла или неионогенные. В отличие от суспензионной полимеризации, инициатор в данном случае – водорастворимый (персульфаты, Red/Ox-системы с Н2О2), и вводится также в ДС. ДФ диспергируется до состояния тонкой эмульсии.
Достоинства: высокие скорость и степень полимеризации – возможность снижения температуры процесса, возможность достижения высокой молекулярной массы и узкого молекулярно-массового распределения.
Недостатки: сложность выделения из реакционной массы и отмывки продукта от компонентов ДС, необходимость утилизации маточника.
Особенности процесса эмульсионной полимеризации требуют детального рассмотрения.
При концентрации ПАВ выше ККМ образуются мицеллы размером 0,01−0,1 мкм с двойным электрическим слоем на поверхности. Их количество и поверхность играют важную роль в процессе в целом. Мономер диспергируется на частицы размером 1−10 мкм, частично попадает в мицеллы, частично – растворяется.
Гидроксильный радикал инициирует полимеризацию с поверхности мицеллы, что облегчается предельно низким межфазным натяжением на границе ДС−мицелла. Через некоторое время после начала полимеризации в мицелле, последняя преобразуется в т.н. полимерно-мономерную частицу (ПМЧ). Мономер в ПМЧ пополняется за счет мономерных частиц, из которых он диффундирует за счет частичной растворимости в ДС, а размеры мицелл и ПМЧ увеличиваются.
Характерной особенностью эмульсионной полимеризации является то обстоятельство, что вплоть до приблизительно 80 %-й конверсии общего количества мономера в ПМЧ обнаруживается только один (!) растущий радикал. Причина этого – чрезвычайно высокая активность гидроксильного радикала, который преимущественно рекомбинирует с растущим макрорадикалом, а не инициирует полимеризацию. Поэтому рост цепи имеет место одновременно в половине мицелл.
Процесс при эмульсионной полимеризации лимитируют растворимость и диффузия мономера в ДС, поэтому скорость эмульсионной полимеризации
43

em.p. = р[M]р−р (2) ,
где kр – константа реакции роста; [M]р-р – концентрация растворенного в ДС мономера; N – количество мицелл.
Поскольку скорость образования гидроксильного радикала сравнительно невысока, а скорость реакции обрыва цепи vo лимитируется скоростью диффузии радикала к ПМЧ, то vo очень низка, а ̅n – высока. Не смотря на то, что обрыв цепи происходит по механизму рекомбинации, ̅n равна кинетической длине цепи, т.к. величина гидроксил-радикала несоизмеримо меньше растущего макрорадикала.
В конце эмульсионной полимеризации из реакционной массы образуется латекс. Полимер выделяют коагуляцией с последующими промывкой и фильтрованием, или используют в виде латекса.
2.8.4. Полимеризация в растворе
По данному способу смесь мономеров, инициаторов и добавок растворяют в совместимом с исходной реакционной массой и продуктом, но инертном растворителе.
Достоинства: технологичность (легкость регулирования тепло- и массообмена).
Недостатки: низкая производительность по полимеру, влияние на процесс реакций передачи кинетической цепи на растворитель, а отсюда –
снижение ̅n.
Как правило, к данному способу полимеризации прибегают, если дальнейшая переработка полимеров предусмотрена, или единственно возможна из растворов (лакокрасочные материалы, пленки, волокна…).
44

3. ИОННАЯ ПОЛИМЕРИЗАЦИЯ
Ионная полимеризация – процесс, в котором реакционным центром растущей цепи является ион.
Разновидности ионной полимеризации – катионная и анионная − обусловлены зарядом реакционного центра: соответственно катионом или анионом. Инициирование ионной полимеризации имеет каталитическую природу, а сама ионная полимеризация характеризуется большим разнообразием механизмов. Предпочтительность вида и механизма ионной полимеризации определяется характером влияния заместителя на двойную связь. Электронодонорные заместители способствуют катионной полимеризации, электроноакцепторные – анионной. Некоторые заместители, как например фенильное ядро, обусловливают альтернативность механизма.
3.1. Катионная полимеризация
Катализаторами катионной полимеризации являются вещёства кислотного характера: протонные и апротонные кислоты, кислоты Льюиса, соли карбония и оксония. Наиболее характерными являются кислоты Льюиса
– продукты взаимодействия некоторых галогенидов металлов и амфотерных элементов (AlCl3, ZnCl2, FeCl3, BF3) с нуклеофильными соединениями – донорами протонов.
3.1.1. Механизм катионной полимеризации
Наиболее известным примером катионной полимеризации является процесс с использованием хлористого алюминия. Постадийно его можно представить следующим образом.
1. Образование активного катиона (или ионной пары):
.
2. Образование активного центра – карбониевого иона:
.
Здесь и далее ED означает любой электронодонорный заместитель.
Реакция идёт через стадию ориентации ионной пары катализатора относительно поляризованной двойной связи, в которой π-электроны смещёны к β-углеродному атому, усиления поляризации, и образования σ-
связи Н−Сβ.
Для протекания катионной поляризации связь в ионной паре не должна быть диссоциирована, но быть достаточно рыхлой и способной поляризоваться. В этом весомая роль отведена растворителю.
3. Рост цепи. Каждая последующая молекула мономера ориентируется относительно ионной пары растущей цепи, и присоединяется β-атомом
45

двойной связи к карбониевому атому. Цепь удлиняется на одно мономерное звено, а активный центр (ионная пара) регенерируется на конце цепи:
.
Здесь А− − комплексный анион 4. Обрыв цепи. Карбокатионы очень активны, поэтому время жизни их
очень мало, а следовательно, полимеры имеют низкие значения ̅ (например, для полиизобутилена и полистирола ̅ ~ 50). В основном, обрыв цепи происходит:
- дезактивацией аниона –



 ; - регенерацией катализатора, наиболее типичной для полимеризации
; - регенерацией катализатора, наиболее типичной для полимеризации
изобутилена −

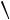

 ; - передачей активного центра на мономер, наиболее типичной реакцией
; - передачей активного центра на мономер, наиболее типичной реакцией
для катионной полимеризации реакцией обрыва –
.
3.1.2. Стереоизомерия при катионной полимеризации
Так как реакция роста цепи при катионной полимеризации идёт через стадию ориентации мономера на активном центре, то при определенных условиях (температура, растворитель) можно получить стереорегулярные полимеры.
Присоединение идёт через образование ;-членного переходного комплекса с ориентированными в пространстве заместителями:
46

3.2. Анионная и ион-координационная полимеризация
Катализаторами анионной полимеризации являются соединения основного характера: щелочные металлы, их гидриды и амиды; металлоорганические соединения; некоторые щелочи. Способы и механизмы катализа анионной полимеризации более разнообразны, чем в случае катионной полимеризации. Однако все их разнообразие можно свести к следующим основным схемам:
-реакция со свободными анионами (в условиях диссоциации катализатора);
-реакция с полярными вещёствами основного характера (например металлоорганическими соединениями);
-реакция с переносом электрона от катализатора к мономеру (например с щелочными металлами)
3.2.1. Катализ в условиях диссоциации катализатора
Типичный случай таких процессов – катализ амидом калия в среде жидкого аммиака при температуре не выше −20 °С:
Обрыв цепи в данном случае происходит только в результате передачи заряда на растворитель:
3.2.2. Катализ металлоорганическими соединениями. «Живая» полимеризация
Анионная полимеризация, катализируемая металлоорганическими соединениями, имеет механизм, схожий с катионной полимеризацией: ориентация, поляризация, образование 4-центрового комплекса, возможность образования стереорегулярных полимеров, обрыв передачей цепи на мономер, растворитель или примеси. Катализаторами полимеризации в этом случае являются, как правило, алкилы металлов: этиллитий, бутиллитий и др.
47

Для случая катализа бутиллитием схему процесса можно представить следующим образом:
.
Так как реакции рекомбинации и диспропорционирования между растущими макроионами одного знака исключены, обрыв цепи возможен путём передачи на мономер:
,
или на растворитель, например на протонный:
.
С учётом разнообразия мономеров, катализаторов и растворителей, пригодных для анионной полимеризации, легко подобрать компоненты реакционной смеси, в которой бы устранялись реакции передачи растущей цепи на мономер и растворитель. В этом случае имеет место т.н. живая полимеризация. Она характеризуется линейной зависимостью молекулярной массы от степени конверсии мономера, а также узким молекулярномассовым распределением. Реакционные центры имеют очень большую живучесть – до нескольких недель, и способны возобновить полимеризацию при добавлении мономера. Такие полимеры применяют для получения блоксополимеров с регулируемой длиной блоков, и не содержащих примесей гомополимера.
3.2.3. Катализ щелочными металлами
Инициирование процесса анионной полимеризации щелочными металлами (Mt) идёт через стадию передачи электрона металла на мономер с образованием анион-радикала:
|
|
|
|
|
. |
|
|
Далее, |
в |
зависимости |
от |
условий, |
может |
идти |
анионная |
(низкотемпературная), или |
радикальная (при |
повышенной температуре) |
|||||
|
|
|
|
|
|
|
48 |

полимеризация. Как правило, первичные ион-радикалы рекомбинируют с образованием бианиона:
.
Обычно в качестве металла используют литий, как более активный металл. Но выбор металла также зависит и от активности мономера. Например, полимеризация бутадиена может идти в присутствии натрия.
3.2.4. Анион-координационная полимеризация
Если сопряженные диены – бутадиен, изопрен, хлоропрен – полимеризовать с использованием катализаторов – металлоорганических соединений в условиях (температура, растворитель), не способствующих выраженному распределению зарядов в реакционном центре, то промежуточный комплекс будет не 4-центровым, а 6-членным:
.
При этом наблюдается образование полимеров с разной степенью стереорегулярности, зависящей от условий проведения процесса. Например, при полимеризации изопрена в присутствии этиллития в пентане образуются макромолекулы, на 94 % состоящие из цис-изомерных звеньев. В присутствии бутиллития в диоксане получается нерегулярный полимер.
3.2.5. Ионно-координационная полимеризация на катализаторах Циглера-Натта
Впервые была проведена в 1955 г. Циглером (ФРГ) и независимо детально исследована Натта (Италия). Обоим была присуждена Нобелевская премия за 1963 г.
Катализаторами Циглера-Натта являются комбинации металлов І−ІІІ
групп и переходных металлов. В основном это системы TiCl3 + AlRnCl3-n. Они образуются в результате многоступенчатых процессов на поверхности кристаллов TiCl4−TiCl3 с образованием комплекса в виде фиолетовых кристаллов:
Существует две модели образования активного центра на гетерогенном катализаторе: моно- и биметаллическая.
49

В соответствии с монометаллической моделью, активный центр со связью С−Ті локализован на одной из кристаллических модификаций TiCl3. TiIII имеет одну вакантную орбиталь и 5 лигандов: 4 атома хлора и 1 углеводородный радикал (или растущую цепь):
.
Молекула мономера, предварительно ориентируясь, координируется с активным центром. Образуется π-комплекс с вакантной орбиталью, который изомеризуется в 4-центровый промежуточный комплекс:
.
Затем молекула мономера внедряется по Ti−R-связи, образуя σ-связь с алкильным радикалом и миграцией его на конец цепи. Вакантная орбиталь регенерируется в другом положении относительного предыдущего:
.
Но так как при полимеризации на катализаторах Циглера-Натта получают в основном изотактические полимеры, необходима заключительная стадия – миграция вакантной орбитали на прежнее место:
.
Аналогично вышеописанному, следующая молекула мономера внедряется между органическим лигандом (растущей цепью) и комплексообразующим металлом:
.
Биметаллическая модель принципиально не отличается от монометаллической. Отличие сводится к тому, что после образования π- комплекса образуется 6-центровый промежуточный комплекс, включающий
50
