
ХФ ВМС; Учебное пособие
.pdfПример. Имеется 3 образца, состоящих из двух монодисперсных фракций с ̅1 =10000 и ̅2 =100000 при их массовых соотношениях g11:g12=0,99:0,01; g21:g22=0,98:0,02 и g31:g32=0,95:0,05 (цифры в индексах:
первая – номер образца, вторая – номер фракции). Тогда
|
|
|
|
|
̅ |
= 10000 × 0,99 + 100000 × 0,01 = 10900; |
|
|
||||||||||||||||||||||
|
|
|
|
|
w |
|
|
|||||||||||||||||||||||
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
̅ |
= 10000 × 0,98 + 100000 × 0,02 = 11800; |
|
|
||||||||||||||||||||||
|
|
|
|
|
w |
|
|
|||||||||||||||||||||||
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
̅ |
= 10000 × 0,95 + 100000 × 0,05 = 14500. |
|
|
||||||||||||||||||||||
|
|
|
|
|
w |
|
|
|||||||||||||||||||||||
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
̅ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
= |
|
|
0,99 |
|
|
0,01 |
= 10091; |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
10000 |
|
100000 |
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
̅ |
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
= |
|
|
0,98 |
|
|
0,02 |
= 10183; |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
10000 |
|
100000 |
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
̅ |
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
= |
|
|
0,95 |
|
|
0,05 |
= 10471. |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
10000 |
100000 |
|
|
|
|
|
|
|
|
||||||||||||
Тогда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
̅ |
|
10900 |
|
|
|
̅ |
|
|
|
11800 |
|
|
|
|
|
|
̅ |
|
14500 |
|
|||||||||
w |
|
|
|
|
w |
|
|
|
|
|
|
w |
|
|
||||||||||||||||
|
1 |
= |
|
|
= 1,080; |
|
|
2 |
|
= |
|
|
|
|
|
= 1,159; |
|
|
3 |
|
= |
|
|
= 1,385. |
||||||
|
̅ |
10091 |
|
̅ |
|
|
10183 |
|
|
̅ |
10471 |
|||||||||||||||||||
|
n |
|
|
|
|
n |
|
|
|
|
|
|
n |
|
|
|||||||||||||||
1 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
Как |
видно, |
увеличение |
доли |
высокомолекулярной |
фракции в |
большей |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
̅ |
, чем |
̅ |
, и |
влечет |
за собой |
|||||||
степени сказывается на увеличении w |
n |
|||||||||||||||||||||||||||||
увеличение ММР. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
Если снижать Mi низкомолекулярной фракции, то это в значительно |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
̅ |
|
|
|
|
|
|
̅ |
|
|
|
|
|
|
|
|
|
|
|
|
большей степени отразится на n, чем на w. Например, если образец на 99 %
состоит из монодисперсной фракции с М1 = 100000 и на 1 % из фракции с М2 = Мі, то с уменьшением Мі молекулярно-массовые характеристики изменяются следующим образом:
|
|
|
|
̅ |
|
Мі |
̅ |
̅ |
|
w |
|
n |
w |
|
̅ |
||
|
|
|
|
n |
|
10000 |
91714 |
99100 |
1,08 |
||
1000 |
50250 |
99010 |
1,97 |
||
100 |
9100 |
99000 |
10,90 |
||
21

2.РАДИКАЛЬНАЯ ПОЛИМЕРИЗАЦИЯ
2.1.Основные виды полимеризационных процессов
2.1.1.Общие сведения о полимеризации
Полимеризация – процесс последовательного присоединения молекул мономера к реакционному центру на конце растущей цепи макромолекулы с регенерацией реакционного центра после каждого акта присоединения.
Реакционными центрами могут быть радикалы, ионы, комплексы. Полимеризация – процесс, состоящий из нескольких последовательнопараллельных элементарных реакций (инициирования, роста цепи, обрыва); определяющей стадией является реакция роста цепи. Все полимеризационные процессы можно разделить по следующим классификационным признакам:
-по типу реакционного центра – на радикальные, ионные (катионные и анионные), ион-координационные;
-по строению мономеров – полимеризация олефинов, диенов, полиенов, неолефиновых соединений с кратными связями, циклических соединений;
-по механизму и особенностям основных стадий процесса полимеризации.
2.1.2. Радикальная полимеризация: общие представления
Радикальная полимеризация – процесс, в котором реакционными центрами растущих цепей являются радикалы.
Радикал – атом или группа атомов с неспаренным электроном. Свободные радикалы – электрически нейтральные частицы. Радикалы характеризуются живучестью, стабильностью и активностью.
Живучесть радикала – кинетическая характеристика, связанная с временем существования радикала. Стабильность радикала – термодинамическая характеристика, обусловленная энергией стабилизации радикала, зависящей от возможности делокализации электрона, и стерических факторов. Между живучестью и стабильностью нет прямой связи, т.к. она зависит от внешних условий. Но между стабильностью и активностью радикала существует обратная зависимость. Например, в ряду радикалов
активность убывает слева направо, а стабильность в том же направлении
возрастает. |
Особенно стабильными являются бензильный |
и |
алильный |
радикалы. Между активностью, а также стабильностью |
|
мономеров и их же радикалов зависимости обратные, т.к. факторы, способствующие росту реакционной способности мономера, способствуют росту стабильности его радикала.
22

Характерные реакции радикалов известны из органической химии: рекомбинация, диспропорционирование, передача радикала, присоединение по двойной связи. Все указанные реакции имеют непосредственное отношение к процессу радикальной полимеризации, и особенно – последняя:



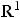



 . Как правило, присоединение происходит по β- углеродному атому двойной связи, т.к. это положение более доступно, и образуется более стабильный радикал.
. Как правило, присоединение происходит по β- углеродному атому двойной связи, т.к. это положение более доступно, и образуется более стабильный радикал.
Реакционная способность мономеров, как и стабильность их радикалов, растет в рядах:
;
.
2.1.3. Общие условия протекания радикальной полимеризации
Основными стадиями процесса радикальной полимеризации являются: образование радикалов; инициирование (зарождение цепи); рост цепи; обрыв цепи. Для протекания радикальной полимеризации необходимы как минимум два условия:
-мономер, способный к радикальной полимеризации;
-радикал, способный к присоединению по двойной связи.
Мономерами для радикальной полимеризации являются, прежде всего, этилен и его производный с самыми различными заместителями у двойной связи. Радикалы, используемые, для инициирования, должны иметь среднюю реакционную способность (при высокой активности будут иметь место в основном рекомбинация и другие побочные реакции; при низкой активности не будет инициирования).
2.1.4. Основные способы инициирования радикальной полимеризации
Для удобства реакции образования радикалов и инициирования рассматривают как одну стадию, т.к. между ними существует однозначная причинно-следственная связь, а собственно инициирование протекает во всех случаях одинаково. Отличия касаются только механизма образования радикалов, и в зависимости от его особенностей называют способ инициирования:
-химическое – посредством соединений, распадающихся на радикалы в условиях полимеризации;
-термическое – за счет образования радикалов из мономеров при повышенной температуре;
-фотохимическое – посредством соединений (в т.ч. – мономеров), распадающихся на радикалы под действием УФ-лучей или видимого света (в присутствии фотосенсибилизаторов);
-радиационно-химическое – под действием радиоактивного излучения;
23

-механохимическое – под действием высоких сдвиговых напряжений;
-электрохимическое.
2.1.5. Химическое инициирование
Радикалгенерирующими агентами может быть широкий круг соединений. Но для радикальной полимеризации используют только некоторые из них: гидропероксиды, алкил- и ацилпероксиды, пероксиэфиры, азо- и диазосоединения с энергией диссоциации на радикалы (Едис) 105−168 кДж/моль. Таким значениям Едис удовлетворяют связи >N−C≡, −S−S−, −O−O−. Преимущественно используют органические и неорганические перекиси:
- гидропероксиды, например гидроперекись кумола (гипериз):
третбутилгидропероксид:
-алкилпероксиды, например третбутилпероксид:
-пероксиэфиры, например третбутилпербензоат:
ацилпероксиды, например перекись ацетила:
перекись бензоила (ПБ):
- пероксидикарбонаты
или азосоединения:
- азосоединения, например ДАК или АИБН (динитрил азо-бис-изомасляной кислоты или азо-бис- изобутиронитрил):
,
;
;
;
;
;
;
.
Последний из приведенных инициаторов имеет энергию диссоциации около 293 кДж/моль, но является активным инициатором вследствие образования азота и смещёния равновесия в сторону образования радикалов.
Наиболее широко используют ПБ. При распаде перекисей образуются первичные и вторичные радикалы, например
,
которые также участвуют в реакциях инициирования. Известно, что на концах макромолекул, инициированных ПБ, обнаруживают в основном фенильные, а не бензоильные заместители. Но при этом увеличивается также и вклад побочных процессов с участием свободных радикалов. В
24

собственно инициировании радикальной полимеризации участвует только часть инициатора, которую обозначают как эффективность инициатора f. Для разных инициаторов f = 0,4−0,99.
Все вышеперечисленные инициаторы органорастворимые, поэтому их используют при полимеризации в массе, суспензии, растворе органического растворителя. Перекиси комбинируют по их активности для поддержания эффективной концентрации радикалов в течение всего процесса: сначала расходуется более активный инициатор, а в конце процесса при повышенной температуре – менее активный.
Для инициирования в водных растворах и для эмульсионной полимеризации используют неорганические инициаторы, например персульфаты:



 .
.
анион-радикал
Инициирующей частицей является активный гидроксильный радикал. Его образование сопровождается снижением рН, поэтому часто вместе с персульфатами используют буферные системы.
Перекись водорода малоактивна в условиях радикальной полимеризации, поэтому ее используют в паре с восстановителями, т.е. в виде инициирующих Red/Ox-систем.
2.1.6. Инициирующие Red/Ox-системы
Такие системы применяют, если по различным соображениям необходимо снизить температуру процесса, а другие способы компенсации снижения скорости образования свободных радикалов (например УФизлучение) не приемлемы. Пероксиды – окислители, а присутствие в системе восстановителей ускоряет распад на радикалы, снижая Еакт с 125−170 до 42 кДж/моль, и увеличивая скорость образования радикалов на порядки. В
качестве восстановителей используют соединения металлов и неметаллов в низших степенях окисления: Fe+2, Cu+1, Cr+2, Co+2, SO3-2, S2O3-2 и т.п.
Например:
Радикалы, как видно из приведенных схем, образуются не путём гомолитического распада, а в результате химических реакций.
2.2.Механизм радикальной полимеризации
2.2.1.Основные стадии процесса
Реакция инициирования – присоединение свободного радикала по двойной связи молекулы мономера:
25

(образование первичного радикала). Скорость инициирования i = i[R∙][M], где k i – константа
скорости инициирования; [R∙] и [M] – соответственно концентрации свободных радикалов и мономера. Но скорость инициирования лимитируется скоростью гомолитического распада инициатора г = 2 г[I] , где f – эффективность инициатора; kг – константа скорости гомолитического распада инициатора; [I]
– концентрация инициатора. Поэтому i = ин[I], где ин = 2 г. Однако это справедливо только для химического инициирования, когда i г.
Реакция роста цепи – присоединение к первичному радикалу, а затем – к растущему радикалу молекул мономера:
 .
.
При этом v1 = vn = vp = const, а саму реакцию для удобства изображают
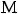



 . Скорость реакции роста цепи vp можно выразить через скорость исчезновения мономера: − [M] = p[M∙][M], где kР – константа
. Скорость реакции роста цепи vp можно выразить через скорость исчезновения мономера: − [M] = p[M∙][M], где kР – константа
скорости реакции роста, а [M•] и [M] – соответственно концентрации растущих радикалов и мономера. Присоединение в основном протекает по типу «хвост» к «голове», но имеет место присоединение по типам «голова» к «голове» и «хвост» к «хвосту».
Реакция обрыва цепи – завершающая стадия процесса полимеризации. Она имеет место на всем протяжении процесса полимеризации, а в реакционной смеси уже вначале процесса присутствует полимер с высокой молекулярной массой. В химии полимеров понятие «цепь» имеет двойственный смысл:
-цепь как кинетическое понятие, указывающее на существование радикала в реакционной смеси – кинетическая цепь;
-цепь как материальное образование – макромолекула с высокой анизотропией размеров – материальная цепь.
При обрыве материальной цепи кинетическая цепь может продолжать рост. Поэтому в данном случае имеется в виду обрыв материальной цепи. Он может произойти реакциями рекомбинации и диспропорционирования:
рекомбинация
диспропорционирование
Преобладание той или иной реакции обусловлено строением мономеров и условиями полимеризации: третичные радикалы, особенно с крупными
26

заместителями, преимущественно диспропорционируют, а вторичные – рекомбинируют.
Скорость реакции обрыва o = o[M∙]2 , где ko – константа скорости обрыва (kо = kрек + kдисп, где kрек и kдисп – соответственно константы скоростей обрыва рекомбинацией и диспропорционированием). Не смотря на то, что kо >> kР (kо ≈ 106−108 л/(моль·с); kР ≈ 102−104 л/(моль·с)), полимеризация идёт до глубоких степеней превращения. Это обусловлено тем, что [M] >> [M•], а также диффузионным контролем реакций обрыва.
2.2.2.Кинетика радикальной полимеризации
Снекоторыми упрощениями для элементарных реакций процесса радикальной полимеризации можно записать:
инициирование |
|
|
|
|
|
|
|
|
|
= |
|
|
[I]; |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ин |
|
|
рост цепи |
|
|
|
|
|
|
|
|
= |
p |
[M∙][M]; |
|||||
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
p |
|
|
|
|
|
|
|
||
обрыв цепи |
|
|
|
|
|
|
|
|
= |
o |
[M∙]2 |
|||||
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
o |
|
|
|
|
|
||
Скорость процесса в целом определяется скоростями наиболее медленной
стадии, а также тех, в которых расходуется |
мономер, т.е. |
vин |
и vр: = |
||||||||||
− |
[M] |
= |
+ . |
Т.к. |
расход мономера |
в реакции |
инициирования |
||||||
|
|||||||||||||
|
|
|
ин |
о |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
[M] |
|
|||
несоизмеримо меньше, |
чем в реакции роста, то можно принять = − |
= |
|||||||||||
|
|||||||||||||
|
|
|
|
[M∙][M]. В |
|
|
|
|
|
|
|||
|
= |
p |
данное уравнение входит |
трудноопределимая |
величина |
||||||||
о |
|
|
|
|
|
|
|
|
|
|
|
||
[M•], что снижает, не смотря на простоту, его практическую ценность.
Для исключения из кинетического уравнения концентрации растущих радикалов необходимо сделать некоторые допущения. При неглубоких степенях превращения (10−15 %) процесс можно считать стационарным, т.е. протекающим при постоянных V, [M•] и [M]. Постоянство концентрации растущих радикалов предполагает равенство vин = vо, т.е. равенство скоростей
образования и исчезновения |
радикалов. Из равенства o[M∙]2 = ин[I] |
||||||
концентрацию растущих радикалов можно выразить как [M∙] = ( |
ин |
[I])0,5 . |
|||||
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
о |
|
Тогда |
|
|
|
|
|
||
|
|
|
|
ин |
0,5 |
|
|
|
|
|
= p ( |
) [I]0,5[M] = [M][I]0,5, |
|||
|
|
)0,5 |
о |
||||
|
|
|
|
|
|
||
где = p ( |
ин |
– эффективная константа скорости процесса радикальной |
|||||
|
|||||||
|
о |
|
|
|
|
|
|
полимеризации при химическом инициировании.
2.2.2.1. Кинетическая длина цепи и степень полимеризации
Скорости |
реакций роста и обрыва цепи vр и vо можно представить как |
соответственно |
количество присоединившихся мономерных молекул к |
|
27 |

растущим радикалам и количество прекративших рост радикалов в единицу
времени. Тогда отношение p = – количество молекул мономера,
о
присоединившихся к растущему радикалу за время его существования, или количество МЗ в макромолекуле. Величина ν получила название
кинетическая длина цепи.
При подстановке соответствующих кинетических выражений и замене [M•] получим
|
p[M] |
|
|
[M] |
|
p2[M]2 |
|||||
= |
|
|
|
= |
|
|
|
= |
|
|
. |
( |
|
[I])0,5 |
|
ин |
[I]0,5 |
|
|
||||
|
ин |
o |
|
|
|
|
|
o |
|
|
|
Из приведенных выражений видно, что ν растет при увеличении концентрации мономера, снижении концентрации инициатора и эффективной скорости процесса.
Средняя степень полимеризации ̅n – количество МЗ в цепи. В зависимости от механизма реакции обрыва цепи ̅n = (1 ÷ 2) .
2.2.2.2. Реакции передачи цепи
Растущая цепь может передавать радикал на другие молекулы в реакционной смеси, превращаясь в «мертвую» макромолекулу:
При этом рост материальной цепи прекращается, а рост кинетической цепи продолжается, т.к. возникающий новый радикал может участвовать в
процессе: 





 . Передача цепи возможна на растворитель, мономер, инициатор, полимер, примеси, а также – специально вводимые агенты: регуляторы, замедлители, инициаторы. С учётом реакций обрыва материальной цепи в результате реакций передачи кинетической цепи выражение для средней степени полимеризации принимает вид:
. Передача цепи возможна на растворитель, мономер, инициатор, полимер, примеси, а также – специально вводимые агенты: регуляторы, замедлители, инициаторы. С учётом реакций обрыва материальной цепи в результате реакций передачи кинетической цепи выражение для средней степени полимеризации принимает вид:
|
|
|
|
|
|
|
̅ |
|
р |
, |
|
|
|
|
||
|
|
|
|
|
|
|
n = = |
о + ∑ пер |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
где ∑ пер = S + M + I ; |
S, M и I – |
соответственно скорости реакций |
||||||||||||||
передачи цепи на растворитель, мономер и инициатор. |
||||||||||||||||
Особое значение имеет передача цепи на растворитель. Она характерна, |
||||||||||||||||
например, для толуола и четыреххлористого углерода (ЧХУ): |
||||||||||||||||
|
|
|
|
|
|
|
|
|
; |
|
|
|
|
|
|
. |
Бензильный и трихлорметильный радикалы способны инициировать
полимеризацию, а также рекомбинировать с другими радикалами. Скорость передачи цепи на растворитель S = S[M∙][S], где kS – константа скорости
передачи цепи на растворитель, [S] – концентрация растворителя. Величина
S |
= – константа передачи цепи на |
растворитель. |
Она показывает |
|
|||
p |
S |
|
|
|
|
|
|
соотношение скоростей взаимодействия |
растущего |
макрорадикала с |
|
|
|
|
28 |
молекулами растворителя и мономера при рваных концентрациях последних. Значение этой константы зависит от природы растворителя и мономера:
Растворитель |
|
Значения СS для мономеров |
||
|
стирола |
|
метилметакрилата |
винилацетата |
Бензол |
0,018 |
|
0,075 |
3 |
Толуол |
0,125 |
|
0,525 |
21,0 |
Гептан |
0,42 |
|
- |
- |
ЧХУ |
90,00 |
|
2,40 |
>104 |
Тетрабромметан |
1,36·104 |
|
0,33·104 |
39,0·104 |
н-Бутилмеркаптан |
22·104 |
|
0,67·104 |
48·104 |
Как видно из табл., не все растворители пригодны для радикальной полимеризации. Растворители с высокими значениями используют в качестве регуляторов молекулярной массы. Величина СS растет со снижением энергии связи С-Н или C-Hal в молекулах растворителей, или с увеличением стабилизации радикала, переданного на растворитель.
Растворители, используемые для регулирования молекулярной массы полимеров, называют телогенами, а полимеризационный процесс с их участием – теломеризацией.
|
|
Остальные значимые реакции передачи цепи аналогично |
можно |
|||||
охарактеризовать |
соответствующими константами передачи |
цепи: |
||||||
|
= |
M |
; |
= |
I |
|
, где См и СІ – соответственно константы передачи цепи на |
|
|
|
|||||||
M |
|
P |
I |
P |
|
|
||
мономер и инициатор; kM и kI – соответственно константы скоростей реакций передачи цепи на мономер и инициатор. Если в уравнение для ̅ с учётом ∑ пер подставить соответствующие выражения, то путём несложных преобразований можно получить основное уравнение кинетики радикальной полимеризации:
1 |
= |
o |
|
+ С |
[S] |
+ I |
[I] |
+ M. |
|
̅ |
2 |
[M] |
2 |
[M] |
[M] |
||||
n |
|
p |
|
|
|
|
|||
Уравнение имеет практическое значение, так как позволяет рассчитать любую из входящих в него величин. Для этого используют данные экспериментов, в которых искусственно создают условия, при которых нивелируются те или иные величины, входящие в основное уравнение.
2.2.3. Передача цепи на полимер
Данный вид реакций передачи цепи имеет значение на завершающем этапе процесса полимеризации, при глубоких степенях превращения. Имеет значение в связи с тем, что проявляется в образовании разветвленных структур, а это в свою очередь оказывает влияние на свойства полимеров. Имеет более высокие значения энергии активации, чем другие реакции
29

передачи цепи, поэтому температура влияет на реакцию передачи на полимер в большей степени, чем на другие реакции передачи.
Константа передачи на полимер |
= |
П |
не входит в основное |
|
|||
П |
|
P |
|
уравнение кинетики, т.к. передача цепи на полимер начинает сказываться на процессе, когда условие стационарности не соблюдается. Кроме того, в отличин от других реакций передачи, передача цепи на полимер приводит к возрастанию ̅n.
Значение П используют для определения плотности разветвленийй (по Флори):
1
= П [1 + ln(1 − )],
где р – степень превращения.
2.2.4. Ингибиторы, замедлители и регуляторы радикальной полимеризации
Ингибиторы полимеризации – вещёства, предотвращающие нежелательную полимеризацию при хранении и транспортировке мономеров. Такие соединения являются активными агентами передачи на них кинетической цепи. Но при этом образуются достаточно стабильные радикалы, практически не способные продолжать кинетическую цепь. Типичные представители ингибиторов – хиноны, алкилфенолы, ариламины, нитрозосоединения. Например, передачу радикала на хинон можно изобразить такой схемой:
Вместе с тем, стабильные радикалы могут участвовать в реакциях обрыва. Для ингибиторов радикальной полимеризации характерны высокие значения
константы передачи цепи |
= |
Z |
> 1000 , где kZ – константа скорости |
|
|||
Z |
|
P |
|
реакции передачи цепи на ингибитор. Для полимеризации ингибированного мономера необходима очистка его от ингибитора или предварительная нейтрализация последнего. Для этого используют избыток инициатора. Время, необходимое для полного расходования ингибитора – индукционный период.
Для исследовательских целей используют соединения − стабильные радикалы, например дифенилпикрилгидразил (ДФПГ) и 2,2,6,6- тетраметилпиперидиноксил-1 (ТЕМПО):
30
