
ХФ ВМС; Учебное пособие
.pdfгибкостью макромолекул. Основными существенными отличиями растворов ВМС от растворов низкомолекулярных соединений являются:
-высокая вязкость даже низкоконцентрированных (~ 1 %-х) растворов полимеров;
-многостадийность процесса растворения полимеров.
Процесс растворения полимеров начинается с набухания их в растворителе. Набухание – сорбционное явление, представляющее собой поглощение полимером низкомолекулярного растворителя, сопровождающееся увеличением объема, иногда на порядок и более.
Процесс набухания состоит из следующих стадий:
-диффузия растворителя в полимерную матрицу;
-сольватация активных центров макромолекул молекулами растворителя;
-ослабление и блокирование меж- и внутримолекулярных взаимодействий сольватными оболочками, способствующее проникновению
вполимерную матрицу новых порций растворителя.
Собственно растворение предварительно набухшего полимера заключается в отделении сольватированных макромолекул от поверхности набухшего полимера и диффузии их в раствор.
11.1.3. Термодинамика растворения полимеров
Растворение полимеров имеет место только при наличии термодинамического сродства его с растворителем. В этом случае процесс протекает самопроизвольно с образованием однофазной системы и снижением свободной энергии ( G < 0).
Движущая сила набухания, с которого начинается растворение полимеров, μi − разность химических потенциалов i-тых компонентов в растворе и отдельно. Условие самопроизвольного растворения – снижение свободной энергии при смешении компонентов:
p < ∑ 0 ,
где p – свободная энергия раствора; 0 – свободная мольная энергия i-го компонента вне раствора; ni – количество молей i-го компонента.
Разность
см = p − ∑ 0
называется свободная энергия смешения. Для самопроизвольного растворения должно выполняться условие см < 0.
Поскольку энергия – величина аддитивная, то показателем направления процесса может быть парциальная мольная свободная энергия ̅, а p можно выразить как:
p = ∑ ̅ .
181

Парциальную мольную свободную энергию i-го компонента можно представить как изменение свободной энергии раствора при добавлении в него бесконечно малого количества i-го компонента, отнесенное к количеству добавленного компонента, и при прочих неизменных условиях:
̅= ( |
p |
) |
= , |
|
|||
|
|
|
|
|
|
, , ( −1) |
|
|
|
|
|
где μi – химический потенциал i-го компонента.
Аналогично с изменением количества i-го компонента в растворе изменяются все парциальные термодинамические параметры системы:
̅= = ̅ − ̅.
Величину химического потенциала легко определить через осмотическое давление. Если разделить растворитель и раствор полупроницаемой перегородкой, проницаемой только для молекул растворителя, то из-за разности химических потенциалов чистого растворителя и его же в растворе
1 = 10 − 1 ,
где 10 и 1 − химические потенциалы чистого растворителя и растворителя в растворе, растворитель перемещается через перегородку в раствор, пока разность давлений р = р – р0, пропорциональных гидравлическим напорам столбов жидкостей – раствора и растворителя не уравновесит разность
химических потенциалов 1 (рис. 4.1). |
|
|
|
|
|
|
|
|
Разность |
|
давлений |
|
раствора |
и |
|
|
растворителя |
на |
перегородку |
называют |
|||
|
осмотическим |
|
давлением |
|
π. |
Для |
|
|
уравновешивания |
разности |
химических |
||||
|
потенциалов чистого растворителя и его же |
||||||
|
в растворе, в последнем необходимо |
||||||
|
создать дополнительное давление, равное |
||||||
|
осмотическому. |
При |
этом |
между |
|||
|
изменением |
химического |
потенциала |
||||
|
растворителя |
μ1 |
и давлением существует |
||||
|
зависимость |
|
̅ |
|
|
|
|
Рис. 4.1. К определению |
|
|
|
|
|
|
|
1 = 1 , |
|
|
(4.1) |
||||
химического потенциала через |
|
|
|||||
̅ |
|
|
|
|
|
|
|
осмотическое давление |
где 1 − парциальный мольный объем |
||||||
растворителя. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
̅ |
= const. Тогда, |
|||
Для раствора, который практически несжимаем, 1 |
|||||||
проинтегрировав (4.1): |
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
∫ 1 |
̅ |
|
|
|
|
|
|
= ∫ 1 , |
|
|
|
|
|
|
|
1 |
0 |
|
|
|
|
|
|
и учитывая р – р0 = π, получаем: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
182 |
1 = − ̅1.
Осмотическое давление – мера термодинамического сродства между компонентами раствора, отнесенная к единице объема растворителя.
Для идеальных растворов справедливо: |
|
|
|||||||
= − |
1 |
= − |
R |
ln |
= − |
R |
ln(1 − ) , |
(4.2) |
|
̅ |
̅ |
|
|||||||
|
|
1 |
|
̅ |
2 |
|
|||
|
1 |
|
1 |
|
|
1 |
|
|
|
где Х1 и Х2 – соответственно мольные доли растворителя и растворенного вещёства: Х1 + Х2 = 1.
С учётом |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
2 |
|
3 |
||
= |
|
2 |
|
2 |
; ln(1 |
− ) = − − |
2 |
|
− |
2 |
− ≈ − , |
|
|
|
|
|
|
||||||||
2 |
1 |
+ 2 |
|
1 |
|
2 |
2 |
2 |
|
|
3 |
2 |
|
|
|
|
|
|
|
|
|||||
из (4.2) легко получить уравнение Вант-Гоффа: |
|
|
|
|||||||||
|
|
|
|
|
|
= R 2 , |
|
|
|
|
|
(4.3) |
где С2 – мольная концентрация растворенного вещёства.
Уравнение (4.3) можно записать, подставив вместо мольной − массовую концентрацию Сm2:
= R |
m2 |
, |
(4.4) |
|
|
||||
|
|
|
||
|
2 |
|
|
где М2 – молекулярная масса растворенного вещёства Известно, что уравнение Вант-Гоффа справедливо для идеальных
растворов, в которых отсутствует взаимодействие молекул растворителя и растворенного вещёства. Однако, даже разбавленные растворы полимеров характеризуются различного рода межмолекулярными взаимодействиями, поэтому для них, как и для других реальных растворов, осмотическое давление описывается степенным рядом:
= R ( |
|
+ |
2 |
+ |
3 |
+ + |
) , |
(4.5) |
1 |
2 |
2 |
2 |
3 |
2 |
|
2 |
|
где А1, А2, А3, … Аn – вириальные коэффициенты.
Отбросив в (4.5) слагаемые высших порядков, как несущественные, и разделив обе части на С2, получаем выражение для приведенного
осмотического давления: |
|
||
|
|
= R ( 1 + 2 2) , |
(4.6) |
|
|
||
|
2 |
|
|
где А1 и А2 – первый и второй вириальные коэффициенты соответственно.
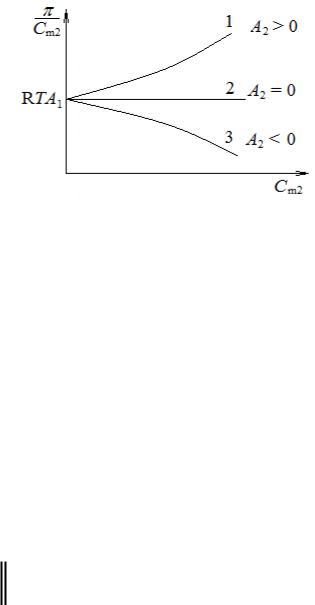
Выражение (4.6) имеет важное теоретическое и практическое значение, так как позволяет качественно и количественно характеризовать растворы полимеров и прогнозировать возможность их образования. Наиболее наглядно это можно сделать путём ее графической интерпретации этой зависимости: графически она представляет собой серию кривых (рис. 4.2).
183
|
Если |
в (4.6) |
подставить |
|
|
массовую концентрацию, то, с |
|||
|
учётом (4.4), |
первый |
вириальный |
|
|
коэффициент А1 |
= 1/М2, что |
||
|
позволяет с |
помощью |
осмометрии |
|
|
растворов полимеров определять их |
|||
|
молекулярную массу. |
|
||
|
Второй |
|
|
вириальный |
|
коэффициент |
А2 |
характеризует |
|
Рис. 4.2. Зависимость приведенного |
качество растворителя, т. е. |
|||
осмотического давления от концентрации |
термодинамическое |
|
сродство |
|
полимера в хорошем (1), идеальном (2) и |
растворителя и полимера. При А2 > 0 |
|||
плохом (3) растворителях |
полимер |
и |
|
растворитель |
|
|
|||
термодинамически совместимы, а растворитель по отношению к полимеру обозначают как хороший растворитель. При А2 = 0 в системе полимер – растворитель все возможные внутри- и межмолекулярные взаимодействия сбалансированы, и раствор ведет себя подобно идеальному, а (4.6) обращается в (4.3) − уравнение Вант-Гоффа для идеальных растворов. Такой растворитель по отношению к полимеру называют идеальный растворитель. При А2 < 0 термодинамическое сродство между компонентами раствора отсутствует, а растворитель называют плохим.
Найдено, что |
|
1 |
|
|
|
|
2 |
= |
|
(0,5 − 1) |
(4.7) |
||
2 |
||||||
|
|
|
|
|||
где ρ1 и ρ2 – плотности |
|
1 |
2 |
|
соответственно; М1 – |
|
растворителя и полимера |
||||||
молекулярная масса растворителя; χ1 – константа Хаггинса.
Константа Хаггинса χ − мера термодинамического сродства растворителя и полимера.
Исходя из теории Флори-Хаггинса, величину χ1 можно рассчитать с
помощью выражения |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
̅ |
|
( 1 |
2 ̅ |
|
|
|
|
||||
1 = |
|
1 |
|
= |
− 2) |
1 |
, |
|
|
|
(4.8) |
||
|
R |
|
|
R |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|||
где δ1 и δ2 – соответственно |
параметры |
растворимости растворителя и |
|||||||||||
полимера (по Гильдебранду, δі = ( |
|
0 |
̅ 0,5 |
, где |
0 |
|
̅ |
|
|||||
|
⁄ ) |
|
⁄ – плотность энергии |
||||||||||
|
|
|
|
|
̅ |
|
|
|
|
|
|
||
когезии і-го компонента |
смеси; |
– парциальный |
мольный |
объем i-го |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
компонента смеси). |
|
|
|
|
|
|
|
|
|
|
|
|
|
Для различных систем растворитель – полимер значения χ1 |
и δі можно |
||||||||||||
найти в специальной справочной литературе или рассчитать. Параметр растворимости жидкостей можно найти через скрытую теплоту парообразования:
|
|
− R |
0,5 |
(4.9) |
|
1 |
= ( |
|
) , |
||
1 |
|||||
|
|
|
|
||
|
|
|
|
184 |

где I и V1 – соответственно скрытая энтальпия парообразования и мольный объем жидкости.
Для расчета параметра растворимости полимеров наиболее распространенным является метод Смолла, в соответствии с которым
2 = 2 ∑ , (4.10)
2
где ∑ − сумма мольных констант взаимодействия атомных группировок, входящих в составное повторяющееся звено полимера, (МДж/м3)0,5; ρ2 – плотность полимера, кг/м3; М2 – эквивалентная масса полимера (масса составного повторяющегося звена в а. е. м.).
Опыт выполнения вышеописанных расчетов указывает на то, что в ряде случаев не удается найти значения мольных констант взаимодействия для некоторых групп. Поэтому более приемлемым и надежным является метод, предложенный Аскадским, в соответствии с которым
|
∑ |
|
|
|
|
|
2 = |
|
=1 |
|
, |
(4.11) |
|
N |
A |
∑ |
|
|||
|
|
|
|
|
|
|
где - вклад каждого атома и типа межмолекулярного взаимодействия в |
||||||
|
|
|
|
|
|
– инкремент объема і-го |
энергию когезии вещёства; NА – число Авогадро; |
||||||
|
|
|
|
|
|
|
атома. |
|
|
|
|
|
|
Таким образом, растворители по отношению к полимерам можно |
||||||
характеризовать величинами А2 и χ1: |
|
|
|
|
||
|
|
|
|
|
|
|
Качественный признак |
|
|
|
|
А2 |
χ1 |
растворителя |
|
|
|
|
||
|
|
|
|
|
|
|
Хороший растворитель |
|
|
|
|
> 0 |
< 0,5 |
Идеальный растворитель |
|
|
|
|
0 |
0,5 |
Плохой растворитель |
|
|
|
|
< 0 |
> 0,5 |
Для самопроизвольного растворения необходима близость значений δi, причём желательно, чтобы δ1 > δ2. Однако имеется множество исключений, так как δi учитывают только неспецифические взаимодействия. Поэтому на практике руководствуются эмпирическим правилом «подобное растворяется в подобном».
11.1.4. Термодинамические условия сольватации и самопроизвольного растворения полимеров
Самопроизвольное растворение предполагает
см = см − см < 0 ,
где Gсм, Hсм и Sсм – соответственно свободная энергия, энтальпия и энтропия смешения.
Данное условие однозначно выполняется при растворении полярных полимеров в полярных растворителях, например динитрата целлюлозы в ацетоне. Совмещёние таких растворителей и полимеров сопровождается, как
185
правило, положительным тепловым эффектом ( Qсм = − Hсм), что свидётельствует об образовании связей полимер – растворитель. Если внутри- и межмолекулярное взаимодействия сильнее взаимодействия растворитель – полимер, то растворение не происходит.
Снижение Gсм, а, следовательно, растворение возможно при следующих термодинамических условиях (сочетании изменений термодинамических функций):
Hсм < 0; Sсм > 0. Такое изменение термодинамических функций имеет место при экзотермическом растворении. При этом взаимодействие полимер
– растворитель преобладает над внутри- и межмолекулярными взаимодействиями полимерных макромолекул. Случай, типичный для растворения полярных полимеров в полярных растворителях.
Hсм < 0; Sсм < 0. В этом случае растворение имеет место, если
│ Hсм│ > │T Sсм│. Процесс сопровождается положительным тепловым эффектом и сильной сольватацией полимера с образованием вязкого структурированного раствора.
Hсм > 0; Sсм > 0. При таком характере изменения термодинамических функций самопроизвольное растворение возможно, если соблюдается условие Hсм < T Sсм. В этом случае растворение эндотермическое. Имеет место при растворении в неполярных растворителях.
Hсм = 0; Sсм > 0. Случай атермического растворения. Имеет место, если энергии взаимодействия полимер – полимер и полимер – растворитель равны.
Сольватация полимера растворителем может закончиться стадией набухания. Основные причины ограниченного набухания полимеров:
-недостаточное термодинамическое сродство с растворителем. Растворитель проникает в аморфные участки, но не затрагивает и не разрушает надмолекулярные структуры. В этом случае неограниченное набухание возможно при повышении температуры. Например, желатин при 35 °С растворяется в воде неограниченно;
-наличие пространственной сетки. В этом случае степень набухания – отношение объемов набухшего и не набухшего полимера – зависит от плотности пространственной сетки (степени сшивки).
В случае несшитого полимера вероятность перехода от набухания к образованию истинного раствора зависит от температуры. Температура в равной степени с термодинамической совместимостью полимер – растворитель определяет форму гибкоцепных макромолекул в растворе. Например, в плохом растворителе с ростом температуры и повышением подвижности сегментов клубки начинают разворачиваться и становиться более проницаемыми для молекул растворителя. Количество флуктуационных узлов внутримолекулярных нехимических связей уменьшается, а вероятность сольватации и межмолекулярных нехимических взаимодействий возрастает. В результате качество растворителя по отношению к полимеру изменяется.
186

Для объяснения и оценки влияния температуры на свойства растворов, Флори ввел понятие θ-температуры. В специальной литературе для нее используют термины критическая температура смешения или температура Флори.
θ-температура для некоторой системы полимер – растворитель – это та температура, при которой растворитель становится идеальным по отношению к растворяемому полимеру и соблюдаются условия μ1 = 0, А2 = 0, χ1 = 0,5.
При θ-температуре большинство термодинамических параметров не зависит от концентрации, например приведенное осмотическое давление.
Совокупность условий, при которых для некоторой системы полимер – растворитель ее температура равна θ-температуре, называют θ-условиями.
Аналогично, растворитель или смесь растворителей, при растворении в которых реализованы θ-условия, называют θ-растворителем.
θ-условия можно реализовать, медленно охлаждая (или нагревая) раствор, или добавляя к раствору в хорошем растворителе плохой растворитель при постоянной температуре. При достижении θ-условий взаимодействия между молекулами растворителя и полимера уравновешивают внутри- и межмолекулярные взаимодействия макромолекул. Клубки макромолекул принимают невозмущенные конформации, зависящие только от строения цепи макромолекул (длин связей, валентных углов). Можно говорить о достижении баланса между сольватированными и несольватированными участками макромолекул, участвующими в тепловом движении. С дальнейшим снижением температуры, а, следовательно, кинетической тепловой энергии сегментов, клубки принимают более компактные формы, доля внутримолекулярных флуктуационных взаимодействий возрастает, а доля сольватированных участков снижается. То же самое имеет место при добавлении в раствор плохого растворителя. Такие макромолекулярные клубки при столкновении легко образуют межмолекулярные нехимические связи, т. е. происходит агрегация макромолекул. Поэтому достижение θ-условий легко определить визуально по легкому помутнению раствора.
Основная ценность θ-условий заключается в том, что макромолекулы при этом принимают конформации, не зависящие от всякого рода межмолекулярных взаимодействий, а обусловленные лишь гибкостью цепи. Поэтому, при определении влияния различных внешних факторов на параметры макромолекул, за «точку отсчета» можно брать параметры макромолекул в θ-условиях. Например, гибкость макромолекул можно оценить, используя в качестве параметра жесткости коэффициент набухания клубка макромолекулы
̅2= √ ̅2 ,
θ
187

где ̅2 и ̅2 − соответственно среднеквадратичные расстояния между концами
θ
макромолекулы в реальных и θ-условиях.
11.1.5. Разбавленные растворы полимеров
Разбавленными считают такие растворы полимеров, в которых расстояния между макромолекулами превышают их гидродинамические размеры, при которых межмакромолекулярное взаимодействие несущественно.
Гибкая и хорошо сольватированная макромолекула в разбавленном растворе представляет собой объемный клубок со связанным и свободным растворителем внутри клубка. По приблизительным расчетам, для свободносочлененной цепи полиэтилена со степенью полимеризации 20000 объем, занимаемый растворителем, составляет около 84 % объема клубка. С учётом валентных и поворотных углов, а также сольватных оболочек объем растворителя ещё больший. При равных молекулярных массах, объем, занимаемый жесткими макромолекулами, существенно больше, чем гибких.
Полимеры исследуют в основном в виде разбавленных растворов. Одна из важных их особенностей разбавленных растворов полимеров − аномально высокая вязкость. Она намного превышает вязкость растворителя и резко возрастает с увеличением концентрации. Определить коэффициент вязкости можно с помощью уравнения Пуазейля, выведенного для случая ламинарного течения жидкости в цилиндрическом канале, т. е. при распределении
скоростей в сечении по параболоиду: |
|
|
||
|
4 |
|
(4.12) |
|
= 8 |
, |
|||
|
||||
где р – перепад давления на срезе канала: р = ρgh, где ρ – плотность
жидкости, g − ускорение свободного падения, h− гидравлический напор; R и l − соответственно радиус и длина канала; W − объем жидкости, вытекающей за время τ.
При измерении вязкости с помощью вискозиметра истечения (Уббелоде, Оствальда и т. п.) h – высота резервуара над срезом капилляра; R и l – радиус и длина капилляра; W – объем резервуара между рисками. Поскольку перечисленные размеры вискозиметра – величины постоянные, то для вискозиметра истечения (4.12) принимает вид:
|
|
= , |
(4.13) |
||||||
где K – постоянная вискозиметра: |
|
|
|
|
|
||||
|
|
|
|
|
4 |
|
|||
|
|
= |
|
|
|
. |
|
||
|
|
|
8 |
|
|||||
Для исследовательских целей принято использовать внесистемные |
|||||||||
величины и единицы измерения вязкости: |
|
||||||||
- относительную вязкость: |
|
|
|
|
|
||||
|
|
= |
р |
= |
р |
, , |
|||
отн |
|
|
|||||||
|
|
0 |
|
|
р |
0 |
|||
|
|
|
|
0 |
|
||||
|
|
|
|
|
|
|
|
|
188 |

где ηр и η0 – соответственно вязкости раствора и чистого растворителя; τр и τ0 – соответственно времена истечения раствора и чистого растворителя;
- удельную вязкость:
|
|
= |
р − 0 |
|
= |
р − 0 |
= − 1 ; |
||
уд |
|
|
|
|
|||||
|
|
0 |
|
|
|
|
отн |
||
|
|
|
|
0 |
|||||
- приведенную вязкость: |
|
|
уд |
|
|
||||
|
|
|
|
|
= |
, |
|||
|
|
|
пр |
|
|||||
|
|
|
|
|
|
|
|||
где С – концентрация раствора, г/дл. |
|
||||||||
|
|
|
|
||||||
Как видно из приведенных формул, ηотн и ηуд – безразмерные величины, а ηпр имеет размерность дл/г.
Важный момент в измерении вязкости разбавленных растворов полимеров – правильный выбор диаметра капилляра вискозиметра, т. к. в основу этой методики положена зависимость (4.11), выведенная из условия ламинарного течения.
Иногда разбавленные растворы полимеров существенно отличаются от ньютоновских жидкостей, поэтому их вязкость зависит от градиента скорости сдвига.
Методом вискозиметрии разбавленных растворов полимеров определяют их средневязкостную молекулярную массу ̅ . Для этого используют различные эмпирические и полуэмпирические выражения. Наиболее распространенным является эмпирическая формула, которую чаще всего называют уравнение Марка-Куна-Хувинка:
[ ] = ,
где К и α – константы, зависящие от природы полимера и растворителя, а также условий проведения эксперимента; [ ] − характеристическая вязкость:
[ ] = 0lim пр .
Характеристическую вязкость определяют путём экстраполяции зависимости η(С) на нулевую концентрацию (рис. 4.3).
Рис 4.3. К определению характеристической вязкости
11.1.6. Концентрированные растворы полимеров
Концентрированными называют растворы полимеров, в которых средние расстояния между макромолекулами позволяют им непосредственно взаимодействовать.
Разделение растворов полимеров на разбавленные и концентрированные с учётом только их концентрации не корректно. Необходимо также учитывать размеры клубков макромолекул, возможность образования связей полимер – растворитель и полимер – полимер, которые
189
влияют на вязкость. Качественные концентрационные интервалы удобно характеризовать произведением С[η] (безразмерной величиной):
-С[η] ≤ 1 – разбавленные растворы, взаимодействие между макромолекулами практически отсутствует;
-С[η] 1−10 – умеренно разбавленные растворы, имеет место взаимодействие и переплетение макромолекул отдельными сегментами;
-С[η] > 10 – концентрированные растворы с развитой пространственной флуктуационной структурой.
Реология концентрированных растворов очень схожа с реологией расплавов полимеров. Их вязкость зависит от ряда факторов, среди которых основными являются:
-молекулярная масса. Зависимость вязкости η от молекулярной массы
М– степенная: = . Для большинства полимеров х ≈ 3,4;
-природа полимера. Жесткоцепные полимеры склонны образовавать структурированные растворы, что приводит к возникновению дополнительной, т. н. структурной вязкости;
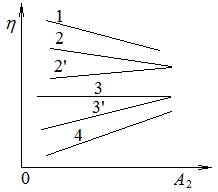
-качество растворителя влияет на вязкость концентрированных растворов полимеров в зависимости от гибкости цепей (рис. 4.4). С ухудшением качества растворителя (снижением А2), вязкость растворов жесткоцепных полимеров, особенно с полярными группами, возрастает в широком интервале
|
концентраций |
последних |
(1). |
Это |
Рис. 4.4. К влиянию качества |
обусловлено |
сильным межмолекулярным |
||
растворителя на вязкость |
взаимодействием с образованием прочных |
|||
нехимических связей, которые можно блокировать только сольватацией активных центров хорошим растворителем. Вязкость растворов затрудненногибких полимеров с ухудшением качества растворителя изменяется в зависимости от природы полимера и концентрационного интервала. Например, при концентрациях ниже 15 % вязкость растворов полистирола (2ʼ) и полиизобутилена (3ʼ) снижается, а выше 15 % у раствора полистирола вязкость возрастает (2), а у полиизобутилена изменяется незначительно (3). Вязкость растворов гибкоцепных полимеров, например полидиметилсилоксана, с ухудшением качества растворителя снижается при любых концентрациях (4);
- температура. Влияние температуры на вязкость растворов полимеров проявляется в зависимости от того, в какой степени она влияет на подвижность сегментов и изменение качества растворителя. Качество растворителя с ростом температуры, как правило, повышается. При этом вязкость изменяется, как указывалось выше, в зависимости от природы и гибкости цепи. Интенсификация теплового движения сегментов преимущественно снижает вязкость. Но если в результате возрастания
190
