
- •Основные понятия
- •1.2. Степень окисления или окислительное число атома в соединениях
- •Восстановители, окислители. Процессы окисления и восстановления
- •1.3.1. Восстановители
- •1.3.2. Окислители
- •1.4. Классификация окислительно-восстановительных реакций (типы овр)
- •1.4.1. Реакции межатомного или межмолекулярного окисления-восстановления
- •1.4.2. Реакции внутримолекулярного окисления – восстановления
- •1.4.3. Реакции диспропорционирования (самоокисления – самовосстановления)
- •2. Составление уравнений реакций окисления – восстановления
- •2.1. Метод электронного баланса
- •2.2. Метод ионно-электронного баланса (метод полуреакций)
- •Овр, протекающие в кислой среде
- •2.2.2. Овр, протекающие в щелочной среде
- •2.2.3. Овр, протекающие в присутствии молекул воды в левой части схемы
- •3.Некоторые особые случаи уравнений
- •3.1. Одновременное окисление атомов, находящихся
- •3.2. Овр в присутствии перекиси водорода (h2o2) и её соединений
- •3.3. Проявление восстановительной и окислительной способности разных атомов одного и того же элемента, входящих в состав разных веществ или одного и того же вещества
- •3.4. Особенности протекания овр при термитной сварке
- •3.5. Овр в присутствии окислителя – озона (о3)
- •3.6. Овр с участием органических соединений
- •4. Эквиваленты окислителей и восстановителей
- •5. Количественная характеристика окислительно-восстановительных реакций и направление овр
- •5.1. Электродный потенциал и его возникновение
- •5.2. Общие понятия о работе гальванического элемента
- •5.3. Стандартный электродный потенциал
- •5.4. Окислительно-восстановительные потенциалы
- •5.4.1. Направление овр в зависимости от значения величины энергии Гиббса ∆g
- •5.4.2. Условия, влияющие на величину овп и направление овр
- •5.4.3. Влияние на направление овр растворимости продукта реакции восстановленной формы
- •5.4.4. Константы равновесия окислительно-восстановительных реакций
- •5.4.5. Примеры решения задач на определение направления окислительно-восстановительных реакций
- •5.4.6. Задачи для самостоятельного решения
- •6. Механизмы некоторых реакций
- •7. Тестовый промежуточной контроль по теме овр
- •Задание: Коэффициент перед восстановителем в реакции
- •Задание: Константа равновесия окислительно-восстановительной системы пристандартных условиях ; равна:
- •Задание: Направление окислительно-восстановительной реакции при указанных условиях будет:
- •Задание: Окислительно-восстановительная реакция
- •Ответы: 1) 0,56 в; 2) 1,21 в; 3) 0,7 в; 4) 0,8 в; 5) 0,82 в.
- •Задание: Константа равновесия окислительно-восстановительной реакции
- •Задание: Константа равновесия реакции
- •Для стандартных условий равна:
- •8. Лабораторные работы
- •8.1. Рекомендации для подготовки к лабораторным занятиям
- •8.2. Реакции межмолекулярного окисления-восстановления Опыт 1. Окислительные свойства дихромата калия
- •Опыт 2. Окислительные свойства перманганата калия (kMnO4) в разных средах
- •Опыт 4. Восстановительные свойства галогенидов
- •Опыт 5. Взаимодействие растворов солей железа (ш) и иодида калия
- •8.3. Реакции внутримолекулярного окисления-восстановления
- •Опыт 2. Термическое разложение перманганата калия (kMnO4)
- •Опыт 3. Термическое разложение нитрата меди (II) (Cu(no3)2·2h2o)
- •8.4. Реакции диспропорционирования (самоокисления, самовосстановления) Опыт 1. Взаимодействие йода со щелочами
- •Опыт 2. Термическое разложение сульфита натрия
- •8.5. Двойственное поведение пероксида водорода в овр Опыт 1. Восстановительные свойства пероксида водорода
- •Опыт 2. Окислительные свойства пероксида водорода
- •8.6. Зависимость направления овр от рН среды Опыт 1 Влияние рН раствора на направление овр
- •8.7. Реакции, в которых окислитель или восстановитель
- •Расходуются также на связывание получаемых продуктов
- •Опыт 1. Окисление хлорид-иона концентрированной соляной кислоты
- •Двуокисью свинца (PbO2)
- •8.8. Учебно-исследовательская работа
- •10. Вопросы для домашнего задания
1.4. Классификация окислительно-восстановительных реакций (типы овр)
Все ОВР подразделяются: на реакции межатомного или межмолекулярного окисления–восстановления; реакции внутримолекулярного окисления–восстановления; реакции самоокисления, самовосстановления (диспропорционирования).
1.4.1. Реакции межатомного или межмолекулярного окисления-восстановления
В реакциях этого типа обмен электронами происходит между различными атомами, молекулами или ионами.
Mg + O2 = 2MgO
H2SO3 + 2H2S = 3S + 3H2O
2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4+K2SO4 + 5Fe2(SO4)3+8H2O
Такие реакции могут протекать в трех разных условиях-средах.
а) в кислой среде, в левой части уравнения присутствуют молекулы кислот, например:
K2Cr2O7 + 3H2S + 4H2SO4 → Cr2(SO4)3 + K2SO4 + 3S + 7H2O;
б) в щелочной среде, в левой части уравнения присутствуют молекулы основания, например:
3Zn + KNO2 + 5KOH = NH3 + 3K2ZnO2 + H2O;
в) в нейтральной среде, в левой части уравнения присутствуют молекулы воды, например:
5(NH4)2S2O8 + 8H2O + 2MnSO4→ 2HMnO4 + 7H2SO4 + 5(NH4)2SO4.
1.4.2. Реакции внутримолекулярного окисления – восстановления
Это такие реакции, когда в одной и той же молекуле сложного вещества атомы одного элемента проявляют свойства окислителя, а атомы другого элемента – свойства восстановителя. Простейшими примерами таких реакций могут служить реакции термического распада сложного вещества. Например:
![]() =
=
![]() +
+![]() +
+![]()
![]() =
=
![]() +3
+3![]()
-
окислитель
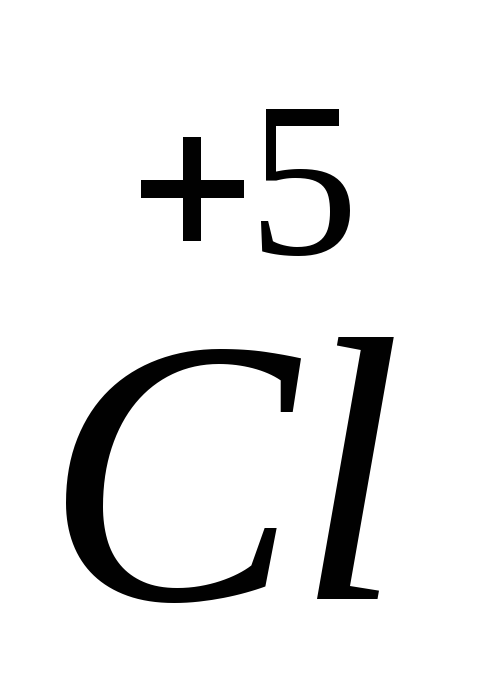 +
6ē =
+
6ē =

2 процесс восстановления
восстановитель
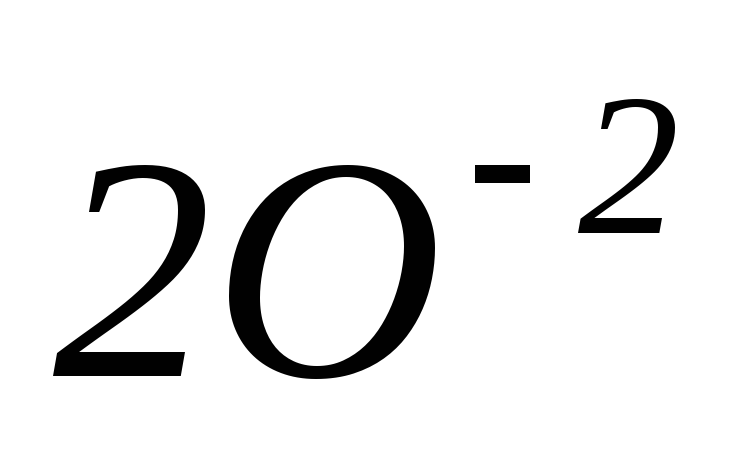 –4ē
=
–4ē
=
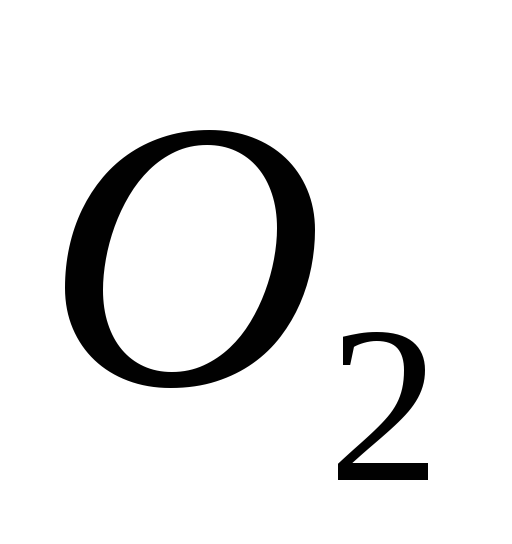
3 процесс окисления
1.4.3. Реакции диспропорционирования (самоокисления – самовосстановления)
В таких реакциях атомы одного элемента в соединении исходного вещества одновременно проявляют как окислительные, так и восстановительные свойства. Эти реакции протекают в том случае, когда атомы в соединении имеют промежуточную степень окисления и поэтому могут отдавать и принимать электроны и соответственно – окисляться и восстанавливаться, переходя в состояние с низшей или высшей степенью окисления.
Скорость реакции диспропорционирования связана с близостью внешних энергетических уровней в обоих состояниях атома.
![]()
![]() =
=
![]() +
+![]() +
+![]() ,
где соединения азота в степени окисления
(+3) проявляют как окислительные, так и
восстановительные свойства:
,
где соединения азота в степени окисления
(+3) проявляют как окислительные, так и
восстановительные свойства:
-
восстановитель
 -2ē
=
-2ē
=

процесс окисления
окслитель
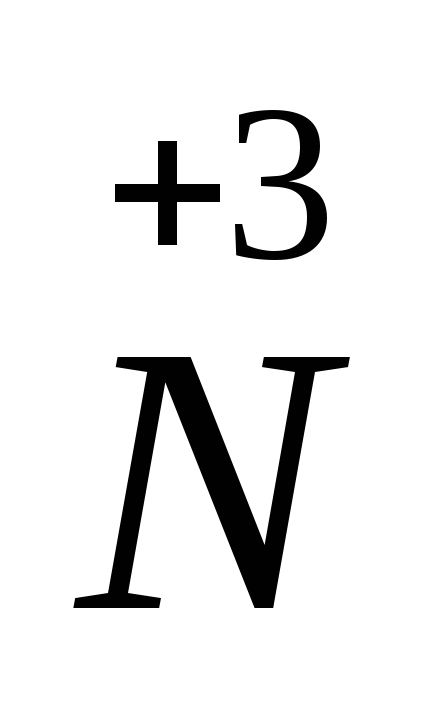 +
ē =
+
ē =

процесс восстановления
2Sº
+ 6KOH
=
![]() +
+
![]() + 2H2O
+ 2H2O
Sº - выполняет роль и окислителя и восстановителя:
-
восстановитель
Sº – 4ē =
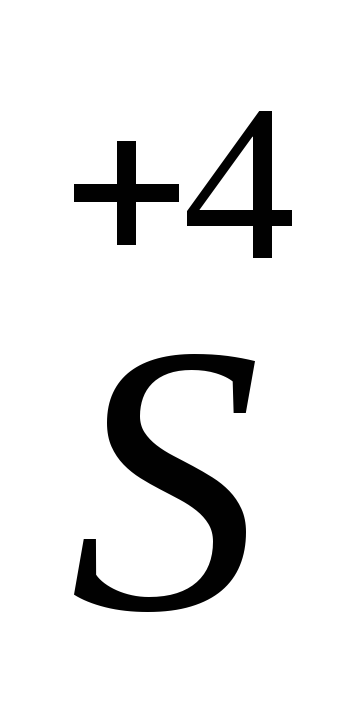
процесс окисления
окислитель
Sº + 2ē =

процесс восстановления
2. Составление уравнений реакций окисления – восстановления
Для составления уравнений ОВР надо знать свойства взаимодействующих веществ, учитывать значения окислительно-восстановительных потенциалов (ОВП) в разных средах (глава 5.4.2), на их основании определять направление протекания ОВР и уметь написать на этом основании продукты реакции правой части уравнения.
Правильно составленное уравнение реакции является выражением сохранения массы веществ. Поэтому необходимо следить за тем, чтобы количество атомов одного и того же элемента в исходных веществах и продуктах реакции было одинаковым. Применяют два основных метода составления реакций окисления-восстановления:
– метод электронного баланса;
– метод ионно-электронного баланса (метод полуреакций).
