
- •Основные понятия
- •1.2. Степень окисления или окислительное число атома в соединениях
- •Восстановители, окислители. Процессы окисления и восстановления
- •1.3.1. Восстановители
- •1.3.2. Окислители
- •1.4. Классификация окислительно-восстановительных реакций (типы овр)
- •1.4.1. Реакции межатомного или межмолекулярного окисления-восстановления
- •1.4.2. Реакции внутримолекулярного окисления – восстановления
- •1.4.3. Реакции диспропорционирования (самоокисления – самовосстановления)
- •2. Составление уравнений реакций окисления – восстановления
- •2.1. Метод электронного баланса
- •2.2. Метод ионно-электронного баланса (метод полуреакций)
- •Овр, протекающие в кислой среде
- •2.2.2. Овр, протекающие в щелочной среде
- •2.2.3. Овр, протекающие в присутствии молекул воды в левой части схемы
- •3.Некоторые особые случаи уравнений
- •3.1. Одновременное окисление атомов, находящихся
- •3.2. Овр в присутствии перекиси водорода (h2o2) и её соединений
- •3.3. Проявление восстановительной и окислительной способности разных атомов одного и того же элемента, входящих в состав разных веществ или одного и того же вещества
- •3.4. Особенности протекания овр при термитной сварке
- •3.5. Овр в присутствии окислителя – озона (о3)
- •3.6. Овр с участием органических соединений
- •4. Эквиваленты окислителей и восстановителей
- •5. Количественная характеристика окислительно-восстановительных реакций и направление овр
- •5.1. Электродный потенциал и его возникновение
- •5.2. Общие понятия о работе гальванического элемента
- •5.3. Стандартный электродный потенциал
- •5.4. Окислительно-восстановительные потенциалы
- •5.4.1. Направление овр в зависимости от значения величины энергии Гиббса ∆g
- •5.4.2. Условия, влияющие на величину овп и направление овр
- •5.4.3. Влияние на направление овр растворимости продукта реакции восстановленной формы
- •5.4.4. Константы равновесия окислительно-восстановительных реакций
- •5.4.5. Примеры решения задач на определение направления окислительно-восстановительных реакций
- •5.4.6. Задачи для самостоятельного решения
- •6. Механизмы некоторых реакций
- •7. Тестовый промежуточной контроль по теме овр
- •Задание: Коэффициент перед восстановителем в реакции
- •Задание: Константа равновесия окислительно-восстановительной системы пристандартных условиях ; равна:
- •Задание: Направление окислительно-восстановительной реакции при указанных условиях будет:
- •Задание: Окислительно-восстановительная реакция
- •Ответы: 1) 0,56 в; 2) 1,21 в; 3) 0,7 в; 4) 0,8 в; 5) 0,82 в.
- •Задание: Константа равновесия окислительно-восстановительной реакции
- •Задание: Константа равновесия реакции
- •Для стандартных условий равна:
- •8. Лабораторные работы
- •8.1. Рекомендации для подготовки к лабораторным занятиям
- •8.2. Реакции межмолекулярного окисления-восстановления Опыт 1. Окислительные свойства дихромата калия
- •Опыт 2. Окислительные свойства перманганата калия (kMnO4) в разных средах
- •Опыт 4. Восстановительные свойства галогенидов
- •Опыт 5. Взаимодействие растворов солей железа (ш) и иодида калия
- •8.3. Реакции внутримолекулярного окисления-восстановления
- •Опыт 2. Термическое разложение перманганата калия (kMnO4)
- •Опыт 3. Термическое разложение нитрата меди (II) (Cu(no3)2·2h2o)
- •8.4. Реакции диспропорционирования (самоокисления, самовосстановления) Опыт 1. Взаимодействие йода со щелочами
- •Опыт 2. Термическое разложение сульфита натрия
- •8.5. Двойственное поведение пероксида водорода в овр Опыт 1. Восстановительные свойства пероксида водорода
- •Опыт 2. Окислительные свойства пероксида водорода
- •8.6. Зависимость направления овр от рН среды Опыт 1 Влияние рН раствора на направление овр
- •8.7. Реакции, в которых окислитель или восстановитель
- •Расходуются также на связывание получаемых продуктов
- •Опыт 1. Окисление хлорид-иона концентрированной соляной кислоты
- •Двуокисью свинца (PbO2)
- •8.8. Учебно-исследовательская работа
- •10. Вопросы для домашнего задания
2.1. Метод электронного баланса
В этом методе подсчет числа принятых и отданных электронов производится на основании значений степеней окисления элементов до, и после реакции.
Порядок нахождения коэффициентов в ОВР методом электронного баланса можно видеть из следующего примера. Пусть взаимодействует бромистый водород HBr с концентрированной серной кислотой. В результате взаимодействия образуется свободный бром Br2 и сернистый газ SO2. Подбор коэффициентов осуществляется в несколько этапов:
а) записывают схему ОВР в молекулярной форме:
![]() ;
;
б) определяют степень окисления элементов до и после реакции. Величину степени окисления записывают над символами, знак заряда указывают перед цифрой;
в) определяют, какие из элементов изменили степени окисления (в этой реакции бром и сера);
г) находят восстановитель и окислитель, рассуждая таким образом: ион брома, имевший окислительное число -1, перешел в нейтральный атом (приобрел окислительное число, равное нулю). Следовательно, ион брома потерял один электрон и является восстановителем, при этом он окислился. Окислительное число серы понизилось с +6 до +4, значит, сера S+6 в ионе SO42– присоединила 2 электрона и является окислителем, при этом она восстановилась;
д) записывают имевшее место в ходе реакции перемещение электронов в виде электронных уравнений, уравнивая число атомов слева и справа уравнений:
|
2Br¯ – 2ē = Brº2 |
процесс окисления |
|
|
процесс восстановления ; |
е) поскольку количество электронов отданных восстановителем и приобретенных окислителем, должно быть одинаковым, то подбираются множители для окислителя и восстановителя с тем расчетом, чтобы соблюдать это равенство. Для этого справа проводят вертикальную черту, пишут за ней соответствующие множители:
-
2Br- – 2e = Brº2
1
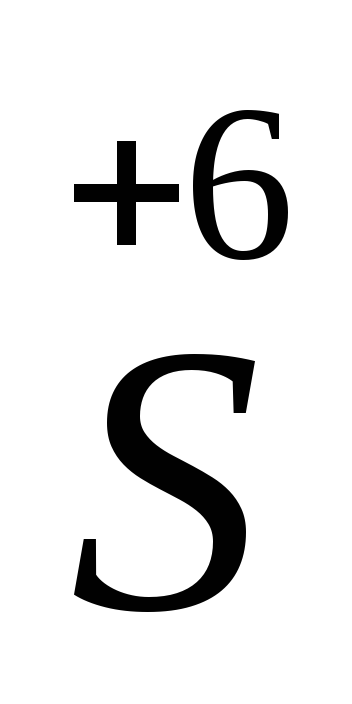 +
2 ē =
+
2 ē =
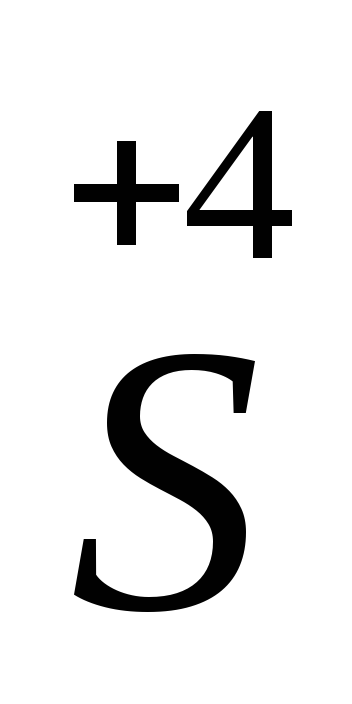
1
Из баланса вытекает вывод, что на каждый атом серы должно приходиться два иона Br–. Следовательно, с одной молекулой H2SO4 реагируют две молекулы HBr. Эти цифры проставляются перед соответствующими молекулами как коэффициенты:
2HBr + H2SO4 → Br2 + SO2 + 2H2O;
ж) далее, сравнивая левую и правую части схемы реакции, замечаем, что в левой части рассматриваемого примера имеется 4 атома водорода и 2 атома кислорода, которых недостает в правой части схемы. Очевидно, что в результате реакций образуется еще 2 молекулы воды;
и) составляется уравнение реакции в окончательном виде. Стрелку можно заменить на знак равенства:
2HBr + H2SO4 = Br2 + SO2 + 2H2O;
к) проверяется правильность составленного уравнения путем подсчета атомов кислорода и водорода в обеих частях уравнения.
Рассмотренный выше пример относится к числу простейших. При определении же коэффициентов ОВР, которые характеризуются наличием молекул кислот, оснований или воды в левой части уравнения (см. 1.4.1), задача усложняется необходимостью нахождения коэффициента перед молекулами упомянутых веществ.
Рассмотрим пример подбора коэффициентов для следующей ОВР, протекающей с участием молекулы кислоты:
H2S + KMnO4 + H2SO4 → S + K2SO4 + H2O + MnSO4
-
 –2ē = S°
–2ē = S° 5 процесс окисления
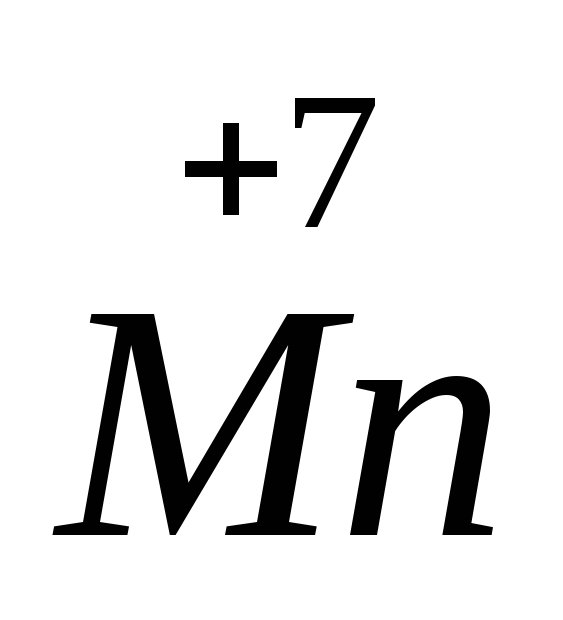 + 5ē =
+ 5ē =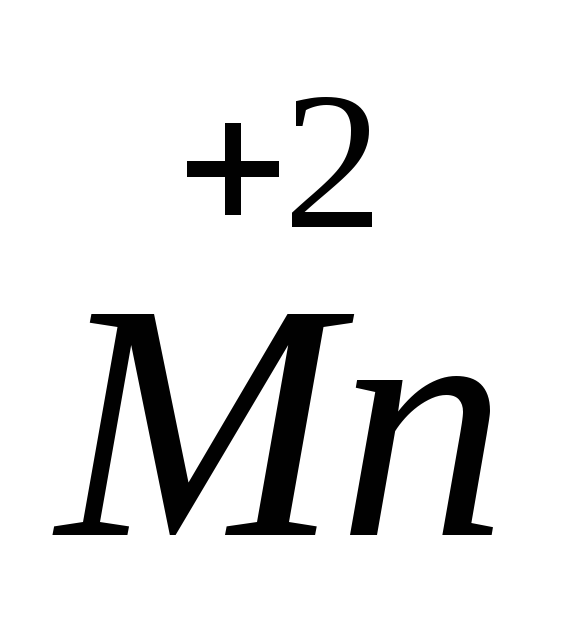
2 процесс восстановления
5H2S + 2KMnO4 + H2SO4 → 5S + 2MnSO4 + K2SO4 + H2O
Задача решается аналогично предыдущей до пункта «ж». Далее уравниваются числа атомов тех элементов, которые имеют постоянное окислительное число. Это касается щелочных и щелочноземельных металлов. В данной реакции число ионов калия в левой части реакции равно числу ионов калия в правой части реакции, поэтому дополнительные коэффициенты не вводятся.
Затем определяют коэффициент перед формулой кислоты.*Для этого подсчитывают число кислотных остатков правой части уравнения (в данном примере три) и вычитают из него число таких же кислотных остатков, содер-жащихся в восстановителе или окислителе (в данном случае кислота не играет роли ни окислителя, ни восстановителя, поэтому оно равно нулю), и по разности 3 – 0 = 3 находят коэффициент для молекулы кислоты перед кислотой ставится коэффициент три.
В последующем определяют число молекул образовавшейся воды. Для этого подсчитывается число атомов водорода в левой части уравнения, в данной реакции их 16, отсюда следует, что образуется 8 молекул воды (на образование воды пошел кислород, освободившийся при восстановлении KMnO4). Наконец, ставится коэффициент 8 перед водой и стрелка заменяется знаком равенства.
5H2S + 2KMnO4 + 3H2SO4 = 5S + MnSO4 + K2SO4 + 8H2O
Проверяется правильность составленного уравнения путем подсчета атомов кислорода в обеих частях уравнения.
Рассмотрим другой пример, когда в левой части уравнения имеется молекула основания.**
NaСrO2 + Br2 + NaOH = Na2CrO4 + NaBr + H2O
В щелочной среде подбор коэффициентов осуществляется так же, как это делалось выше, до пункта «ж».
Na![]() O2
+ Br°2
+ NaOH → Na2
O2
+ Br°2
+ NaOH → Na2![]()
![]() 4
+ Na
4
+ Na![]() + H2O
+ H2O
-
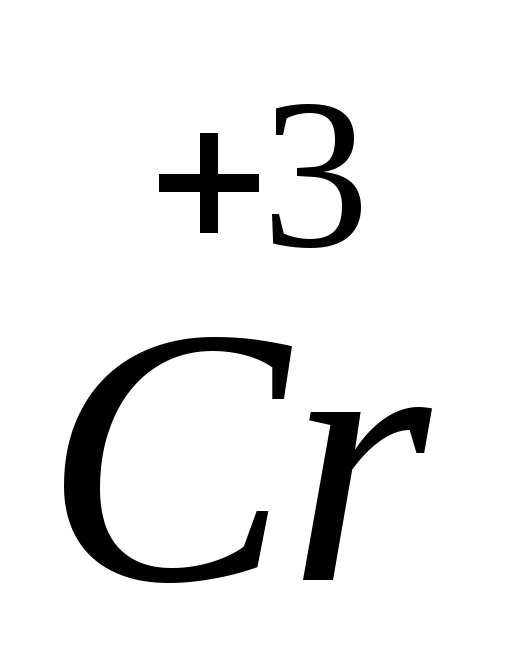 –3ē =
–3ē =
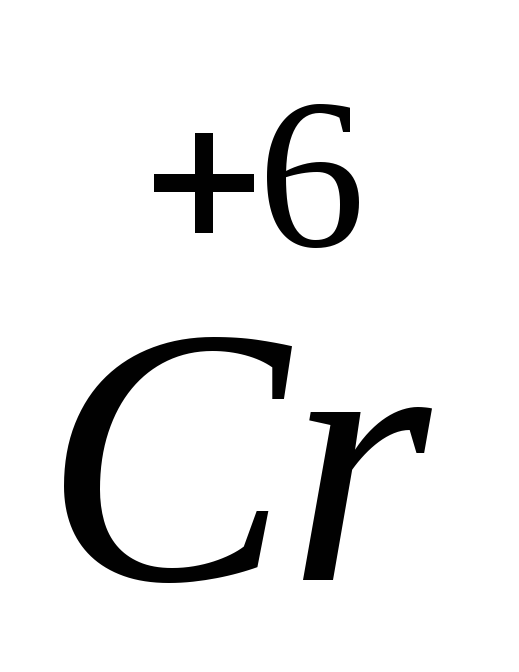
2
Br2 +2ē = 2Br¯
3
2NaCrO2 + 3Br2 + 8NaOH – 2Na2CrO4 + 6NaBr + H2O
Затем коэффициент перед молекулой основания находят как разницу между числом ионов металлов (в данном случае ионов Na+), входящих в состав молекулы щелочи, и числом тех же ионов (если таковые имеются), входящих в состав молекул восстановителя и окислителя. В данном примере этот коэффициент равен 10 – 2 = 8. Перед молекулой щелочи ставится найденный коэффициент. По числу атомов водорода в левой части уравнения находят коэффициент перед молекулой воды. В данном примере он равен 4. Все найденные коэффициенты расставляются, и стрелка заменяется знаком равенства.
Проверяется правильность составленного уравнения путем подсчета атомов кислорода в обеих частях уравнения.
Метод электронного баланса применим для любых ОВР, протекающих в растворах, расплавах, твердых системах гомогенного и гетерогенного характера, например, при сплавлении, обжиге, горении и т.д. Вследствие того, что понятия – «окислительное число» или «степень окисления» имеют формальный характер, то используемые при этом схемы также являются формальными и поэтому применительно к растворам не отражают реально протекающих в них процессов.
Метод неудобен для подсчета окислительного числа элементов в перекисных, органических, полисульфидных соединениях, в полииодидах, некоторых комплексных соединениях и т.д., написание структурных формул которых вызывает значительные затруднения.
