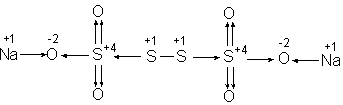- •Основные понятия
- •1.2. Степень окисления или окислительное число атома в соединениях
- •Восстановители, окислители. Процессы окисления и восстановления
- •1.3.1. Восстановители
- •1.3.2. Окислители
- •1.4. Классификация окислительно-восстановительных реакций (типы овр)
- •1.4.1. Реакции межатомного или межмолекулярного окисления-восстановления
- •1.4.2. Реакции внутримолекулярного окисления – восстановления
- •1.4.3. Реакции диспропорционирования (самоокисления – самовосстановления)
- •2. Составление уравнений реакций окисления – восстановления
- •2.1. Метод электронного баланса
- •2.2. Метод ионно-электронного баланса (метод полуреакций)
- •Овр, протекающие в кислой среде
- •2.2.2. Овр, протекающие в щелочной среде
- •2.2.3. Овр, протекающие в присутствии молекул воды в левой части схемы
- •3.Некоторые особые случаи уравнений
- •3.1. Одновременное окисление атомов, находящихся
- •3.2. Овр в присутствии перекиси водорода (h2o2) и её соединений
- •3.3. Проявление восстановительной и окислительной способности разных атомов одного и того же элемента, входящих в состав разных веществ или одного и того же вещества
- •3.4. Особенности протекания овр при термитной сварке
- •3.5. Овр в присутствии окислителя – озона (о3)
- •3.6. Овр с участием органических соединений
- •4. Эквиваленты окислителей и восстановителей
- •5. Количественная характеристика окислительно-восстановительных реакций и направление овр
- •5.1. Электродный потенциал и его возникновение
- •5.2. Общие понятия о работе гальванического элемента
- •5.3. Стандартный электродный потенциал
- •5.4. Окислительно-восстановительные потенциалы
- •5.4.1. Направление овр в зависимости от значения величины энергии Гиббса ∆g
- •5.4.2. Условия, влияющие на величину овп и направление овр
- •5.4.3. Влияние на направление овр растворимости продукта реакции восстановленной формы
- •5.4.4. Константы равновесия окислительно-восстановительных реакций
- •5.4.5. Примеры решения задач на определение направления окислительно-восстановительных реакций
- •5.4.6. Задачи для самостоятельного решения
- •6. Механизмы некоторых реакций
- •7. Тестовый промежуточной контроль по теме овр
- •Задание: Коэффициент перед восстановителем в реакции
- •Задание: Константа равновесия окислительно-восстановительной системы пристандартных условиях ; равна:
- •Задание: Направление окислительно-восстановительной реакции при указанных условиях будет:
- •Задание: Окислительно-восстановительная реакция
- •Ответы: 1) 0,56 в; 2) 1,21 в; 3) 0,7 в; 4) 0,8 в; 5) 0,82 в.
- •Задание: Константа равновесия окислительно-восстановительной реакции
- •Задание: Константа равновесия реакции
- •Для стандартных условий равна:
- •8. Лабораторные работы
- •8.1. Рекомендации для подготовки к лабораторным занятиям
- •8.2. Реакции межмолекулярного окисления-восстановления Опыт 1. Окислительные свойства дихромата калия
- •Опыт 2. Окислительные свойства перманганата калия (kMnO4) в разных средах
- •Опыт 4. Восстановительные свойства галогенидов
- •Опыт 5. Взаимодействие растворов солей железа (ш) и иодида калия
- •8.3. Реакции внутримолекулярного окисления-восстановления
- •Опыт 2. Термическое разложение перманганата калия (kMnO4)
- •Опыт 3. Термическое разложение нитрата меди (II) (Cu(no3)2·2h2o)
- •8.4. Реакции диспропорционирования (самоокисления, самовосстановления) Опыт 1. Взаимодействие йода со щелочами
- •Опыт 2. Термическое разложение сульфита натрия
- •8.5. Двойственное поведение пероксида водорода в овр Опыт 1. Восстановительные свойства пероксида водорода
- •Опыт 2. Окислительные свойства пероксида водорода
- •8.6. Зависимость направления овр от рН среды Опыт 1 Влияние рН раствора на направление овр
- •8.7. Реакции, в которых окислитель или восстановитель
- •Расходуются также на связывание получаемых продуктов
- •Опыт 1. Окисление хлорид-иона концентрированной соляной кислоты
- •Двуокисью свинца (PbO2)
- •8.8. Учебно-исследовательская работа
- •10. Вопросы для домашнего задания
ВВЕДЕНИЕ
Окислительно-восстановительные процессы принадлежат к числу наиболее распространенных химических реакций и имеют большое значение в теории и практике.
Окисление-восстановление – один из важнейших процессов природы. Дыхание, усвоение углекислого газа растениями с выделением кислорода, обмен веществ и ряд биологических процессов в основе своей являются окислительно-восстановительными реакциями.
Сжигание топлива в топках паровых котлов и двигателях внутреннего сгорания, электролитическое осаждение металлов, процессы, происходящие в гальванических элементах и аккумуляторах, включают реакции окисления-восстановления.
Получение простых веществ, например, железа, хрома, марганца, никеля, кобальта, вольфрама, меди, серебра, цинка, серы, хлора, йода и т.д. и ценных химических продуктов, например, аммиака, щелочей, сернистого газа, азотной, серной и других кислот, основано на окислительно-восстановительных реакциях.
Производство строительных материалов, пластических масс, удобрений, медикаментов и т.д. также было бы невозможно без использования окислительно-восстановительных процессов.
Известно, что сероводород токсичен, коррозионно агрессивен и имеет неприятный запах. После сгорания сероводород окисляется до диоксида серы (SO2), вносящего большой вклад в кислотные дожди и выбросы парникового газа. Удаление сероводорода с использованием окислительно-восстановительных реакций является очень важной экологической проблемой.
Суть реакции удаления сероводорода из потоков газа в нефтегазоперерабатывающей, металлургической промышленности заключается в окислении гидросульфидных ионов (HS–) до элементарной серы путем восстановления Fe3+→Fe2+ с последующим повторным окислением ионов Fe2+ до Fe3+ посредством контакта с воздухом по схеме:
H2S(горячий пар) + Н2О(жид.) → Н2S(ж.) (1)
Н2S(ж.) → H+ + HS– (2)
HS– + 2Fe3+ → So + 2Fe2+ + H+ (3)
½ O2(воздух) + H2O(ж) → ½ O2 (ж) (4)
2Fe2+ + 1/2O2(воздух ж)+H2O → 2Fe3+ + 2OH– (5)
Суммарная реакция:
(Fe)
Н2S(пар)+1/2O2(пар) → S0 + H2O (6)
Уравнение 1 и 2 представляют абсорбцию H2S в водный раствор хелатного соединения железа и его последующую ионизацию, а уравнение 3 представляет окисление гидросульфидных ионов до элементарной серы, сопровождающееся восстановлением трехвалентного железа до двухвалентного состояния. Уравнения 4 и 5 представляют абсорбцию кислорода в водный раствор с последующим окислением двухвалентного железа обратно в трехвалентное состояние.
Fe3+ служит двум целям:
а) Fe3+ является и электронным донором и акцептором;
б) Fe3+ выступает в роли катализатора, ускоряя суммарную реакцию.
Fe3+ – каталитический реагент.
На процессах окисления-восстановления в аналитической химии основаны методы объемного анализа: перманганатометрия, йодометрия, броматометрия и другие, играющие важную роль при контролировании производственных процессов и выполнении научных исследований. Поэтому изучению окислительно-восстановительных реакций при изучении курса химии необходимо уделить должное внимание.
1. ОБЩАЯ ХАРАКТЕРИСТИКА ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
Основные понятия
По современным представлениям окислительно-восстановительные реакции (ОВР) – это реакции, которые протекают с переходом (чаще с оттягиванием) электронов от одних атомов (в составе ионов, молекул) к другим.
Частицы, к которым оттягиваются (переходят), электроны, называются окислителями, во время реакции они восстанавливаются. Процесс присоединения (оттягивания) электронов называется восстановлением.
Пример, H2+2Na=2NaH (1)
1) восстановитель 2Nao–2ē=2Na+ окисление
2) окислитель Н2+2ē=2Н¯ восстановление
Н2 – окислитель, восстанавливается до гидрид-иона Н¯.
В реакции Н2+Br2=2HBr (2)
бром является окислителем, он приобретает электрон и восстанавливается, а водород – восстановитель.
1) окислитель Br2+2ē=2Br ¯ восстановление
2) восстановитель Н2 – 2ē=2Н+ окисление
Частицы (атомы, молекулы, ионы), которые способны отдавать электроны в ходе ОВР, называются восстановителями; в примере (1) восстановитель натрий, а в примере (2) восстановитель – молекула водорода. Процесс отдачи электронов называется окислением.
Следует отметить, что в ОВР в большинстве случаев происходит не потеря или приобретение электронов, а только смещение электронного облака связи от одной частицы (иона, атома, молекулы) к другой с образованием ковалентной связи. Поэтому правильнее говорить об изменении электронной плотности у восстановителя (обеднение электронами) и окислителя (обогащение электронами). Перераспределение электронной плотности (перестройка электронных орбиталей и изменение электронного состояния участвующих веществ) приводит к образованию новых веществ с определенным строением и химическими свойствами. Для составления уравнений ОВР не имеет большого значения, какая связь при этих реакциях образуется – ионная или ковалентная. Поэтому для простоты говорят о присоединении или отдаче электронов независимо от типа связи.
1.2. Степень окисления или окислительное число атома в соединениях
Переход (смещение) электронов может быть более или менее значительным и для того, чтобы не учитывать этого обстоятельства (весьма важного для оценки характера химической связи) и облегчить составление ОВР. С этой целью ввели понятие окислительного числа (О.Ч.) или степени окисления (С.О.) атома в молекуле или ионе. Степень окисления– условный электрический заряд атома элемента в данной частице (молекуле, ионе), который он может приобрести в том случае, если все его связи считать условно ионными. Таким образом, во всех связях подразумевается полный переход электронов от менее электроотрицательного элемента к более электроотрицательному.
Следовательно, степень окисления водорода в соединении NaHравна минус единице, а в молекулеHBrплюс единице. Степень окисления, равная минус единице, означает, что атом в данной молекуле как бы присоединил один электрон соседа. Например, свободный атом водорода имеет электронную формулу 1s1, а водород с С.О., равной –1, будет иметь электронную формулу 1s2.
1s1+ē ↔ 1s2
Из такой записи непосредственно видно, что свободный водород принимает электрон и потому является окислителем.
Степень окисления, равная плюс единице, означает, что атом элемента в данной молекуле как бы отдал один электрон соседнему атому. При этом, конечно, меняется его электронная формула. Так, свободный атом натрия имеет электронную формулу 1s22s22p63s1, а натрий в С.О., равной +1, будет иметь формулу1s22s22p63so, т.е. натрий1s22s22p63s1отдал один электрон и потому является восстановителем (пример 1).
В разных молекулах С.О. данного элемента может быть различной. Например, степень окисления водорода в молекулах HBrиNaHравна соответственно +1 и –1.
На основании изложенного можно дать такое определение ОВР:
ОВР – это реакции, сопровождающиеся изменением степени окисления (С.О.) атомов элементов.
Не следует отождествлять степень окисления элемента с его валентностью. Валентность – это число, показывающее, сколько связей образовано элементом в данной молекуле. Поэтому валентность знака заряда не имеет. Например, в молекуле NH4Cl валентность азота равна 4, а степень окисления равна минус –3. В молекулеН2С2О4валентность углерода равна 4, что видно из строения
![]() ,
а степень окисления равна +3. В молекуле
азотаN≡Nвалентность его равна 3, а степень
окисления равна 0. В молекулах Н2,
О2, Сl2и др.
оба атома равноценны, электроны от
атомов не оттягиваются и не притягиваются
и потому степень окисления равна 0.
,
а степень окисления равна +3. В молекуле
азотаN≡Nвалентность его равна 3, а степень
окисления равна 0. В молекулах Н2,
О2, Сl2и др.
оба атома равноценны, электроны от
атомов не оттягиваются и не притягиваются
и потому степень окисления равна 0.
В молекуле Н2О2(Н:О:О:Н)степень окисления кислорода равна –1; и общая электронная пара двух атомов кислорода принадлежит им в равной степени. Перетягиваются электронные пары только со стороны атомов водорода, поэтому степень окисления водорода в Н2О2равна +1.
Можно считать, что положительная степень окисления атома в соединении совпадает с числом оттянутых от атома общих электронных пар, а отрицательная степень окисления соответствует числу принятых атомом общих электронных пар в рассматриваемом соединении.
Принято указывать степень окисления
сверху символа элемента со знаком «+»
или «–» перед цифрой (например,
![]() ).
Не следует путать порядок написания
степени окисления элементов в соединении
и зарядов ионов в растворе. Для обозначения
заряда ионов знаки «+» и «–» ставятся
после арабской цифры, например,Cu2+,
Na+, SO42–,
Cr3+.
Заряды (+1) и (–1) обозначают просто
знаками «+» и «–».
).
Не следует путать порядок написания
степени окисления элементов в соединении
и зарядов ионов в растворе. Для обозначения
заряда ионов знаки «+» и «–» ставятся
после арабской цифры, например,Cu2+,
Na+, SO42–,
Cr3+.
Заряды (+1) и (–1) обозначают просто
знаками «+» и «–».
Для определения степени окисления используют следующие положения:
степени окисления атомов в простых веществах равны нулю (F2o, Cao, Mgo, N2o, O2o, Feo);
водород в соединениях имеет степень окисления +1, за исключением гидридов – солеподобных соединений активных металлов (NaH, CaH2и др.), в которых степень окисления водорода равна (–1);
степени окисления кислорода в соединениях обычно (–2). Исключение составляют пероксиды – соединения, содержащие группу –О–О–,где степень окисления кислорода (–1), и некоторые другие вещества (надпероксиды, озониды, фториды кислорода); в соединенииOF2степень окисления кислорода +2;
во всех соединениях атомы металлов имеют только положительные окислительные числа (Na2+SO4, Cr+3Cl3, Ca+2Cl2, K2+CO3и др.). При этом металлы главных подгруппI,II,IIIгрупп периодической таблицы Д.И. Менделеева имеют постоянные положительные значения степени окисления, которая равна номеру группы;
атомы фтора, как элемента с наибольшей электроотрицательностью, имеют в соединениях окислительное число, равное (–1);
алгебраическая сумма окислительных чисел атомов в сложных ионах равна заряду этого иона, например:
в перманганат-ионе (Mn+7O4–2)–: +7+(–2)·4= 1–;
сульфат-ионе (S+6O4–2)2–: +6+(–2)·4=2–;
дихромат-ионе (Cr2+6O7–2)2–: +6+(–2)·4=2–;
алгебраическая сумма степеней окисления атомов в молекуле с учетом атома с неизвестной С.О.=х приравнивается нулю. Например, в молекуле K2Cr2O7 (1∙2+2х+(–2)∙7)=0 2х=12 х=6, т.к. молекула в целом электронейтральна.
для комплексных соединений обычно указывают степень окисления центрального атома, иона – комплексообразователя. Например, [Cu(OH)4]SO4, [Zn(H2O)4]Cl2, K2[PtCl6]– степень окисления меди равна +2, цинка +2 и платины +4;
химические связи в большинстве органических соединений имеют слабо выраженный полярный характер; присоединение к ним таких электроотрицательных элементов, как F, O, Cl, N, приводит к изменению электронной плотности между атомами углерода и указанными элементами, а следовательно, и к увеличению полярности связи между ними. Степень окисления атомов в них определяется так же, как и в ковалентных полярных соединениях.
Эти положения позволяют легко определить степень окисления атома элемента, если известны степени окисления остальных атомов элементов, входящих в состав иона или молекулы. Для этого нужно решить простое уравнение с одним неизвестным.
Пример 1. Найти степень окисления серы в молекуле H2S2O7. Составляем для этой молекулы следующее уравнение:
х∙2+1∙2+(–2)∙7=0,где
х – С.О. серы в данной молекуле;
2 – число атомов серы в данной молекуле;
1 – С.О. водорода;
2 – число атомов водорода;
(–2) – степень окисления кислорода;
7 – число атомов кислорода.
2х+2+(–14)=0
Решая указанное уравнение с одним неизвестным, находим 2х=12, а х=6.
Пример 2. Найти степень окисления йода в молекуле H5IO6. Составляем для этой молекулы уравнение:
(1∙5)+х+(–2)·6=0, где
1 – степень окисления водорода;
5 – число атомов водорода;
х – степень окисления йода;
(–2) – степень окисления кислорода; 6 – число атомов кислорода.
Решая уравнение, получаем х=+7.
Пример 3. Найти степень окисления Sв молекулеNa2S4O6. Составляем для нее уравнение:
1∙2+х∙4+(–2)∙6=0, где
1 – С.О. натрия;
2 – число атомов натрия;
х – С.О. серы;
4 – число атомов серы в молекуле;
(–2) – С.О. кислорода. Решая уравнение, получаем х=2,5.
Пример 4. Определить С.О. серы в соединении
![]() .
Структурная формула соединения
.
Структурная формула соединения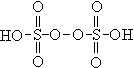 .
При решении уравнения с одним неизвестным
получаем+1∙2+2х+(–2)∙8=0 2х=14 х=7.
Значения С.О. серы в примерах 3 и 4 являются
формальными, т.к. они не соответствуют
электронному строению атома. У атома
серы шесть валентных электронов, поэтому
степень окисления серы не может быть
больше 6 (пример 4) и не может быть дробным
(пример 3).
.
При решении уравнения с одним неизвестным
получаем+1∙2+2х+(–2)∙8=0 2х=14 х=7.
Значения С.О. серы в примерах 3 и 4 являются
формальными, т.к. они не соответствуют
электронному строению атома. У атома
серы шесть валентных электронов, поэтому
степень окисления серы не может быть
больше 6 (пример 4) и не может быть дробным
(пример 3).
Чтобы определить действительное значение степени окисления в подобных случаях, необходимо составить электронно-графические формулы (ЭГФ) молекул рассматриваемых соединений и отметить направление смещения общих электронных пар.
В соединении Na2S4O6степени окисления атомов серы различны. Например:
|
ЭГФ –
|
|
, |
где черточка с указанием стрелки – смещенная электронная пара.
У двух атомов серы, связанных с кислородными атомами, степени окисления равны +4, а у двух других (+1). Допускаем, что электроотрицательность атомов серы, образующих пять ковалентных связей с атомами кислорода, выше электроотрицательности других атомов серы.
В случае сложных ионов, например,
![]() ,
,
степень окисления серы, хрома, фосфора, кремния, олова, меди находится аналогичным путем. Исходят из того, что алгебраическая сумма степеней окисления элементов данного иона с учетом числа их атомов равна указанному заряду иона.
Пример 1. Определить С.О. серы в ионе SO32–.
х + (–2)∙3 = 2 –;
(–2) – С.О. кислорода;
3 – число атомов кислорода;
(2–) – заряд всего иона.
Отсюда легко находим х=4.
Пример 2. Определить С.О. кремния в ионе SiF62–.
х + (–1)∙6 = 2–
(х)– С.О. кремния;
(–1) – С.О. фтора;
6 – число атомов фтора;
(2–) – заряд всего иона.
Отсюда х=4.
Пример 3. Определить С.О. олова в ионе [Sn(OH)6]2–.
х + (–1)∙6 = 2–
(х)– С.О. олова;
(–1) – С.О. гидроксильной группы;
(2–) – заряд всего иона.
Отсюда находят х=4.
Пример 4. Определить С.О. меди в ионе [Cu(NH3)4]2+.
х + 0∙4 = 2+
(х)– С.О. меди;
(0) – С.О. молекулы аммиака (как всякой молекулы, оно равно нулю);
(2+) – заряд иона.
Отсюда находят х=2.
Пример 5. Определить С.О. хрома в ионе[Cr(OH)5(H2O)]2–
х + (–1)∙5 + 0∙1 = 2–
(х) – С.О. хрома;
(–1) – С.О. гидроксильной группы;
(0) – С.О. молекулы воды;
1 – число молекул воды;
(2–) – заряд всего сложного иона.
Отсюда находят х=3.
В органических соединениях: метане CH4, метиловом спирте СН3ОН, формальдегиде СН2О, муравьиной кислоте НСООН, а также в диоксиде углерода СО2– степени окисления углерода составляют соответственно –4, –2, 0, +2, +4, тогда как валентность углерода во всех этих соединениях равна четырем. С.О. углерода в молекуле СН4(–4) – это низшая степень окисления углерода, которая соответствует числу электронов необходимых для завершения оболочки атома до восьмиэлектронной. Восьмиэлектронная внешняя оболочка у атомов является завершенной. Степень окисления атома углерода (–4) в СН4можно объяснить тем, что водород по сравнению с углеродом менее электроотрицателен. ОЭО водорода 2,1; ОЭО углерода 3. ΔОЭО=3-2,1=0,9, вследствие этого атом углерода оттягивает на себя общие электронные пары в молекуле СН4.
В молекуле метилового спирта графическая формула, которой такова:
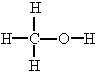 ,кислород как более
электроотрицательный атом оттягивает
электронную плотность на себя от атомов
углерода и водорода, а атом углерода в
свою очередь оттягивает электронную
плотность трех атомов водорода, и поэтому
атом углерода проявляет степень окисления
–2.
,кислород как более
электроотрицательный атом оттягивает
электронную плотность на себя от атомов
углерода и водорода, а атом углерода в
свою очередь оттягивает электронную
плотность трех атомов водорода, и поэтому
атом углерода проявляет степень окисления
–2.
В
молекуле метаналя СН2О
атом кислорода связан с атомом углерода
двойной химической связью 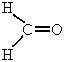 ,
по которой происходит оттягивание общих
электронных пар к кислороду как более
электроотрицательному элементу. В свою
очередь углерод оттягивает электронную
плотность от двух атомов водорода и
С.О. углерода становится равной нулю.
,
по которой происходит оттягивание общих
электронных пар к кислороду как более
электроотрицательному элементу. В свою
очередь углерод оттягивает электронную
плотность от двух атомов водорода и
С.О. углерода становится равной нулю.
В
молекуле муравьиной кислоты СНООН ![]() С.О. атома углерода равна +2. Атом кислорода
связан с атомом углерода двойной
химической связью, по которой происходит
оттягивание общих электронных пар к
кислороду, атом кислорода ОН‾ – группы
оттягивает электронные плотности от
атомов углерода и водорода, а атом
углерода в свою очередь оттягивает
электронную плотность от атома водорода,
связанного непосредственно с ним. Таким
образом, С.О. углерода становится равной
+2.
С.О. атома углерода равна +2. Атом кислорода
связан с атомом углерода двойной
химической связью, по которой происходит
оттягивание общих электронных пар к
кислороду, атом кислорода ОН‾ – группы
оттягивает электронные плотности от
атомов углерода и водорода, а атом
углерода в свою очередь оттягивает
электронную плотность от атома водорода,
связанного непосредственно с ним. Таким
образом, С.О. углерода становится равной
+2.
В
молекуле СО2
С.О. равна +4. Углерод связан с двумя
атомами кислорода двумя двойными
связями, вследствие бóльшей
электроотрицательности атом кислорода
оттягивает по две электронные пары от
атомов углерода![]() .
.
Учитывая положение атомов в периодической системе Д.И. Менделеева и сопоставляя значения их электроотрицательностей (приложение 2), можно количественно определить степень окисления атома в соединении. Например, в серусодержащих соединениях степень окисления серы имеет значения
![]() ,
объясняется аналогично примерам,
рассмотренным для органических
соединений.
,
объясняется аналогично примерам,
рассмотренным для органических
соединений.
Степени окисления закономерно изменяются при переходе от одного элемента к другому в периодической системе Д.И. Менделеева.
Атом в соединениях может иметь высшую, низшую и промежуточную степени окисления.
Высшая степень окисления – это наибольшее для данного элемента значение положительного окислительного числа. Высшая степень окисления, за редким исключением, отвечает номеру группы, к которой относится данный элемент. Так, у элемента Vгруппы, азота, высшая степень окисления равна пяти; у элементовVIIгруппы, хлора и марганца, высшая степень окисления равна семи, а у элементовVIIIгруппы, ксенона и осмия, – восьми и т.д.
Исключения составляют фтор, кислород, гелий, неон, аргон, а также железо и элементы подгрупп кобальта и никеля, высшая степень окисления которых ниже, чем номер группы, к которой они относятся. У элементов подгруппы меди, наоборот: высшая степень окисления равна трём, хотя они и относятся к Iгруппе.
В главных подгруппах при переходе от элементов сверху вниз обычно устойчивы низкие степени окисления, в побочных подгруппах – наоборот, более высокие.
Низшая степень окисления – это отрицательное значение окислительного числа С.О. для атома элемента и определяется числом электронов, которые атом элемента может присоединить на внешний энергетический уровень для его полного завершения (т.е. до восьми электронов). Для элементов главных подгрупп IV,V,VI,VIIгрупп периодической системы окислительные числа имеют отрицательные значения – соответственно –4, –3, –2, –1.
Степень (состояние) окисления элемента – понятие условное, однако оно весьма полезно. Значения степеней окисления элементов широко используются при составлении формул соединений, написании и подборе коэффициентов в уравнениях реакций, для классификации соединений, характеристики их химической природы и свойств, предсказания направления течения химических реакций и их продуктов.