- •Основные понятия
- •1.2. Степень окисления или окислительное число атома в соединениях
- •Восстановители, окислители. Процессы окисления и восстановления
- •1.3.1. Восстановители
- •1.3.2. Окислители
- •1.4. Классификация окислительно-восстановительных реакций (типы овр)
- •1.4.1. Реакции межатомного или межмолекулярного окисления-восстановления
- •1.4.2. Реакции внутримолекулярного окисления – восстановления
- •1.4.3. Реакции диспропорционирования (самоокисления – самовосстановления)
- •2. Составление уравнений реакций окисления – восстановления
- •2.1. Метод электронного баланса
- •2.2. Метод ионно-электронного баланса (метод полуреакций)
- •Овр, протекающие в кислой среде
- •2.2.2. Овр, протекающие в щелочной среде
- •2.2.3. Овр, протекающие в присутствии молекул воды в левой части схемы
- •3.Некоторые особые случаи уравнений
- •3.1. Одновременное окисление атомов, находящихся
- •3.2. Овр в присутствии перекиси водорода (h2o2) и её соединений
- •3.3. Проявление восстановительной и окислительной способности разных атомов одного и того же элемента, входящих в состав разных веществ или одного и того же вещества
- •3.4. Особенности протекания овр при термитной сварке
- •3.5. Овр в присутствии окислителя – озона (о3)
- •3.6. Овр с участием органических соединений
- •4. Эквиваленты окислителей и восстановителей
- •5. Количественная характеристика окислительно-восстановительных реакций и направление овр
- •5.1. Электродный потенциал и его возникновение
- •5.2. Общие понятия о работе гальванического элемента
- •5.3. Стандартный электродный потенциал
- •5.4. Окислительно-восстановительные потенциалы
- •5.4.1. Направление овр в зависимости от значения величины энергии Гиббса ∆g
- •5.4.2. Условия, влияющие на величину овп и направление овр
- •5.4.3. Влияние на направление овр растворимости продукта реакции восстановленной формы
- •5.4.4. Константы равновесия окислительно-восстановительных реакций
- •5.4.5. Примеры решения задач на определение направления окислительно-восстановительных реакций
- •5.4.6. Задачи для самостоятельного решения
- •6. Механизмы некоторых реакций
- •7. Тестовый промежуточной контроль по теме овр
- •Задание: Коэффициент перед восстановителем в реакции
- •Задание: Константа равновесия окислительно-восстановительной системы пристандартных условиях ; равна:
- •Задание: Направление окислительно-восстановительной реакции при указанных условиях будет:
- •Задание: Окислительно-восстановительная реакция
- •Ответы: 1) 0,56 в; 2) 1,21 в; 3) 0,7 в; 4) 0,8 в; 5) 0,82 в.
- •Задание: Константа равновесия окислительно-восстановительной реакции
- •Задание: Константа равновесия реакции
- •Для стандартных условий равна:
- •8. Лабораторные работы
- •8.1. Рекомендации для подготовки к лабораторным занятиям
- •8.2. Реакции межмолекулярного окисления-восстановления Опыт 1. Окислительные свойства дихромата калия
- •Опыт 2. Окислительные свойства перманганата калия (kMnO4) в разных средах
- •Опыт 4. Восстановительные свойства галогенидов
- •Опыт 5. Взаимодействие растворов солей железа (ш) и иодида калия
- •8.3. Реакции внутримолекулярного окисления-восстановления
- •Опыт 2. Термическое разложение перманганата калия (kMnO4)
- •Опыт 3. Термическое разложение нитрата меди (II) (Cu(no3)2·2h2o)
- •8.4. Реакции диспропорционирования (самоокисления, самовосстановления) Опыт 1. Взаимодействие йода со щелочами
- •Опыт 2. Термическое разложение сульфита натрия
- •8.5. Двойственное поведение пероксида водорода в овр Опыт 1. Восстановительные свойства пероксида водорода
- •Опыт 2. Окислительные свойства пероксида водорода
- •8.6. Зависимость направления овр от рН среды Опыт 1 Влияние рН раствора на направление овр
- •8.7. Реакции, в которых окислитель или восстановитель
- •Расходуются также на связывание получаемых продуктов
- •Опыт 1. Окисление хлорид-иона концентрированной соляной кислоты
- •Двуокисью свинца (PbO2)
- •8.8. Учебно-исследовательская работа
- •10. Вопросы для домашнего задания
5. Количественная характеристика окислительно-восстановительных реакций и направление овр
5.1. Электродный потенциал и его возникновение
Взаимное превращение электрической и химической форм энергии происходит в электрохимических системах, состоящих из следующих частей:
1) проводники второго рода – вещества, обладающие ионной проводимостью – электролиты; 2) проводники первого рода – вещества, обладающие электронной проводимостью, находящиеся в контакте с электролитами. На границе раздела двух фаз происходит перенос электрического заряда, т.е. протекает электрохимическая реакция. Электродами называют проводники, имеющие электронную проводимость (проводники первого рода) и находящиеся в контакте с ионным проводником. При переходе заряженных частиц (ионы, электроны) через границу раздела фаз, например раствор электролита – металл, возникает электрохимическая реакция. В результате этого металл и раствор приобретают электрический заряд, и на границе их раздела создается двойной электрический слой (ДЭС), а разность потенциалов между положительными и отрицательными поверхностями вызывает скачок потенциала.
Можно выделить 4 основные причины возникновения скачка потенциала в электрохимических системах:
1. При контакте двух металлов М1 и М2 наблюдается переход электронов из одного металла в другой до тех пор, пока не станут равными электрохимические потенциалы электронов в этих металлах и установится электрохимическое равновесие ē(М1) ↔ ē(М2). В результате электронных переходов на границе двух металлов возникает скачок потенциала. Движущей силой электронных переходов является различие в работах выхода электронов из металлов М1 и М2.
Если опустить металлический стержень или пластинку в раствор электролита, содержащий ионы этого металла, также установится электрохимическое равновесие. При этом катионы металла переходят в раствор (металл растворяется) и, наоборот, из раствора катионы осаждаются на металлической поверхности. Условием равновесия является равенство электрохимических потенциалов катионов Мn+ в растворе и в металле. Рассматриваемое равновесие является фактически результатом электрохимической реакции
М + S ↔ [MS]n+ + nē
Важно, что образующиеся электроны остаются на поверхности металла, а в растворе будут накапливаться катионы, сольватированные молекулами растворителя S. За счет электростатического притяжения вдоль заряженной отрицательно поверхности металла в растворе будут ориентироваться положительные катионы. Таким образом, на границе металл – раствор электролита возникает двойной электрический слой, характеризующийся некоторым скачком потенциала.
В обоих рассмотренных случаях на границе двух разных фаз возникает скачок потенциала, который называется гальвани-потенциалом, включающим и химическую, и электрохимическую работу. Если разность потенциалов возникает в разных точках внутри одной фазы, то такой скачок потенциала называется вольта-потенциалом (учитывает только электрическую работу).
2. На границе электрод – раствор электролита двойной электрический слой и скачок потенциала может возникнуть также за счет избирательной адсорбции ионов одного знака на поверхности электрода. Например, на незаряженной поверхности ртутного электрода, контактирующего с раствором KCl, адсорбируются иодид-ионы, а катионы К+ выстраиваются вдоль адсорбированных анионов, образуя двойной электрический слой. Подобная адсорбция возможна также на неметаллической поверхности и на коллоидных частицах.
3. Полярные молекулы представляют собой диполи, в которых за счет смещения электронной плотности вдоль химической связи возникают частичные положительный и отрицательный заряды. Избирательная абсорбция подобных молекул из раствора на твердую поверхность происходит таким образом, что молекулы располагаются перпендикулярно к поверхности. В результате вновь образуется ДЭС и возникает скачок потенциала.
4. В гальваническом элементе и электролизере скачок потенциала на границе электрод – раствор электролита изменяется при прохождении через них электрического тока за счет поляризации электродов.
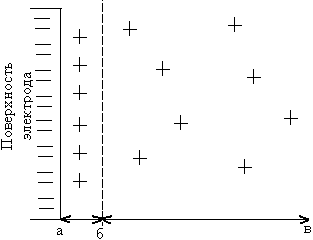
Обе фазы, как видно выше, построены из самостоятельно существующих заряженных частиц, и при переходе из фазы в фазу в неэквивалентных количествах в поверхностном слое каждой фазы возникают электрические заряды, равные по значению, но противоположные по знаку. Вследствие этого образуется двойной электрический слой, разность зарядов между обкладками которого обусловливает скачок потенциала (электродный потенциал) (рис. 1).
Рассмотрим, как возникает скачок потенциала на границе раздела фаз активного металла цинка, опущенного в раствор своей соли (ZnSO4). Полярные молекулы воды раствора электролита ориентируются отрицательными полюсами к поверхности металла. Ионы цинка взаимодействуют с полярными молекулами воды, образуя гидратированный ион [Zn(H2O)4]2+, и переходят в раствор.
Вследствие этого поверхность металла заряжается отрицательно, поскольку на ней накаливаются избыточные электроны, а слой раствора, примыкающий к ней положительно, образуя адсорбционный и диффузионный слои l1 и l2 (рис.1).
По истечении времени увеличивается концентрация катионов в растворе у поверхности металла и вероятность выхода катионов из металла уменьшается, а вероятность обратного входа их в металл (адсорбция) из раствора увеличивается.
Наконец скорости этих процессов выравниваются и устанавливается динамическое равновесие на границе металл-раствор электролита. Между обкладками двойного электрического слоя также устанавливается динамическое равновесие:
![]()
где n-число атомов цинка в металле; х-число гидратированных ионов цинка, вышедших из металла во внешнюю обкладку двойного электрического слоя (в раствор); ē – электрон.
Динамическое равновесие записывается в упрощенном виде:
|
| |
|
|
Гидратированный ион |
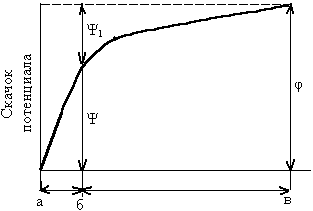
Увеличение концентрации ионов металла в растворе смещает равновесие влево и повышает потенциал металла (рис. 1).
|
|
|
|
А |
Б |
|
Рис. 1. Строение двойного электрического слоя на границе раствор – активный металл (А) и распределение потенциала в ионной обкладке раствора (Б): аб – плотная часть; бв – диффузная часть; φ – разность потенциалов между растворами и металлом; Ψ и Ψ1 – падение потенциала в плотной и диффузной частях ДЭС | |
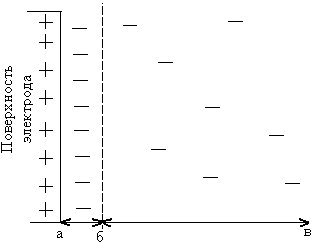
Способность посылать в раствор у различных металлов выражена неодинаково и при одинаковых условиях зависит от энергии сублимации металла, энергии ионизации его атомов, энергии гидратации ионов. Пассивные металлы (Cu, Ag) не посылают в раствор ионов. Для медного электрода, погруженного в раствор своей соли (CuSO4), преобладает адсорбция ионов металла на поверхности металла.
Схематично процесс изображают следующим образом:
[nCu]+xCu2+ּH2O+ xSO42- · H2O↔[nCu]xCu2++ xSO4 2- · H2O,
где n – число атомов меди в металле; х-число адсорбирующихся ионов меди и число сульфатных ионов, оставшихся в эквивалентном количестве во внешней обкладке двойного слоя
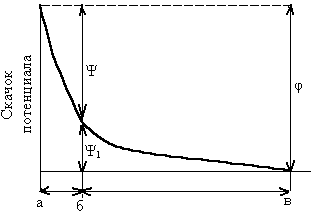
В этом случае поверхность металла заряжается положительно, прилегающий к ней раствор – отрицательно за счет избытка в нем анионов SO42- (рис. 2).
|
|
|
|
А |
Б |
|
Рис. 2. Строение двойного электрического слоя на границе раствор – пассивный металл (А) и распределение потенциала в ионной обкладке раствора (Б): аб – плотная часть; бв – диффузная часть; φ – разность потенциалов между растворами и металлом; Ψ и Ψ1 – падение потенциала в плотной и диффузной частях ДЭС | |