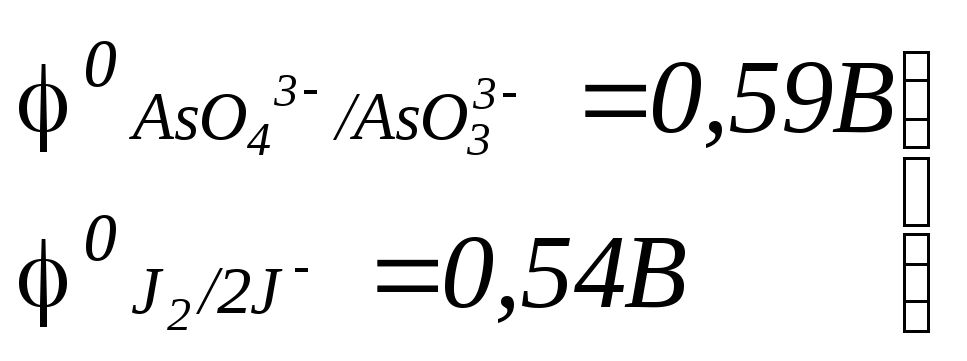- •Основные понятия
- •1.2. Степень окисления или окислительное число атома в соединениях
- •Восстановители, окислители. Процессы окисления и восстановления
- •1.3.1. Восстановители
- •1.3.2. Окислители
- •1.4. Классификация окислительно-восстановительных реакций (типы овр)
- •1.4.1. Реакции межатомного или межмолекулярного окисления-восстановления
- •1.4.2. Реакции внутримолекулярного окисления – восстановления
- •1.4.3. Реакции диспропорционирования (самоокисления – самовосстановления)
- •2. Составление уравнений реакций окисления – восстановления
- •2.1. Метод электронного баланса
- •2.2. Метод ионно-электронного баланса (метод полуреакций)
- •Овр, протекающие в кислой среде
- •2.2.2. Овр, протекающие в щелочной среде
- •2.2.3. Овр, протекающие в присутствии молекул воды в левой части схемы
- •3.Некоторые особые случаи уравнений
- •3.1. Одновременное окисление атомов, находящихся
- •3.2. Овр в присутствии перекиси водорода (h2o2) и её соединений
- •3.3. Проявление восстановительной и окислительной способности разных атомов одного и того же элемента, входящих в состав разных веществ или одного и того же вещества
- •3.4. Особенности протекания овр при термитной сварке
- •3.5. Овр в присутствии окислителя – озона (о3)
- •3.6. Овр с участием органических соединений
- •4. Эквиваленты окислителей и восстановителей
- •5. Количественная характеристика окислительно-восстановительных реакций и направление овр
- •5.1. Электродный потенциал и его возникновение
- •5.2. Общие понятия о работе гальванического элемента
- •5.3. Стандартный электродный потенциал
- •5.4. Окислительно-восстановительные потенциалы
- •5.4.1. Направление овр в зависимости от значения величины энергии Гиббса ∆g
- •5.4.2. Условия, влияющие на величину овп и направление овр
- •5.4.3. Влияние на направление овр растворимости продукта реакции восстановленной формы
- •5.4.4. Константы равновесия окислительно-восстановительных реакций
- •5.4.5. Примеры решения задач на определение направления окислительно-восстановительных реакций
- •5.4.6. Задачи для самостоятельного решения
- •6. Механизмы некоторых реакций
- •7. Тестовый промежуточной контроль по теме овр
- •Задание: Коэффициент перед восстановителем в реакции
- •Задание: Константа равновесия окислительно-восстановительной системы пристандартных условиях ; равна:
- •Задание: Направление окислительно-восстановительной реакции при указанных условиях будет:
- •Задание: Окислительно-восстановительная реакция
- •Ответы: 1) 0,56 в; 2) 1,21 в; 3) 0,7 в; 4) 0,8 в; 5) 0,82 в.
- •Задание: Константа равновесия окислительно-восстановительной реакции
- •Задание: Константа равновесия реакции
- •Для стандартных условий равна:
- •8. Лабораторные работы
- •8.1. Рекомендации для подготовки к лабораторным занятиям
- •8.2. Реакции межмолекулярного окисления-восстановления Опыт 1. Окислительные свойства дихромата калия
- •Опыт 2. Окислительные свойства перманганата калия (kMnO4) в разных средах
- •Опыт 4. Восстановительные свойства галогенидов
- •Опыт 5. Взаимодействие растворов солей железа (ш) и иодида калия
- •8.3. Реакции внутримолекулярного окисления-восстановления
- •Опыт 2. Термическое разложение перманганата калия (kMnO4)
- •Опыт 3. Термическое разложение нитрата меди (II) (Cu(no3)2·2h2o)
- •8.4. Реакции диспропорционирования (самоокисления, самовосстановления) Опыт 1. Взаимодействие йода со щелочами
- •Опыт 2. Термическое разложение сульфита натрия
- •8.5. Двойственное поведение пероксида водорода в овр Опыт 1. Восстановительные свойства пероксида водорода
- •Опыт 2. Окислительные свойства пероксида водорода
- •8.6. Зависимость направления овр от рН среды Опыт 1 Влияние рН раствора на направление овр
- •8.7. Реакции, в которых окислитель или восстановитель
- •Расходуются также на связывание получаемых продуктов
- •Опыт 1. Окисление хлорид-иона концентрированной соляной кислоты
- •Двуокисью свинца (PbO2)
- •8.8. Учебно-исследовательская работа
- •10. Вопросы для домашнего задания
5.4.1. Направление овр в зависимости от значения величины энергии Гиббса ∆g
В электрохимических системах происходит взаимное превращение свободной энергии химических реакций и электрической энергии. Для термодинамически обратимой химической реакции протекающей в электрохимической цепи при постоянном давлении и температуре, уменьшение энергии Гиббса равно максимально полезной работе. Так, если ∆Gреакции<0, реакция возможна, если ∆G > 0, прямое направление реакции невозможно, но возможна обратная реакция. Величина ∆G ОВР, протекающей в водном растворе, может быть рассчитана на основании следующего уравнения:
![]() ;
;![]() ;
(5.8)
;
(5.8)
или для стандартных условий:
![]() ,
,
![]()
где n – число электронов ОВР;
F – число Фарадея;
![]() -
окислительно-восстановительный потенциал
системы, проявляющий в данной реакции
окислительные свойства;
-
окислительно-восстановительный потенциал
системы, проявляющий в данной реакции
окислительные свойства;
![]() -
окислительно-восстановительный потенциал
системы, проявляющий в данной реакции
восстановительные свойства.
-
окислительно-восстановительный потенциал
системы, проявляющий в данной реакции
восстановительные свойства.
Если
![]() и ∆G
< 0, то реакция в заданном направлении
возможна. В случае
и ∆G
< 0, то реакция в заданном направлении
возможна. В случае
![]() ,
∆G
будет больше нуля, т.е. заданное направление
реакции будет невозможным.
,
∆G
будет больше нуля, т.е. заданное направление
реакции будет невозможным.
В решении вопроса о практической целесообразности данной реакции весьма важен не только фактор принципиальной возможности данной реакции, но и другой фактор – скорость ее. Скорость реакции может оказаться настолько малой, что она практически становится неприемлемой, несмотря на то, что термодинамически она возможна.
5.4.2. Условия, влияющие на величину овп и направление овр
Изменение стандартных условий может привести к существенному изменению значений окислительно-восстановительных потенциалов, что может определить и иное направление ОВР.
Например, реакция
![]() (5.9)
(5.9)
может самопроизвольно идти как слева направо, так и справа налево. Направление ее протекания определяется концентрациями ионов железа и ртути. В этой реакции участвуют две электрохимические системы:
-
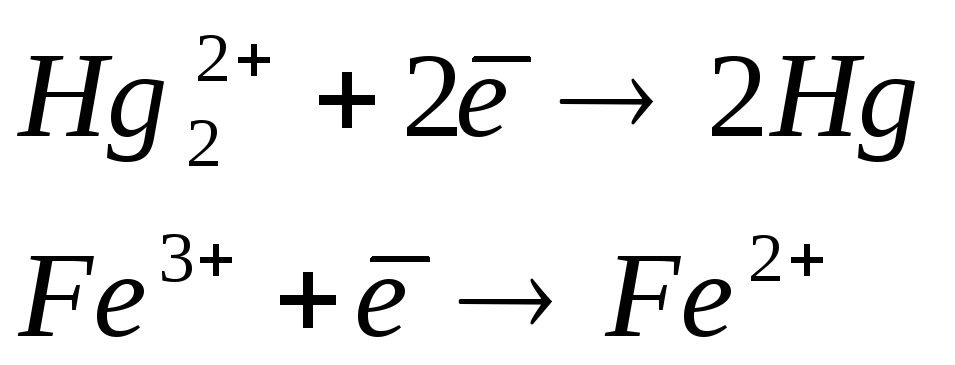
1
2

Различия в значениях φ0 систем незначительно
Этим процессам отвечают потенциалы:

При значениях концентраций
![]()
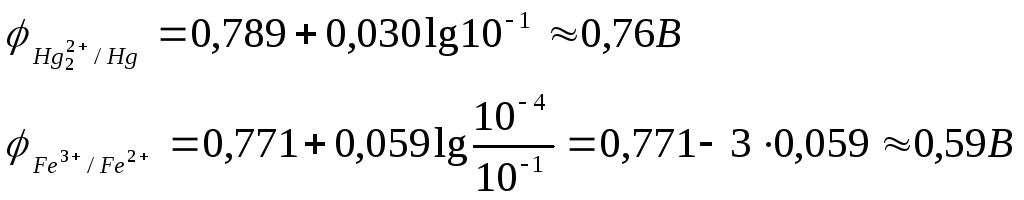
В
этих условиях рассматриваемая реакция
будет протекать слева направо потому,
что ![]() >
>![]() ,
и Hg22+
будет проявлять роль более сильного
окислителя, а Fe2+
- более сильного восстановителя.
,
и Hg22+
будет проявлять роль более сильного
окислителя, а Fe2+
- более сильного восстановителя.
Если
же
![]() ,
то
,
то

Следовательно,
при этих концентрациях реакция может
протекать справа налево, так как
![]() и
и![]() - более сильный окислитель, аHg0
– более сильный восстановитель.
- более сильный окислитель, аHg0
– более сильный восстановитель.
Если окислительно-восстановительная реакция протекает с участием ионов водорода или гидроксид-ионов, то величина pH раствора также может повлиять на изменение направления протекания реакции.
Например:
![]() (5.10)
(5.10)
|
|
1 1 |
|
Различия φ0 незначительны |
![]()
Как видно из этих схем, окислительно-восстановительный потенциал первой электрохимической системы зависит от pH (от H+):
![]()
Чем
меньше pH
(чем больше [H+]),
тем положительнее величина
![]() ,
тем сильнее в данных условиях проявляют
ионы
,
тем сильнее в данных условиях проявляют
ионы![]() окислительные свойства. Если изменять
кислотность среды, увеличивpH
(уменьшив [H+]
), направление реакции изменится:
например, если реакцию (5.10) проводить в
присутствии избытка NaHCO3,
который поддерживает рН раствора равным
8,
а концентрацию ионов Н+
уменьшить до 10-8
г-ион/л, тогда уменьшение концентрации
катионов водорода на потенциале пары
J2/2J-
не отразится. А для пары
окислительные свойства. Если изменять
кислотность среды, увеличивpH
(уменьшив [H+]
), направление реакции изменится:
например, если реакцию (5.10) проводить в
присутствии избытка NaHCO3,
который поддерживает рН раствора равным
8,
а концентрацию ионов Н+
уменьшить до 10-8
г-ион/л, тогда уменьшение концентрации
катионов водорода на потенциале пары
J2/2J-
не отразится. А для пары
![]() ,
где превращение окисленной формы в
восстановленную происходит при участии
катионов водорода, – очень сильно
отразится и ОВП понизится до величины
0,108В.
,
где превращение окисленной формы в
восстановленную происходит при участии
катионов водорода, – очень сильно
отразится и ОВП понизится до величины
0,108В.

![]()
![]() т.к.
величина 0,108 В меньше
т.к.
величина 0,108 В меньше
![]() ,
то в этих условиях элементарный йод
будет окислять ионы
,
то в этих условиях элементарный йод
будет окислять ионы![]() в
в![]() и реакция протекает так:
и реакция протекает так:
![]() (5.11)
(5.11)
Связывание ионов Н+, происходящее при прибавлении NaHCO3; H++HCO3¯ = H2O+CO2↑, способствует протеканию реакции (5.11).