
- •Основные понятия
- •1.2. Степень окисления или окислительное число атома в соединениях
- •Восстановители, окислители. Процессы окисления и восстановления
- •1.3.1. Восстановители
- •1.3.2. Окислители
- •1.4. Классификация окислительно-восстановительных реакций (типы овр)
- •1.4.1. Реакции межатомного или межмолекулярного окисления-восстановления
- •1.4.2. Реакции внутримолекулярного окисления – восстановления
- •1.4.3. Реакции диспропорционирования (самоокисления – самовосстановления)
- •2. Составление уравнений реакций окисления – восстановления
- •2.1. Метод электронного баланса
- •2.2. Метод ионно-электронного баланса (метод полуреакций)
- •Овр, протекающие в кислой среде
- •2.2.2. Овр, протекающие в щелочной среде
- •2.2.3. Овр, протекающие в присутствии молекул воды в левой части схемы
- •3.Некоторые особые случаи уравнений
- •3.1. Одновременное окисление атомов, находящихся
- •3.2. Овр в присутствии перекиси водорода (h2o2) и её соединений
- •3.3. Проявление восстановительной и окислительной способности разных атомов одного и того же элемента, входящих в состав разных веществ или одного и того же вещества
- •3.4. Особенности протекания овр при термитной сварке
- •3.5. Овр в присутствии окислителя – озона (о3)
- •3.6. Овр с участием органических соединений
- •4. Эквиваленты окислителей и восстановителей
- •5. Количественная характеристика окислительно-восстановительных реакций и направление овр
- •5.1. Электродный потенциал и его возникновение
- •5.2. Общие понятия о работе гальванического элемента
- •5.3. Стандартный электродный потенциал
- •5.4. Окислительно-восстановительные потенциалы
- •5.4.1. Направление овр в зависимости от значения величины энергии Гиббса ∆g
- •5.4.2. Условия, влияющие на величину овп и направление овр
- •5.4.3. Влияние на направление овр растворимости продукта реакции восстановленной формы
- •5.4.4. Константы равновесия окислительно-восстановительных реакций
- •5.4.5. Примеры решения задач на определение направления окислительно-восстановительных реакций
- •5.4.6. Задачи для самостоятельного решения
- •6. Механизмы некоторых реакций
- •7. Тестовый промежуточной контроль по теме овр
- •Задание: Коэффициент перед восстановителем в реакции
- •Задание: Константа равновесия окислительно-восстановительной системы пристандартных условиях ; равна:
- •Задание: Направление окислительно-восстановительной реакции при указанных условиях будет:
- •Задание: Окислительно-восстановительная реакция
- •Ответы: 1) 0,56 в; 2) 1,21 в; 3) 0,7 в; 4) 0,8 в; 5) 0,82 в.
- •Задание: Константа равновесия окислительно-восстановительной реакции
- •Задание: Константа равновесия реакции
- •Для стандартных условий равна:
- •8. Лабораторные работы
- •8.1. Рекомендации для подготовки к лабораторным занятиям
- •8.2. Реакции межмолекулярного окисления-восстановления Опыт 1. Окислительные свойства дихромата калия
- •Опыт 2. Окислительные свойства перманганата калия (kMnO4) в разных средах
- •Опыт 4. Восстановительные свойства галогенидов
- •Опыт 5. Взаимодействие растворов солей железа (ш) и иодида калия
- •8.3. Реакции внутримолекулярного окисления-восстановления
- •Опыт 2. Термическое разложение перманганата калия (kMnO4)
- •Опыт 3. Термическое разложение нитрата меди (II) (Cu(no3)2·2h2o)
- •8.4. Реакции диспропорционирования (самоокисления, самовосстановления) Опыт 1. Взаимодействие йода со щелочами
- •Опыт 2. Термическое разложение сульфита натрия
- •8.5. Двойственное поведение пероксида водорода в овр Опыт 1. Восстановительные свойства пероксида водорода
- •Опыт 2. Окислительные свойства пероксида водорода
- •8.6. Зависимость направления овр от рН среды Опыт 1 Влияние рН раствора на направление овр
- •8.7. Реакции, в которых окислитель или восстановитель
- •Расходуются также на связывание получаемых продуктов
- •Опыт 1. Окисление хлорид-иона концентрированной соляной кислоты
- •Двуокисью свинца (PbO2)
- •8.8. Учебно-исследовательская работа
- •10. Вопросы для домашнего задания
1.3.2. Окислители
Окислители – это частицы (атомы, ионы, молекулы), принимающие в результате реакции электроны. Процесс принятия электронов называют восстановлением. При восстановлении величина О.Ч. или степени окисления уменьшается. Окислителями могут быть нейтральные атомы и молекулы; положительно заряженные ионы металлов в высшей степени окисления; сложные ионы и молекулы, содержащие атомы металла в состоянии высокой степени окисления; сложные ионы и молекулы, содержащие атомы неметалла в состоянии положительной степени окисления; катионы водорода (Н+).
– Нейтральные атомы, имеющие на последнем энергетическом уровне от 4 до 7 электронов(ns2np2–ns2np5)
…3s23p2– …3s23p5,
SiCl
– это неметаллы, характеризующиеся большим сродством к электрону или большой электроотрицательностью.
7N 1s22s22p3 + 3ē → 1s22s22p6 → N3–
17Cl 1s22s22p63s23p5 + ē → 1s22s22p63s23p6 → Cl¯
Самые сильные окислители – атомы галогенов и кислорода, самые слабые окислители – атомы главной подгруппы четвертой группы (C,Si,Ge,Sn,Pb).
– Положительно заряженные ионы атомов металлов с высокой степенью окисления:Sn4+, Fe6+, Ge4+, Cu2+, Cr6+, Mn7+
![]()
|
окислитель |
Cu2+ + ē =Cu+ |
процесс восстановления |
|
восстановитель |
2I¯ – 2ē = I2 |
процесс окисления |
– Сложные ионы и молекулы, содержащие атомы металла в состоянии высшей степени окисления:
(![]()
![]()
![]() [
[![]() ]
]![]() ,
,![]() и
др.
и
др.
2MnSO4 + 5PbO2 + 6HNO3 = 2HMnO4 + 3Pb(NO3)2 + 2PbSO4 + 2H2O
|
окислитель |
PbO2 + 4H+ + 2ē=Pb2+ + 2H2O |
5процесс восстановления |
|
восстановитель |
Mn2+ + 4H2O – 5ē = MnO4¯ + 8H+ |
2процесс окисления |
K2Cr2O7 + 4H2SO4 + 3NaNO2 → Cr2(SO4)3 + 3NaNO3 + K2SO4
|
окислитель |
Cr2O72– + 14H+ + 6ē = 2Cr3+ + 7H2O |
1 процесс восстановления |
|
восстановитель |
NO2¯ + H2O – 2ē = NO3¯ + 2H+ |
3 процесс окисления |
– Сложные ионы и молекулы, содержащие атомы неметалла в состоянии положительной степени окисления.
![]()
![]()
![]()
![]()
![]()
Сильными
окислителями являются концентрированные
кислоты: азотная – HNO3,
серная -
![]() ,
селеновая -
,
селеновая -![]() ,
теллуровая -
,
теллуровая -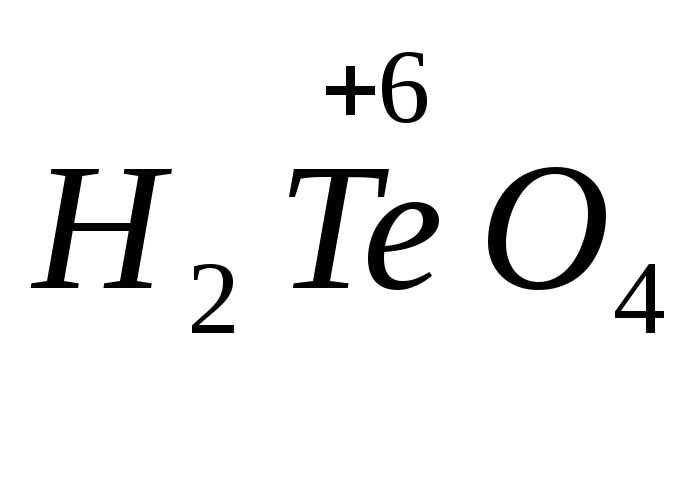
HClO3 + 3H2SO3 = HCl + 3H2SO4
|
окислитель |
ClO3– + 6H+ + 6ē = Cl– + 3H2O |
1 процесс восстановления |
|
восстановитель |
SO32– + H2O – 2ē = SO42– + 2H+ |
3 процесс окисления |
2HI–1
+
![]() = I2º
+
= I2º
+
![]() + H2O
+ H2O
|
окислитель |
SeO42– + 2H+ + 2ē = SeO32– + H2O |
восстановление |
|
восстановитель |
2I¯ – 2ē = I2 |
окисление |
2Asº
+
3![]() =3SO2
+
=3SO2
+
![]()
|
окислитель |
2Asº + 3H2O – ē = AlO33– + 6H+ |
процесс восстановления |
|
восстановитель |
SO42– + 4H+ + 2ē = SO2 + 2H2O |
процесс окисления |
В табл. 1 приведены применяемые в практике восстановители и окислители.
Таблица 1
Применяемые в практике восстановители и окислители
|
Восстановители |
Окислители |
|
а) металлы как простые вещества: Kº,Naº,Caº,Alº и др.; б) простые анионы неметаллов: S2–,Cl¯,I¯,Br¯,Se2–и др.; в) сложные анионы и молекулы, содержащие электроположительные элементы в промежуточной степени окисления: S+4O32–,N+3O2–,As+3O3–3,Cr+3O2–, [Fe+2(CN)6]4–,C+2O,N+2O,S+4O2и др.; г) простые катионы в низшей степе- ни окисления: Fe2+,Sn2+,Cr3+,Cu+,Mn2+,As3+и др.; д) некоторые неметаллы: C,H2,S,N2и др.; е) катод при электролизе. |
а) неметаллы как простые вещества с большой электроотрицательностью: F2,O2,Cl2и др.; б) простые катионы в высокой степени окисления: Sn4+,Fe3+,Cu2+и др., а такжеH+;
в) сложные ионы
и молекулы, содержащие атомы металла
в высшей степени окисления:
г)
сложные ионы и молекулы, содержащие
атомы неметаллов в положительной
степени окисления:
д) анод при электролизе. |
Растворы кислот – более сильные окислители, чем растворы их солей, при этом окислительная активность первых тем значительнее, чем выше их концетрация. Так, KN+5O3 в водном растворе почти не проявляет окислительных свойств (необходим очень сильный восстановитель), разбавленная HN+5O3 является слабым окислителем, а концентрированная – один из наиболее энергичных окислителей.
