- •Основные понятия
- •1.2. Степень окисления или окислительное число атома в соединениях
- •Восстановители, окислители. Процессы окисления и восстановления
- •1.3.1. Восстановители
- •1.3.2. Окислители
- •1.4. Классификация окислительно-восстановительных реакций (типы овр)
- •1.4.1. Реакции межатомного или межмолекулярного окисления-восстановления
- •1.4.2. Реакции внутримолекулярного окисления – восстановления
- •1.4.3. Реакции диспропорционирования (самоокисления – самовосстановления)
- •2. Составление уравнений реакций окисления – восстановления
- •2.1. Метод электронного баланса
- •2.2. Метод ионно-электронного баланса (метод полуреакций)
- •Овр, протекающие в кислой среде
- •2.2.2. Овр, протекающие в щелочной среде
- •2.2.3. Овр, протекающие в присутствии молекул воды в левой части схемы
- •3.Некоторые особые случаи уравнений
- •3.1. Одновременное окисление атомов, находящихся
- •3.2. Овр в присутствии перекиси водорода (h2o2) и её соединений
- •3.3. Проявление восстановительной и окислительной способности разных атомов одного и того же элемента, входящих в состав разных веществ или одного и того же вещества
- •3.4. Особенности протекания овр при термитной сварке
- •3.5. Овр в присутствии окислителя – озона (о3)
- •3.6. Овр с участием органических соединений
- •4. Эквиваленты окислителей и восстановителей
- •5. Количественная характеристика окислительно-восстановительных реакций и направление овр
- •5.1. Электродный потенциал и его возникновение
- •5.2. Общие понятия о работе гальванического элемента
- •5.3. Стандартный электродный потенциал
- •5.4. Окислительно-восстановительные потенциалы
- •5.4.1. Направление овр в зависимости от значения величины энергии Гиббса ∆g
- •5.4.2. Условия, влияющие на величину овп и направление овр
- •5.4.3. Влияние на направление овр растворимости продукта реакции восстановленной формы
- •5.4.4. Константы равновесия окислительно-восстановительных реакций
- •5.4.5. Примеры решения задач на определение направления окислительно-восстановительных реакций
- •5.4.6. Задачи для самостоятельного решения
- •6. Механизмы некоторых реакций
- •7. Тестовый промежуточной контроль по теме овр
- •Задание: Коэффициент перед восстановителем в реакции
- •Задание: Константа равновесия окислительно-восстановительной системы пристандартных условиях ; равна:
- •Задание: Направление окислительно-восстановительной реакции при указанных условиях будет:
- •Задание: Окислительно-восстановительная реакция
- •Ответы: 1) 0,56 в; 2) 1,21 в; 3) 0,7 в; 4) 0,8 в; 5) 0,82 в.
- •Задание: Константа равновесия окислительно-восстановительной реакции
- •Задание: Константа равновесия реакции
- •Для стандартных условий равна:
- •8. Лабораторные работы
- •8.1. Рекомендации для подготовки к лабораторным занятиям
- •8.2. Реакции межмолекулярного окисления-восстановления Опыт 1. Окислительные свойства дихромата калия
- •Опыт 2. Окислительные свойства перманганата калия (kMnO4) в разных средах
- •Опыт 4. Восстановительные свойства галогенидов
- •Опыт 5. Взаимодействие растворов солей железа (ш) и иодида калия
- •8.3. Реакции внутримолекулярного окисления-восстановления
- •Опыт 2. Термическое разложение перманганата калия (kMnO4)
- •Опыт 3. Термическое разложение нитрата меди (II) (Cu(no3)2·2h2o)
- •8.4. Реакции диспропорционирования (самоокисления, самовосстановления) Опыт 1. Взаимодействие йода со щелочами
- •Опыт 2. Термическое разложение сульфита натрия
- •8.5. Двойственное поведение пероксида водорода в овр Опыт 1. Восстановительные свойства пероксида водорода
- •Опыт 2. Окислительные свойства пероксида водорода
- •8.6. Зависимость направления овр от рН среды Опыт 1 Влияние рН раствора на направление овр
- •8.7. Реакции, в которых окислитель или восстановитель
- •Расходуются также на связывание получаемых продуктов
- •Опыт 1. Окисление хлорид-иона концентрированной соляной кислоты
- •Двуокисью свинца (PbO2)
- •8.8. Учебно-исследовательская работа
- •10. Вопросы для домашнего задания
5.3. Стандартный электродный потенциал
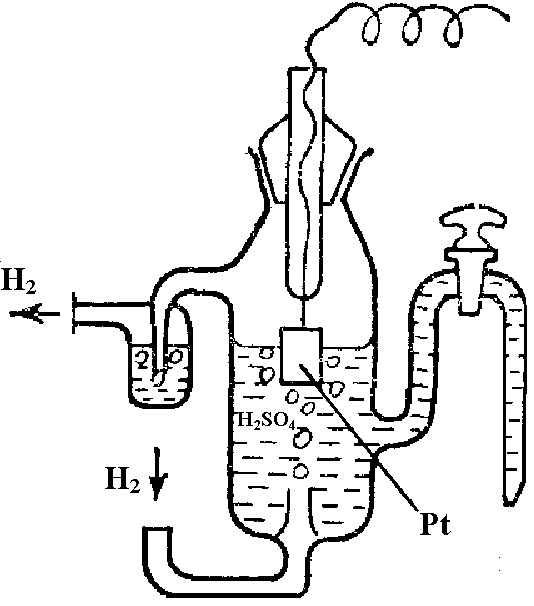
Скачок потенциала на границе металл – раствор, как и разности потенциалов между двумя точками, находящимися в различных фазах, экспериментально измерить невозможно. Поскольку экспериментально можно измерить лишь величину ЭДС электрохимической цепи, то опытным путем можно определить только относительные величины так называемых электродных потенциалов, т.е. ЭДС цепи, составленной из данного электрода и некоторого стандартного электрода, потенциал которого условно принимают равным нулю. Таким стандартным электродам, или электродом сравнения, является обратимый водородный электрод – стеклянный сосуд, наполненный раствором сильной кислоты (HCl или H2SO4) с концентрацией ионов водорода [Н+] = 1 моль/л, в который частично погружена платиновая пластинка, покрытая платиновой чернью (нанесенная на его поверхность порошкообразная платина), способная адсорбировать подаваемый газообразный водород при давлении 1 атм (рис. 4).
|
|
|
Рис. 4. Стандартный водородный электрод |
Этому электроду отвечает обратимый процесс, который можно записать в виде
2Н+
+2ē ↔ Н2,
![]()
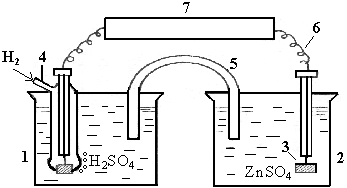
Соединив с водородным электродом в гальванический элемент другой полуэлемент, можно определить ЭДС этого гальваноэлемента, а по ней – относительный стандартный электродный потенциал данной гальванопары. Например, в гальваноэлементе Zn0/Zn2+//2H+/H2ЭДС, определяемая вольтметром равна 0,76B (см. рис. 5).
|
|
|
Рис. 5. Схема прибора для определения стандартного потенциала пары Zn/Zn2+: 1, 2 – стаканы с электролитами; 3 – цинковая пластина; 4-стандартный водородный электрод; 5- внутренняя цепь; 6-внешняя цепь; 7-потенциометр |
Знак «+» электродного потенциала отвечает движению ионов от раствора к электроду в элементе, где рассматриваемый электрод соединен с водородным электродом, и движению электронов по внешней цепи от водородного электрода. Знак «–» ставится перед значением электродного потенциала при движении ионов и электронов в обратном направлении.
Поскольку в нашем примере опытным путем установлено повышение концентрации ионов Zn2+ и уменьшение концентрации ионов H+, то значения электродного потенциала цинкового электрода следует приводить со знаком «–».
Относительно стандартного водородного электрода можно определить потенциалы не только пар Ме/Меn+, но и пар, составленных из любого восстановителя и его окисленной формы и любого окислителя и его восстановленной формы.
5.4. Окислительно-восстановительные потенциалы
Рассмотрим такие электроды, реакции на которых не связаны с выделением из электролита или растворением в нем простых веществ, но связаны с изменением валентности ионов в растворе. Химическую реакцию, сопровождающуюся переходом электронов между молекулами двух участвующих в реакции веществ, можно записать в следующем виде:
Например: Окисл.1+ n1ē↔Восстан-ль1– восстановленная форма;
Восстан-ль2 - n2ē ↔ Окисл.2 – окисленная форма.
Поэтому следует говорить не об отдельном окислителе и восстановителе, а об окислительно-восстановительных системах, компонентами в которых являются окисленная и восстановленная формы одного и того же соединения.
Величину окислительно-восстановительного потенциала (ОВП) надо указывать для пары: окисленной и восстановленной форм. Его обозначают φ, В (Вольт) – φокисл.форма/восст.форма. Числителем индекса указывают окисленную форму, а знаменателем – восстановленную форму.
Так например, обычно записывают
![]() ;
;![]() ;
;![]()
ОВП – величина, характеризующая окислительно-восстановительную способность веществ.
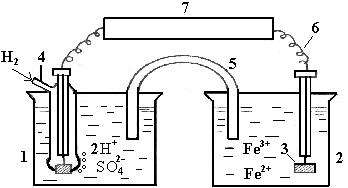
При экспериментальном определении относительных значений ОВП различных пар следует учитывать, что величина их зависит не только от силы входящих в состав данной пары окислителя и восстановителя, но и от отношения их концентраций (активностей). Для получения сравнимых результатов необходимо сделать их концентрации одинаковыми, например, равными 1 моль/л или 1 г-ион/л, и разные окислительно-восстановительные пары комбинировать с одной и той же стандартной парой (стандартным водородным электродом, представляющим собой пару 2H+/H2при концентрации H+, равной 1 г-ион/л) (см. рис. 4 и 6).
|
|
|
Рис. 6. Схема прибора для определения стандартного потенциала пары Fe3+/Fe2+: 1, 2 – стаканы с электролитами; 3 – платиновый проводник; 4-стандартный водородный электрод; 5 – внутренняя цепь; 6-внешняя цепь; 7-потенциометр
|
Всякий окислитель, присоединяя электроны, переходит при этом в свою восстановительную форму, а восстановитель, отдавая электроны, переходит в окисленную форму. Например:
Fe3+ + ē = Fe2+ - восстановленная форма;
2H+ + 2ē = H2 - окисленная форма.
Отрицательным полюсом такого элемента является стандартный водородный электрод, положительным полюсом является платиновый электрод.
На первом происходит процесс отдачи электронов молекулами водорода платине, т.е. реакция окисления их до катионов водорода:
H2 – 2ē ↔ 2H+
Освобождающиеся при этом электроны протекают по проводнику к платиновому электроду, где их присоединяют ионы Fe3+, восстанавливающиеся до Fe2+:
2Fe3+ + 2ē ↔ 2Fe2+
Сложив почленно оба написанных уравнения, получим общее уравнение реакции, происходящей при работе данного элемента:
2Fe3+ +Н 2 ↔ 2Fe2+ + 2Н+
ЭДС этого элемента оказывается равным 0,77В, т.к. она представляет собой разность стандартных потенциалов обеих пар можно написать:
ЭДС=![]() =0,77В;
=0,77В;
т.к.
величина φ0/2Н+/Н2
условно принята за 0, то
![]() =
+0,77В.
=
+0,77В.
Знак
плюс показывает, что данная пара при
комбинировании ее со стандартным
водородным электродом играет роль
положительного полюса и полученная для
этой пары
![]() величина
стандартного потенциала (+0,77В) является
мерой способностиFe3+
ионов отнимать электроны от молекулы
Н2,
т.е. окислять их до ионов Н+.
величина
стандартного потенциала (+0,77В) является
мерой способностиFe3+
ионов отнимать электроны от молекулы
Н2,
т.е. окислять их до ионов Н+.
Чем больше стандартный окислительно-восстановительный потенциал данной пары, тем более сильным окислителем является ее окисленная форма и более слабым восстановителем является восстановленная форма.
Когда комбинируются две какие-либо окислительно-восстановительные пары, то более сильный из двух окислителей отнимает электроны у более сильного восстановителя, причем образуются более слабые восстановитель и окислитель.
Значения
φ для различных окислительно-восстановительных
систем, измеренные в стандартных условиях
![]() (температура
298 К, давление 101,3 кПа, концентрации
окисленной и восстановленной форм,
равные единице: 1 моль/л или 1 г-ион/л)
приводятся в справочных таблицах (см.
приложение 3).
(температура
298 К, давление 101,3 кПа, концентрации
окисленной и восстановленной форм,
равные единице: 1 моль/л или 1 г-ион/л)
приводятся в справочных таблицах (см.
приложение 3).
Направление
окислительно-восстановительной реакции
таково, что из более сильных окислителя
и восстановителя получаются более
слабые окислитель и восстановитель.
Связь между величинами
![]() и
и![]() выражается формулой Нернста
выражается формулой Нернста
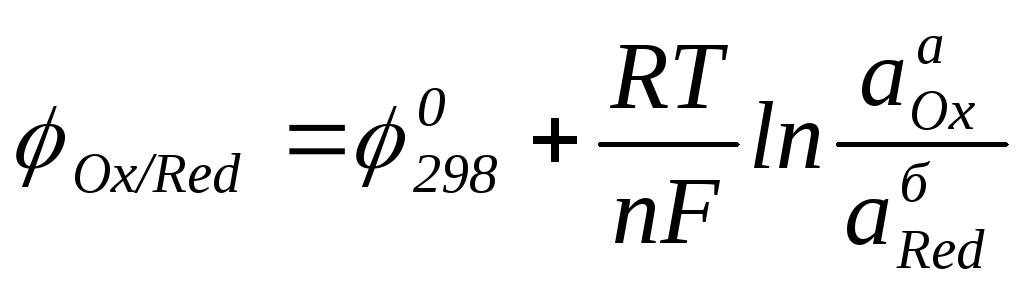 или
(5.1)
или
(5.1)
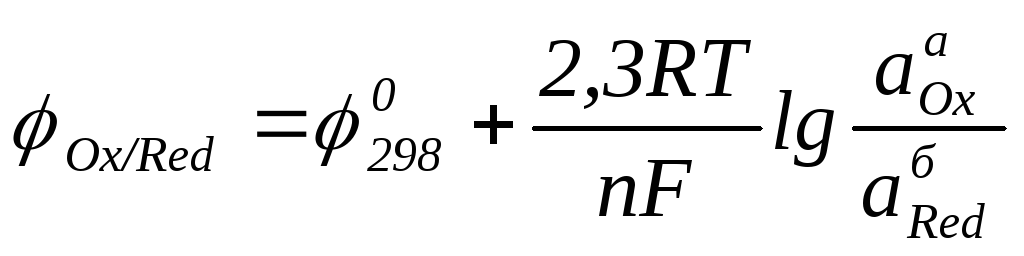 (5.2)
(5.2)
где Т – абсолютная температура (273+t°), К;
F – число Фарадея – 96485 кл/моль;
R – газовая постоянная – 8,31 Дж/(моль·K);
n – число электронов, принятых окислителем или отданных восстановителем;
aOx – активная концентрация окислителя;
aRed – активная концентрация восстановителя;
а и б – коэффициенты перед окислителем и восстановителем.
Если в формулу (5.2) подставить значения R, F, учитывая, что для разбавленных растворов активности ионов примерно равны их концентрациям, то для 25° С уравнение Нернста будет иметь следующий вид:
![]() ,
(5.3),
,
(5.3),
где [Ox] и [Red] – концентрации окислителя и восстановителя, моль/л.
Если в реакции принимают участие ионы водорода H+, то их концентрация влияет на величину ОВП:
![]() ,
(5.4)
,
(5.4)
где с - коэффициент перед H+ в ионно-молекулярном уравнении ОВР.
Например:
![]() (5.5)
(5.5)

![]() (5.6)
(5.6)
 (5.7)
(5.7)
Чем меньше величина окислительно-восстановительного потенциала, тем более сильными восстановительными свойствами характеризуется восстановленная форма окислительно-восстановительной системы и более слабыми окислительными свойствами характеризуется окисленная форма. И наоборот, чем положительнее величина окислительно-восстановительного потенциала, тем более сильными окислительными свойствами характеризуется окисленная форма и более слабые восстановительные свойства проявляет восстановленная форма в ОВР.
Например, при сравнении стандартных значений следующих ОВП (систем):
![]() и
и
![]() определим, между какими компонентами
этих систем сможет произойти реакция.
Так как значение
определим, между какими компонентами
этих систем сможет произойти реакция.
Так как значение![]() >
>![]() ,тоFe3+
будет
проявлять более сильные окислительные
свойства, чем
Сu2+,
а Cu0
– более сильные восстановительные
свойства, чем Fe2+.
Следовательно Cu0
и Fe3+
могут
прореагировать по следующей схеме
,тоFe3+
будет
проявлять более сильные окислительные
свойства, чем
Сu2+,
а Cu0
– более сильные восстановительные
свойства, чем Fe2+.
Следовательно Cu0
и Fe3+
могут
прореагировать по следующей схеме
![]() .
Составим молекулярное уравнение ОВР
исходя из схемы, для этого положительно
заряженные ионы нужно соединить с
отрицательно заряженными, так, чтобы
получилось нужное нейтральное соединение.
Как видно в самой схеме отрицательно
заряженных ионов нет, то необходимо
подумать, какие анионы можно использовать.
Выбор осуществляется по следующим
соображениям: вещество полученное при
сочетании ионов должно быть устойчивым
и растворимым. Для рассматриваемой
схемы такими ионами могут быть хлорид-
или сульфат-ионы. Наиболее удобны
хлорид-ионы. В левой части схемы больше
никаких катионов нет, поэтому другие
анионы не потребуются. В продуктах
реакции должны присутствовать эти же
анионы, поэтому и катионы правой части
соединим с хлорид-ионами:
.
Составим молекулярное уравнение ОВР
исходя из схемы, для этого положительно
заряженные ионы нужно соединить с
отрицательно заряженными, так, чтобы
получилось нужное нейтральное соединение.
Как видно в самой схеме отрицательно
заряженных ионов нет, то необходимо
подумать, какие анионы можно использовать.
Выбор осуществляется по следующим
соображениям: вещество полученное при
сочетании ионов должно быть устойчивым
и растворимым. Для рассматриваемой
схемы такими ионами могут быть хлорид-
или сульфат-ионы. Наиболее удобны
хлорид-ионы. В левой части схемы больше
никаких катионов нет, поэтому другие
анионы не потребуются. В продуктах
реакции должны присутствовать эти же
анионы, поэтому и катионы правой части
соединим с хлорид-ионами:![]() ,
ионыCu2+
окислить ионы Fe2+
не могут,
т.е. обратное направление этой реакции
невозможно.
,
ионыCu2+
окислить ионы Fe2+
не могут,
т.е. обратное направление этой реакции
невозможно.
Окислители
с большим потенциалом способны окислять
любой из восстановителей с меньшим
потенциалом. Так, ион
![]() в кислой среде, имеющий
в кислой среде, имеющий![]() может
окислить восстановители:
может
окислить восстановители:
![]() и
др.
и
др.
Чтобы
предвидеть направление ОВР, нужно найти
![]() (или
(или![]() реакции).
реакции).
![]()
![]()
Если
![]() (или
(или![]() )
больше нуля, реакция протекает слева
направо.
)
больше нуля, реакция протекает слева
направо.