
- •Основные понятия
- •1.2. Степень окисления или окислительное число атома в соединениях
- •Восстановители, окислители. Процессы окисления и восстановления
- •1.3.1. Восстановители
- •1.3.2. Окислители
- •1.4. Классификация окислительно-восстановительных реакций (типы овр)
- •1.4.1. Реакции межатомного или межмолекулярного окисления-восстановления
- •1.4.2. Реакции внутримолекулярного окисления – восстановления
- •1.4.3. Реакции диспропорционирования (самоокисления – самовосстановления)
- •2. Составление уравнений реакций окисления – восстановления
- •2.1. Метод электронного баланса
- •2.2. Метод ионно-электронного баланса (метод полуреакций)
- •Овр, протекающие в кислой среде
- •2.2.2. Овр, протекающие в щелочной среде
- •2.2.3. Овр, протекающие в присутствии молекул воды в левой части схемы
- •3.Некоторые особые случаи уравнений
- •3.1. Одновременное окисление атомов, находящихся
- •3.2. Овр в присутствии перекиси водорода (h2o2) и её соединений
- •3.3. Проявление восстановительной и окислительной способности разных атомов одного и того же элемента, входящих в состав разных веществ или одного и того же вещества
- •3.4. Особенности протекания овр при термитной сварке
- •3.5. Овр в присутствии окислителя – озона (о3)
- •3.6. Овр с участием органических соединений
- •4. Эквиваленты окислителей и восстановителей
- •5. Количественная характеристика окислительно-восстановительных реакций и направление овр
- •5.1. Электродный потенциал и его возникновение
- •5.2. Общие понятия о работе гальванического элемента
- •5.3. Стандартный электродный потенциал
- •5.4. Окислительно-восстановительные потенциалы
- •5.4.1. Направление овр в зависимости от значения величины энергии Гиббса ∆g
- •5.4.2. Условия, влияющие на величину овп и направление овр
- •5.4.3. Влияние на направление овр растворимости продукта реакции восстановленной формы
- •5.4.4. Константы равновесия окислительно-восстановительных реакций
- •5.4.5. Примеры решения задач на определение направления окислительно-восстановительных реакций
- •5.4.6. Задачи для самостоятельного решения
- •6. Механизмы некоторых реакций
- •7. Тестовый промежуточной контроль по теме овр
- •Задание: Коэффициент перед восстановителем в реакции
- •Задание: Константа равновесия окислительно-восстановительной системы пристандартных условиях ; равна:
- •Задание: Направление окислительно-восстановительной реакции при указанных условиях будет:
- •Задание: Окислительно-восстановительная реакция
- •Ответы: 1) 0,56 в; 2) 1,21 в; 3) 0,7 в; 4) 0,8 в; 5) 0,82 в.
- •Задание: Константа равновесия окислительно-восстановительной реакции
- •Задание: Константа равновесия реакции
- •Для стандартных условий равна:
- •8. Лабораторные работы
- •8.1. Рекомендации для подготовки к лабораторным занятиям
- •8.2. Реакции межмолекулярного окисления-восстановления Опыт 1. Окислительные свойства дихромата калия
- •Опыт 2. Окислительные свойства перманганата калия (kMnO4) в разных средах
- •Опыт 4. Восстановительные свойства галогенидов
- •Опыт 5. Взаимодействие растворов солей железа (ш) и иодида калия
- •8.3. Реакции внутримолекулярного окисления-восстановления
- •Опыт 2. Термическое разложение перманганата калия (kMnO4)
- •Опыт 3. Термическое разложение нитрата меди (II) (Cu(no3)2·2h2o)
- •8.4. Реакции диспропорционирования (самоокисления, самовосстановления) Опыт 1. Взаимодействие йода со щелочами
- •Опыт 2. Термическое разложение сульфита натрия
- •8.5. Двойственное поведение пероксида водорода в овр Опыт 1. Восстановительные свойства пероксида водорода
- •Опыт 2. Окислительные свойства пероксида водорода
- •8.6. Зависимость направления овр от рН среды Опыт 1 Влияние рН раствора на направление овр
- •8.7. Реакции, в которых окислитель или восстановитель
- •Расходуются также на связывание получаемых продуктов
- •Опыт 1. Окисление хлорид-иона концентрированной соляной кислоты
- •Двуокисью свинца (PbO2)
- •8.8. Учебно-исследовательская работа
- •10. Вопросы для домашнего задания
Опыт 2. Окислительные свойства пероксида водорода
а) Цель опыта
б) Теоретическое обоснование
в) Приборы: пробирка, пробиркодержатель, спиртовка.
г) Реактивы: раствор йодида калия или натрия 0,5н, 2 н раствор серной кислоты 2н, 3% -ный раствор перекиси водорода, крахмальный клейстер
д) Выполнение опыта и наблюдения.
1) К 2...3 каплям раствора йодида калия или натрия прибавить столько же разбавленной серной кислоты и 3...4 капли раствора пероксида водорода. Написать уравнение реакции. Какое вещество образовалось и как его можно обнаружить?
2) По обменной реакции между нитратом свинца (II) Pb(NO3)2 и сероводородной водой H2S получить осадок сульфида свинца PbS. Осадок отфильтровать и обработать 3%-ным раствором пероксида водорода. Как изменяется цвет осадка? Привести уравнение реакций получения сульфида свинца и его окисление в сульфат свинца PbSO4.
е) Сделать выводы, увязывая с наблюдениями и теоретическим обоснованием.
8.6. Зависимость направления овр от рН среды Опыт 1 Влияние рН раствора на направление овр
а) Цель опыта
б) Теоретическое обоснование
в) Приборы: пробирка, пробиркодержатель, спиртовка.
г) Реактивы: 0,5н раствор ортоарсената калия, 2н раствор серной кислоты, 0,5н раствор йодида калия (натрия).
д) Выполнение опыта и наблюдения:
К 2…3 каплям раствора ортоарсената калия прибавить 3 капли разбавленной серной кислоты и 2…3 капли раствора йодида калия. Что наблюдаете? Написать уравнение реакции. Как изменится цвет раствора при добавлении в него 3…4 капель концентрированного раствора щелочи? Ответ обоснуйте с помощью стандартных окислительно-восстановительных потенциалов систем AsO43-/AsO33- и J2/2J-.
е) Сделать выводы, увязывая с наблюдениями и теоретическим обоснованием.
8.7. Реакции, в которых окислитель или восстановитель
Расходуются также на связывание получаемых продуктов
Опыт 1. Окисление хлорид-иона концентрированной соляной кислоты
Двуокисью свинца (PbO2)
а) Цель опыта
б) Теоретическое обоснование
в) Приборы: пробирка, микрошпатель, пробиркодержатель, спиртовка
г) Реактивы: диоксид свинца, концентрированная HCl (ρ=1,19 г/см3)
д) Выполнение опыта и наблюдения:
В пробирку внести один микрошпатель порошка двуокиси свинца и 3 – 4 капли концентрированной соляной кислоты уд.веса 1,19. Пробирку осторожно нагреть. Отметить цвет выпавшего осадка хлорида свинца. Какой газ выделяется? Сколько молекул НСl в этой реакции явилось восстановителем? Написать уравнение реакции.
е) Сделать выводы, увязывая с наблюдениями в опыте и теоретическим обоснованием.
8.8. Учебно-исследовательская работа
Составить уравнения реакций перехода соединений марганца по схеме:
а) Цель опыта
б) Теоретическое обоснование
в) Приборы: пробирка стеклянная
г) Реактивы: 0,5 н растворы солей – KMnO4, Na2S, Na2S2O3, K2MnO4;
2н раствор HCl, 2н раствор NaOH, 3% -ный раствор перекиси водорода (Н2О2), кристаллы MnO2.
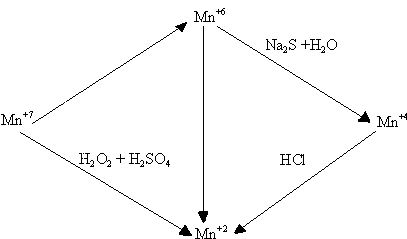
д) Выполнение опыта и наблюдения
е) Сделать выводы, увязывая с наблюдениями и теоретическим обоснованием.
9. Примеры ОВР для самостоятельного решения
Подберите коэффициенты в следующих окислительно-восстановительных реакциях. Укажите: восстановитель, окислитель; процессы окисления и восстановления.
FeS2 + HNO3
 Fe(NO3)3
+ NO + H2SO4
Fe(NO3)3
+ NO + H2SO4
KJ + (NH4)2Cr2O7 + H2SO4
 J2
+ Cr2(SO4)3
+ (NH4)2SO4
+ K2SO4
+ H2O
J2
+ Cr2(SO4)3
+ (NH4)2SO4
+ K2SO4
+ H2OPH3 + KMnO4 + H2SO4
 H3PO4
+ MnSO4
+ K2SO4
+ H2O
H3PO4
+ MnSO4
+ K2SO4
+ H2OMnO2 + KC1O3 + KOH
 K2MnO4
+ KC1 + H2O
K2MnO4
+ KC1 + H2OC3H5(OH)3 + K2Cr2O7 + H2SO4
 CO2
+ Cr2(SO4)3
+ K2SO4
+ H2O
CO2
+ Cr2(SO4)3
+ K2SO4
+ H2OCoCl2 + K2S2O8 + KOH
 Co2O3
+ K2SO4
+ KC1 + H2O
Co2O3
+ K2SO4
+ KC1 + H2OC2H2 + KMnO4 + H2SO4
 CO2
+ K2SO4
+ MnSO4
+ H2O
CO2
+ K2SO4
+ MnSO4
+ H2OK2MnO4 + Na2SO3 + H2O
 MnO2
+ Na2SO4
+ KOH
MnO2
+ Na2SO4
+ KOHHNO3 + Р + H2O
 H3PO4
+NO
H3PO4
+NOBaFeO4 + KJ + HC1
 FeCl2
+ BaCl2
+ J2
+ KC1 + H2O
FeCl2
+ BaCl2
+ J2
+ KC1 + H2OCrO3 + H2O2 + H2SO4
 Cr2(SO4)3
+ H2O
+ O2
Cr2(SO4)3
+ H2O
+ O2FeCl3 + H2O2 + KOH
 K2FeO4
+ KC1 + H2O
K2FeO4
+ KC1 + H2OKOH + Cl2
 KC1 + KC1O3
+ H2O
KC1 + KC1O3
+ H2ONa2WO4 + FeSO4 + H2SO4
 WO2
+ Fe2(SO4)3
+ Na2SO4
+ H2O
WO2
+ Fe2(SO4)3
+ Na2SO4
+ H2OHJO3+HJ
 J2+H2O
J2+H2OКBrO + MnCl2 + KOH
 KBr
+ MnO2
+ KC1 + H2O
KBr
+ MnO2
+ KC1 + H2ONaNO2 + NaJ + H2SO4
 NO
+ J2
+ Na2SO4
+ H2O
NO
+ J2
+ Na2SO4
+ H2OJ2 + Cl2 + H2O
 HJO3
+ HC1
HJO3
+ HC1N2H4 + AgNO3 + KOH
 N2
+ Ag + KNO3
+ H2O
N2
+ Ag + KNO3
+ H2OHNO2 + KMnO4 + H2SO4
 HNO3
+ MnSO4
+ K2SO4
+ H2O
HNO3
+ MnSO4
+ K2SO4
+ H2OKNO3 + Al + KOH + H2O
 NH3
+ KAIO2
NH3
+ KAIO2Au + HNO3 + HC1
 AuCl3
+ NO +H2O
AuCl3
+ NO +H2OPt + HNO3 + HC1
 PtCL4
+ NO + H2O
PtCL4
+ NO + H2OCu(NO3)2
 CuO
+ NO2
+ O2
CuO
+ NO2
+ O2AgNO3
 Ag
+ NO2+O2
Ag
+ NO2+O2NH4NO2
 N2+H2O
N2+H2OSeO2 + SO2 + H2O
 H2SO4
+ Se
H2SO4
+ SeAg + H2S + O2
 Ag2S
+ H2O
Ag2S
+ H2OBi + H2SO4
 Bi2(SO4)3
+ SO2
+ H2O
Bi2(SO4)3
+ SO2
+ H2OAs2O3 + Zn + H2SO4
 AsH3
+ ZnSO4
+ H2O
AsH3
+ ZnSO4
+ H2OK3As04 + KJ + H2SO4
 K3
AsO3
+ J2
+ K2SO4
+ H2O
K3
AsO3
+ J2
+ K2SO4
+ H2OP + HNO3 + H2O
 H3PO4+
NO
H3PO4+
NOKJ + H2O + O3
 J2+
KOH + O2
J2+
KOH + O2KMnO4
 K2MnO4
+ MnO2
+ O2
K2MnO4
+ MnO2
+ O2Br2+ C12+ H2O
 HBrO3
+ HC1
HBrO3
+ HC1C1O2+ KOH
 KC1O3
+ KC1O2+
H2O
KC1O3
+ KC1O2+
H2OFeCl2 + Cl2
 FeCl3
FeCl3KMnO4 + H2O2 + H2SO4
 MnSO4
+ O2
+ K2SO4
+ H2O
MnSO4
+ O2
+ K2SO4
+ H2OAg2O + H2O2
 Ag + H2O
+ O2
Ag + H2O
+ O2SO2 + Br2 + H2O
 HBr
+ H2SO4
HBr
+ H2SO4J2 + KOH
 KJO3
+ KJ + H2O
KJO3
+ KJ + H2OMg + H2SO4
 MgSO4
+ H2
MgSO4
+ H2Cu + H2SO4
 CuSO4
+ SO2
+ H2O
CuSO4
+ SO2
+ H2OKMnO4 + KOH
 K2MnO4
+ O2
+ H2O
K2MnO4
+ O2
+ H2OBi2S3 + HNO3
 Bi(NO3)3
+ NO + S + H2O
Bi(NO3)3
+ NO + S + H2ONiS + H2O2 + H2SO4
 S + NiSO4
+ H2O
S + NiSO4
+ H2OCr2(SO4)3 + K2S2O8+ H2O
 K2Cr2O7
+ K2SO4
+ H2SO4
K2Cr2O7
+ K2SO4
+ H2SO4AgNO3 + AsH3 + H2O
 Ag + H3
AsO4
+ HNO3
Ag + H3
AsO4
+ HNO3Na2S2O4 + AgCl + NH4OH
 (NH4)2SO3
+ NaCl + Ag + H2O
(NH4)2SO3
+ NaCl + Ag + H2OKJO3 + Cl2 + KOH
 K5JO6
+ H2O
+ KC1
K5JO6
+ H2O
+ KC1Na2SeO3 + Cl2 + NaOH
 Na2SeO4
+ NaCl + H2O
Na2SeO4
+ NaCl + H2OAsH3 + KMnO4 + H2SO4
 H3AsO4
+ MnSO4
+ K2SO4
+ H2O
H3AsO4
+ MnSO4
+ K2SO4
+ H2OHg + NaNO3 + H2SO4
 Na2SO4
+ Hg2SO4
+ NO + H2O
Na2SO4
+ Hg2SO4
+ NO + H2OH2C2O4 + KC1O3
 K2CO3
+ CO2
+ C1O2
+ H2O
K2CO3
+ CO2
+ C1O2
+ H2OMn(NO3)2 + PbO2 + HNO3
 HMnO4
+ Pb(NO3)2
+ H2O
HMnO4
+ Pb(NO3)2
+ H2OH2C2O4 + КСЮ3
 K2CO3
+ CO2
+ C1O2
+ H2O
K2CO3
+ CO2
+ C1O2
+ H2OКClO3 + FeCl2 + HC1
 KC1
+ FeCl3
+ H2O
KC1
+ FeCl3
+ H2OKH + SO2
 H2
+ K2S2O4
H2
+ K2S2O4KJ + Na2O2 + H2O
 J2
+ KOH + NaOH
J2
+ KOH + NaOHNa2O2 + KMnO4 + H2SO4
 O2
+ H2O
+ Na2SO4
+ K2SO4
+ MnSO4
O2
+ H2O
+ Na2SO4
+ K2SO4
+ MnSO4MoS2 + O2 + Na2CO3
 Na2MoO4
+ Na2SO4
+ CO2
Na2MoO4
+ Na2SO4
+ CO2CH3CH2OH + K2Cr2O7 + H2SO4
 CH3CHO+Cr2(SO4)3+K2SO4
+ H2O
CH3CHO+Cr2(SO4)3+K2SO4
+ H2OK2Mn04 + H2O
 KMnO4
+ MnO2
+ KOH
KMnO4
+ MnO2
+ KOHAu + KCN + O2 + H2O
 K[Au(CN)2]
+ KOH
K[Au(CN)2]
+ KOHP + KJO3 + KOH
 K3PO4
+ KJ + H2O
K3PO4
+ KJ + H2ON2H4+ J2 + KOH
 N2+
KJ + H2O
N2+
KJ + H2OFeBr2 + KMnO4 + H2SO4
 Fe2(SO4)3
+ FeBr3
+ MnSO4
+ KBr + H2O
Fe2(SO4)3
+ FeBr3
+ MnSO4
+ KBr + H2OH2O2 + AgNO3 + NH4OH
 O2
+ Ag + NH4NO3
+ H2O
O2
+ Ag + NH4NO3
+ H2OHCHO + [Ag(NH3)2]OH
 Ag + CO2
+
NH3
+ H2O
Ag + CO2
+
NH3
+ H2OH2S + C6H5NO2
 S
+ C6H5NH2
+ H2O
S
+ C6H5NH2
+ H2OAsH3 + AuCl3 + KOH
 K3As03
+ Au + H2O
K3As03
+ Au + H2ONaJ + MnO2 + H2SO4
 J2
+ MnSO4
+ Na2SO4
+ H2O
J2
+ MnSO4
+ Na2SO4
+ H2ONaHSO3 + NaJO3 + H2SO4
 Na2SO4
+ NaHSO4
+ J2
+ H2O
Na2SO4
+ NaHSO4
+ J2
+ H2OJ2+KC1O3
 KJO3+C12
KJO3+C12Br2+ NaOH
 H2O
+ NaBr + NaBrO3
H2O
+ NaBr + NaBrO3MnSO4 + PbO2 + HNO3
 HMnO4
+ Pb(NO3)2
+ PbSO4
+ H2O
HMnO4
+ Pb(NO3)2
+ PbSO4
+ H2OMnO2 + KBr + H2SO4
 K2SO4
+ MnSO4
+ Br2
+ H2O
K2SO4
+ MnSO4
+ Br2
+ H2OSbCl3 + Hg2Cl2 + NaOH
 NaSbO3
+ NaCl + Hg + H2O
NaSbO3
+ NaCl + Hg + H2OCoBr2 + O2 + KOH + H2O
 Co(OH)3
+ KBr
Co(OH)3
+ KBrCo(NO3)2 + AgNO3 + NaOH
 Co(OH)3
+ Ag + NaNO3
Co(OH)3
+ Ag + NaNO3Co + HNO3 + H2SO4
 COSO4
+ N2
+ H2O
COSO4
+ N2
+ H2OKMnO4 + NaNO2 + Ba(OH)2
 BaMnO4
+ NaNO3
+ KOH + H2O
BaMnO4
+ NaNO3
+ KOH + H2OKMnO4 + HNO2 + H2SO4
 HNO3
+ K2SO4
+ MnSO4
+ H2O
HNO3
+ K2SO4
+ MnSO4
+ H2OBi(NO3)3 + SnCl2 + NaOH
 Bi + Na2Sn03
+ NaNO3
+ NaCl + H2O
Bi + Na2Sn03
+ NaNO3
+ NaCl + H2OH2SO3 + H2S
 S
+ H2O
S
+ H2ONH4NO2
 N2
+ H2O
N2
+ H2OP + КОН + H2O
 PH3 +
КН2РО2
PH3 +
КН2РО2
S + КОН
 K2SO3
+ K2S
+ Н2О
K2SO3
+ K2S
+ Н2О
НС1 + CrO3
 CrCl3+ С12+ Н2О
CrCl3+ С12+ Н2ОF2 + H2O
 HF
+ O2
HF
+ O2AgNO3+ КОН + Н2О2
 Ag+KNO3+ О2ъ
Ag+KNO3+ О2ъK2SO3 + KMnO4 + H2SO4
 K2SO4
+ MnSO4
+ Н2О
K2SO4
+ MnSO4
+ Н2ОK2SO3 + KMnO4 + Н2О
 K2SO4
+ MnO2
+ КОН
K2SO4
+ MnO2
+ КОНK2SO3 + KMnO4 + KOH
 K2SO4
+ K2Mn04
+ H2O
K2SO4
+ K2Mn04
+ H2OHBr + H2SO4
 Br2
+ SO2
+ H2O
Br2
+ SO2
+ H2OС + H2SO4
 CO2
+ SO2
+ H2O
CO2
+ SO2
+ H2OZn + H2SO4
 ZnSO4
+ H2S
+ H2O
ZnSO4
+ H2S
+ H2OP + HNO3
 H3PO4
+ NO2
+ H2O
H3PO4
+ NO2
+ H2OAg + HNO3
 AgNO3
+ NO2
+H2O
AgNO3
+ NO2
+H2OCu + HNO3
 Cu(NO3)2
+ NO + H2O
Cu(NO3)2
+ NO + H2OZn + HNO3
 Zn(NO3)2
+ N2O
+ H2O
Zn(NO3)2
+ N2O
+ H2OZn + HNO3
 Zn(NO3)2
+ N2
+ H2O
Zn(NO3)2
+ N2
+ H2OMg + HNO3
 Mg(NO3)2
+ NH4NO3 + H2O
Mg(NO3)2
+ NH4NO3 + H2OКClO3 + FeSO4 + H2SO4
 KC1 + Fe2(SO4)3
+ H2O
KC1 + Fe2(SO4)3
+ H2OKMnO4 + KCrO2 + H2O
 K2Cr04
+ MnO(OH)2
K2Cr04
+ MnO(OH)2KMnO4 + H2SO4 + H2S
 K2SO4
+ MnSO4
+ S + H2O
K2SO4
+ MnSO4
+ S + H2OAs2S + HNO3 + H2O
 H3As04+
H2SO4+
NO
H3As04+
H2SO4+
NOCuS + HNO3
 Cu(NO3)2
+ NO + H2O
+ S
Cu(NO3)2
+ NO + H2O
+ SNa2SO3 + Na2Cr2O7 + H2SO4
 Na2SO4+
Cr2(SO4)3
+ H2O
Na2SO4+
Cr2(SO4)3
+ H2ONa2SO3 + J2 + H2O
 Na2SO4
+ HJ
Na2SO4
+ HJKCIO3 + FeCl2 + HCI
 KC1 + FeCl3
+ H2O
KC1 + FeCl3
+ H2OMnO(OH)2 + H2O2 + H2SO4
 MnSO4
+ H2O
+ O2
MnSO4
+ H2O
+ O2H2O2 + KJ + HCI
 J2
+ KC1 + H2O
J2
+ KC1 + H2OKMnO4 + HNO2 + H2SO4
 HNO3
+ K2SO4
+ MnSO4
+ H2O
HNO3
+ K2SO4
+ MnSO4
+ H2OH2O2 + AgNO3 + NH4OH
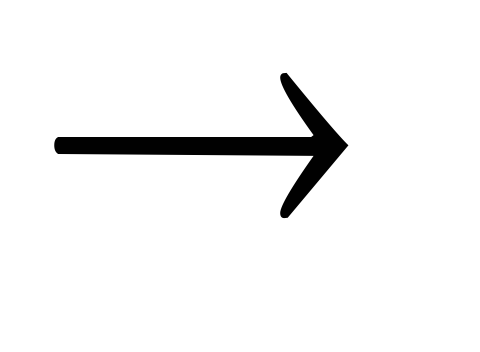 O2
+ Ag + NH4NO3
+ H2O
O2
+ Ag + NH4NO3
+ H2OKJ + H2O2 + H2SO4
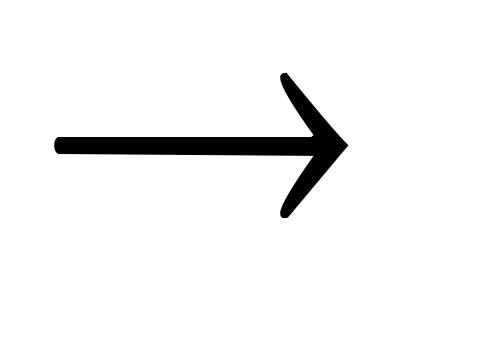 J2
+ K2SO4
+ H2O
J2
+ K2SO4
+ H2OKJ + O3 + H2O
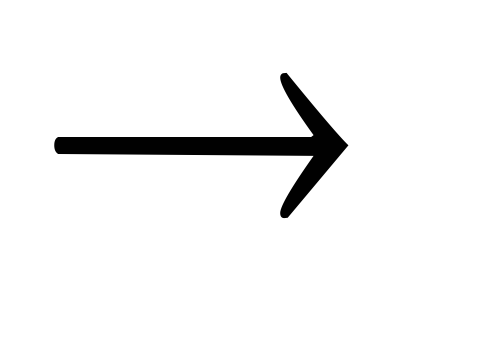 J2
+ O2
+ KOH
J2
+ O2
+ KOHN2H4 + KMnO4 + H2SO4
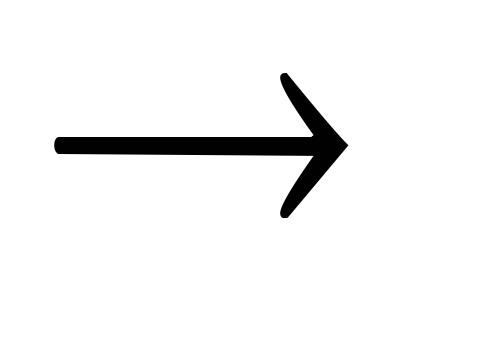 N2
+ MnSO4
+ K2SO4
+ H2O
N2
+ MnSO4
+ K2SO4
+ H2ONa2SO3 + HNO3
 Na2SO4
+ NO + H2O
Na2SO4
+ NO + H2OAs2O3 + HOC1 + H2O
 H3AsO4
+ HCI
H3AsO4
+ HCIMnSO4 + Ca(OCl)2 + NaOH
 MnO2
+ CaCl2
+ Na2SO4
+ H2O
MnO2
+ CaCl2
+ Na2SO4
+ H2OMnCl2 + KOC1 + KOH
 MnO2
+ KC1 + H2O
MnO2
+ KC1 + H2OMnSO4+ H2O2+ KOH
 MnO2+
K2SO4+
H2O
MnO2+
K2SO4+
H2OMnSO4 + NaNO3 + Na2CO3
 Na2Mn04
+ CO2
+ NaNO2
+ Na2SO4
Na2Mn04
+ CO2
+ NaNO2
+ Na2SO4Ni(OH)2+ CaOCl2+ H2O
 Ni(OH)3
+ CaCl2
Ni(OH)3
+ CaCl2UC14 + O2 + H2O
 UO2C12
+ HCI
UO2C12
+ HCIKJ + CeO2 + HCI
 J2
+ CeCl3
+ KC1 + H2O
J2
+ CeCl3
+ KC1 + H2OBi(NO3)3 + SnCl2 + NaOH
 Bi + Na2SnO,
+ NaCl + NaNO3
+ H2O
Bi + Na2SnO,
+ NaCl + NaNO3
+ H2OAs2Se3 + HNO3 + H2O
 H3AsO4
+ H2SeO4
+ NO
H3AsO4
+ H2SeO4
+ NOPbO2 + MnSO4 + HNO3
 HMnO4
+ PbSO4
+ Pb(NO3)2
+ H2O
HMnO4
+ PbSO4
+ Pb(NO3)2
+ H2OH2S + HNO3
 H2SO4
+ NO + H2O
H2SO4
+ NO + H2OK2Cr2O7 + NaNO2 + H2SO4
 Cr2(SO4)3
+ NaNO3
+ K2SO4
+ H2O
Cr2(SO4)3
+ NaNO3
+ K2SO4
+ H2OK2Cr2O7 + HCl
 CrCl3
+ Cl2
+ KCl + H2O
CrCl3
+ Cl2
+ KCl + H2O
