
- •Основные понятия
- •1.2. Степень окисления или окислительное число атома в соединениях
- •Восстановители, окислители. Процессы окисления и восстановления
- •1.3.1. Восстановители
- •1.3.2. Окислители
- •1.4. Классификация окислительно-восстановительных реакций (типы овр)
- •1.4.1. Реакции межатомного или межмолекулярного окисления-восстановления
- •1.4.2. Реакции внутримолекулярного окисления – восстановления
- •1.4.3. Реакции диспропорционирования (самоокисления – самовосстановления)
- •2. Составление уравнений реакций окисления – восстановления
- •2.1. Метод электронного баланса
- •2.2. Метод ионно-электронного баланса (метод полуреакций)
- •Овр, протекающие в кислой среде
- •2.2.2. Овр, протекающие в щелочной среде
- •2.2.3. Овр, протекающие в присутствии молекул воды в левой части схемы
- •3.Некоторые особые случаи уравнений
- •3.1. Одновременное окисление атомов, находящихся
- •3.2. Овр в присутствии перекиси водорода (h2o2) и её соединений
- •3.3. Проявление восстановительной и окислительной способности разных атомов одного и того же элемента, входящих в состав разных веществ или одного и того же вещества
- •3.4. Особенности протекания овр при термитной сварке
- •3.5. Овр в присутствии окислителя – озона (о3)
- •3.6. Овр с участием органических соединений
- •4. Эквиваленты окислителей и восстановителей
- •5. Количественная характеристика окислительно-восстановительных реакций и направление овр
- •5.1. Электродный потенциал и его возникновение
- •5.2. Общие понятия о работе гальванического элемента
- •5.3. Стандартный электродный потенциал
- •5.4. Окислительно-восстановительные потенциалы
- •5.4.1. Направление овр в зависимости от значения величины энергии Гиббса ∆g
- •5.4.2. Условия, влияющие на величину овп и направление овр
- •5.4.3. Влияние на направление овр растворимости продукта реакции восстановленной формы
- •5.4.4. Константы равновесия окислительно-восстановительных реакций
- •5.4.5. Примеры решения задач на определение направления окислительно-восстановительных реакций
- •5.4.6. Задачи для самостоятельного решения
- •6. Механизмы некоторых реакций
- •7. Тестовый промежуточной контроль по теме овр
- •Задание: Коэффициент перед восстановителем в реакции
- •Задание: Константа равновесия окислительно-восстановительной системы пристандартных условиях ; равна:
- •Задание: Направление окислительно-восстановительной реакции при указанных условиях будет:
- •Задание: Окислительно-восстановительная реакция
- •Ответы: 1) 0,56 в; 2) 1,21 в; 3) 0,7 в; 4) 0,8 в; 5) 0,82 в.
- •Задание: Константа равновесия окислительно-восстановительной реакции
- •Задание: Константа равновесия реакции
- •Для стандартных условий равна:
- •8. Лабораторные работы
- •8.1. Рекомендации для подготовки к лабораторным занятиям
- •8.2. Реакции межмолекулярного окисления-восстановления Опыт 1. Окислительные свойства дихромата калия
- •Опыт 2. Окислительные свойства перманганата калия (kMnO4) в разных средах
- •Опыт 4. Восстановительные свойства галогенидов
- •Опыт 5. Взаимодействие растворов солей железа (ш) и иодида калия
- •8.3. Реакции внутримолекулярного окисления-восстановления
- •Опыт 2. Термическое разложение перманганата калия (kMnO4)
- •Опыт 3. Термическое разложение нитрата меди (II) (Cu(no3)2·2h2o)
- •8.4. Реакции диспропорционирования (самоокисления, самовосстановления) Опыт 1. Взаимодействие йода со щелочами
- •Опыт 2. Термическое разложение сульфита натрия
- •8.5. Двойственное поведение пероксида водорода в овр Опыт 1. Восстановительные свойства пероксида водорода
- •Опыт 2. Окислительные свойства пероксида водорода
- •8.6. Зависимость направления овр от рН среды Опыт 1 Влияние рН раствора на направление овр
- •8.7. Реакции, в которых окислитель или восстановитель
- •Расходуются также на связывание получаемых продуктов
- •Опыт 1. Окисление хлорид-иона концентрированной соляной кислоты
- •Двуокисью свинца (PbO2)
- •8.8. Учебно-исследовательская работа
- •10. Вопросы для домашнего задания
5.4.3. Влияние на направление овр растворимости продукта реакции восстановленной формы
Рассмотрим реакцию, лежащую в основе определения содержания меди (II) в растворе сульфата меди (II) методом иодометрии:
![]() (5.12)
(5.12)
В этой реакции участвуют две пары окислительно-восстановительных систем: Cu2+/Cu+ и J2/2J¯, значения φ° которых равны 0,17 и 0,54 В соответственно.
В этой реакции Cu2+ восстанавливается до Cu+ и сравнивая значения φ° этих пар, можно предположить, что данная реакция невозможна в прямом направлении, т.к. ∆φ° <0.
Однако эта реакция практически протекает, так как восстановленный ион Cu+ входит в продукт реакции, который мало растворим и характеризуется ПРCuI = 10-12. Вследствие малой растворимости продукта реакции CuJ, сильно понижается в растворе активная концентрация иона Cu+ и результатом этого является увеличение потенциала пары Cu2+/Cu+.
Рассчитаем потенциал пары Cu2+/Cu+ по уравнению Нернста. Из значения ПРCuJ, равного 10-12, и приняв концентрацию иодид-ионов равной 10-1 моль/л, рассчитаем концентрацию ионов Cu (I). ПРCuJ =[Cu+][J¯] =10-12 =>
[Cu+]=10-12/10-1=10-11моль/л
и
![]() ,
условно приняв концентрацию ионов меди
(II)
равной 1 моль/л:
,
условно приняв концентрацию ионов меди
(II)
равной 1 моль/л:
![]() ;
тогда
;
тогда
![]() .
.
Поскольку величина 0,808В больше величины стандартного потенциала пары J2/2J¯ (+0,54В), то рассматриваемая реакция должна идти в прямом направлении:
Δφреакции = 0,808 – 0,54 = 0,268В т.е Δφ > 0 и рассматриваемая реакция протекает в направлении
![]() .
.
Такие случаи наблюдаются нередко. Причиной изменения направления могут являться не только понижение активной концентрации того или иного иона в растворе в результате образования малорастворимого соединения, но и связывание этого иона в прочный комплекс.
5.4.4. Константы равновесия окислительно-восстановительных реакций
и влияние их на направление ОВР
ОВР – это обратимые реакции, поэтому и возможно изменить направление их на прямо противоположное. А в обратимых реакциях устанавливается химическое равновесие: константу равновесия окислительно-восстановительных реакций можно рассчитать, зная величины стандартных потенциалов обеих окислительно-восстановительных пар.
Пример:
Для
реакции
![]() (5.13)
(5.13)
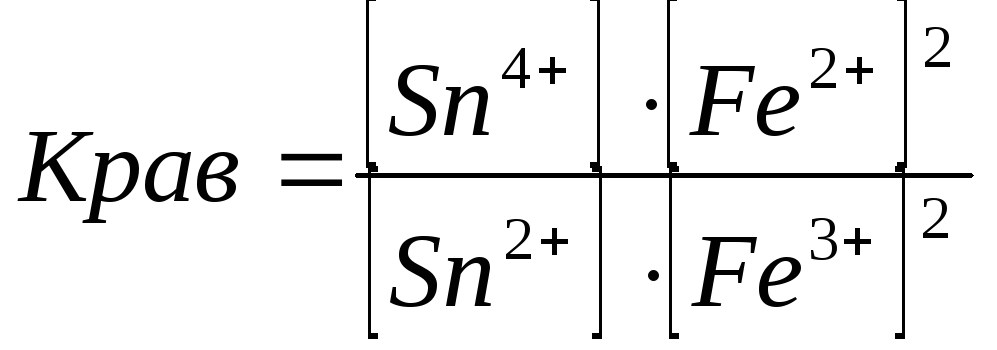 (5.14)
(5.14)
Из
табл. 3 выпишем значения φ0
обеих окислительно-восстановительных
пар:![]() ,
,![]() .
.
Выражение
ОВП пар
![]() будут
равны
будут
равны![]() (5.15)
(5.15)
![]() (5.16)
(5.16)
Из
этих уравнений видно, что по мере
увеличения концентраций ионов
![]() и уменьшения концентраций ионов
и уменьшения концентраций ионов![]() и
и![]() в результате протекания реакции потенциал
первой пары (5.15), который первоначально
был меньше, должен постепенно увеличиваться,
а второй пары (5.16) – уменьшаться, это
приводит к выравниванию значений
потенциалов и установлению равновесия
в результате протекания реакции потенциал
первой пары (5.15), который первоначально
был меньше, должен постепенно увеличиваться,
а второй пары (5.16) – уменьшаться, это
приводит к выравниванию значений
потенциалов и установлению равновесия
![]() (5.17)
(5.17)
Подставляя
в это равенство значения
![]() и
и![]() ,
из уравнений (5.15), (5.16) получим
,
из уравнений (5.15), (5.16) получим![]() и, сделав некоторые математические
преобразования, получим
и, сделав некоторые математические
преобразования, получим
![]() второй
член левой части (5.17) преобразуем и
получим
второй
член левой части (5.17) преобразуем и
получим
![]() отсюда
отсюда
![]() ;
так как выражение, стоящее под знаком
логарифма, представляет собой константу
равновесия (5.17), то
;
так как выражение, стоящее под знаком
логарифма, представляет собой константу
равновесия (5.17), то
![]() Кравнов=1021.
(5.18)
Кравнов=1021.
(5.18)
Найденный результат показывает, что при установившемся равновесии произведение концентраций Sn4+ и Fe2+ в 1021 раз превышает произведение концентраций оставшихся непревращенных Sn2+ и Fe3+.
Вывод:
высокое числовое значение константы
равновесия свидетельствует о том, что
данная ОВР протекает практически до
конца. Для любого обратимого
окислительно-восстановительного
процесса выведено следующее уравнение:
![]() (5.19), где
(5.19), где
![]() и
и![]() - стандартные окислительно-восстановительные
потенциалы пар,n
– число электронов. Из этого уравнения
следует, что константы равновесия ОВР
тем больше, чем больше разность стандартных
потенциалов обеих пар. Если эта разность
большая, ОВР протекает практически до
конца, а при малой разности потенциалов
химическое превращение взятых веществ
до конца не доходит и поэтому, чтобы ОВР
протекали в прямом направлении до конца,
нужно создавать определенные условия:
- стандартные окислительно-восстановительные
потенциалы пар,n
– число электронов. Из этого уравнения
следует, что константы равновесия ОВР
тем больше, чем больше разность стандартных
потенциалов обеих пар. Если эта разность
большая, ОВР протекает практически до
конца, а при малой разности потенциалов
химическое превращение взятых веществ
до конца не доходит и поэтому, чтобы ОВР
протекали в прямом направлении до конца,
нужно создавать определенные условия:
1) рН среды; 2) температуру; 3) активные концентрации ионов окисленной и восстановленной форм.
