
- •Ярославский государственный университет
- •Часть I. Механика
- •Глава 1. Кинематика
- •1.1. Общие понятия
- •1.2. Векторные величины. Действия над векторами
- •1.3. Производная
- •1.4. Траектория, путь, перемещение, скорость
- •1.5. Ускорение
- •1.6. Кинематика вращательного движения
- •Глава 2. Динамика материальной точки
- •2.1. Общие понятия
- •2.2. Виды взаимодействия и сил в природе
- •2.3. Первый закон Ньютона. Инерциальные системы отсчета
- •2.4. Масса и импульс тела
- •2.5. Второй закон Ньютона
- •2.6. Третий закон Ньютона
- •2.7. Преобразования Галилея. Принцип относительности Галилея
- •8. Упругие силы
- •2.8.1. Деформация растяжения – сжатия
- •2.8.2. Деформация сдвига
- •2.9. Силы трения
- •2.10. Сила тяжести. Вес тела
- •2.11. Тело на наклонной плоскости
- •Глава 3. Законы сохранения
- •3.1. Сохраняющиеся величины
- •3.2. Кинетическая энергия
- •3.3. Работа
- •3.4. Консервативные силы. Потенциальная энергия
- •3.5. Потенциальная энергия во внешнем поле сил тяжести Земли
- •3.6. Потенциальная энергия упругой деформации
- •3.7. Условия равновесия механической системы
- •3.8. Закон сохранения импульса
- •3.9. Соударение двух тел
- •Глава 4. Механика твердого тела
- •4.1. Кинематика твердого тела
- •2. Кинетическая энергия при вращательном движении. Момент инерции тела
- •4.3. Основной закон динамики вращательного движения. Момент силы
- •Глава 5. Неинерциальные системы отсчета. Силы инерции
- •5.1. Неинерциальные системы отсчета. Силы инерции
- •5.2. Силы инерции при прямолинейном движении системы отсчета
- •5.3. Центробежная сила инерции
- •5.4. Сила Кориолиса
- •Глава 6. Общие вопросы теории относительности
- •1. Специальная теория относительности (релятивистская механика)
- •6.2. Общая теория относительности
- •Глава 7. Гидродинамика
- •7.1. Основные понятия гидродинамики. Уравнение неразрывности
- •7.2. Уравнение Бернулли и его следствия
- •7.3. Следствия уравнения Бернулли
- •7.3.1. Горизонтальная струя жидкости
- •7.3.2. Истечение жидкости из отверстия
- •7.4. Силы внутреннего трения
- •7.5. Ламинарное и турбулентное течения
- •7.6. Течение жидкости в круглой трубе
- •7.7. Движение тел в жидкостях и газах
- •7.8. Определение вязкости жидкости с использованием формулы Стокса
- •Часть 2. Колебания и волны
- •1. Колебательное движение. Свободные, затухающие, вынужденные колебания
- •2. Упругие волны
- •3. Уравнение упругой волны
- •Часть 3. Молекулярная физика и термодинамика
- •1.1. Агрегатные состояния вещества
- •1.2. Жидкое состояние. Поверхностное натяжение
- •1.3. Давление под изогнутой поверхностью
- •1.4. Равновесие на границе раздела: твердое тело, газ и жидкость
- •1.5. Капиллярные явления
- •Глава 2. Основы термодинамики
- •2.1. Внутренняя энергия системы
- •2.2. Первое начало термодинамики
- •2.3. Идеальный газ
- •2.3.1. Уравнение состояния идеального газа
- •2.3.2. Внутренняя энергия и теплоемкость идеального газа
- •2.4. Изопроцессы
- •2.4.1. Изотермический процесс. Закон Бойля-Мариотта
- •2.4.2. Изобарный процесс. Закон Гей-Люсака
- •2.4.3. Изохорный процесс. Закон Шарля
- •2.4.4. Адиабатический процесс
- •2.5. Газ Ван-дер-Ваальса
- •2.6. Осмос
- •1. Микро и макро состояния. Энтропия
- •2. Термодинамические потенциалы
- •2.1. Внутренняя энергия
- •2.2. Свободная энергия
- •2.3. Энтальпия
- •2.4. Термодинамический потенциал Гиббса
- •3.Тепловые двигатели
- •Глава 3. Элементарная молекулярно кинетическая теория газов
- •3.1. Характер теплового движения молекул. Распределение Максвелла по скоростям молекул
- •3.2. Давление газа на стенку. Основное уравнение молекулярно-кинетической теории газов
- •3.3. Барометрическая формула. Распределение Больцмана по энергиям молекул
- •Глава 4. Фазовые равновесия и превращения
- •4.1. Фазовые состояния и диаграммы
- •4.2.Фазовые переходы испарения и конденсации. Равновесие жидкости и насыщенного пара
- •4.3. Пересыщенный пар и перегретая жидкость
- •Часть I. Механика
- •Глава 1. Кинематика
- •Глава 2. Динамика материальной точки
- •Глава 3. Законы сохранения
- •Часть 2. Колебания и волны
- •Глава 3. Основы молекулярно кинетической теории газов
- •Глава 4. Фазовые равновесия и превращения
2.4. Изопроцессы
Многие процессы изменения состояния определенной массы идеального газа происходят так, что один из трех макроскопических параметров, входящих в уравнение состояния (8) рV=vRT= (m/M)RT, остается постоянным, два других соответственно изменяются. Такие процессы называютсяизопроцессами.
2.4.1. Изотермический процесс. Закон Бойля-Мариотта
Для изотермическогопроцесса (Т =const) в соответствии с (8) получим
рV = v RT = = (m/M) RT = const. (24)
Уравнение (24) известно как закон Бойля-Мариотта.
При изотермическом процессе внутренняя энергия тела в соответствии с (18) не изменяется, поэтому все переданное телу тепло идет на совершение работы: Q=A. При расширении газа, находящегося в цилиндрическом сосуде под поршнем, при столкновении с поршнем скорость (и соответственно энергия) молекул будет уменьшаться, поэтому для сохранения температуры газа к нему надо подводить теплоQ>0 и соответственно А>0. При изотермическом сжатии соответственноQ<0 и А<0. Диаграммы состояний идеального газа для различных параметров, отложенных по осям координат, приведены на рис. 5, а, б и в .
Графиком функции на рис. 5, а является гипербола р = (const)/Vи работа при изменении объема отV1доV2, согласно (5) будет равна:
V2
A12 = рdV = (m/M)RTln (V2/V1) (25)
V1

а б в
Рис. 5.
2.4.2. Изобарный процесс. Закон Гей-Люсака
Изобарный процесс происходит при постоянном давлении. Из уравнения Клайперона-Менделеева при этом условии следует закон Гей-Люсака:
V = [(mR)/Мр] Т = const Т, (26)
или объем газа при постоянном давлении пропорционален термодинамической температуре, что, как уже отмечалось, используется для построения термодинамической температурной шкалы. Диаграммы изобарного процесса приведены на рис. 6.



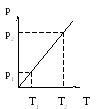
Рис. 6. Рис. 7.
Работа при изобарном процессе при изменении объема от V1доV2будет равна в соответствии с (5) р(V2–V1). При расширении газ совершает положительную работу, отдавая энергию окружающим телам. При сжатии – работа отрицательна и внутренняя энергия газа увеличивается.
2.4.3. Изохорный процесс. Закон Шарля
Изохорный процесс идет при постоянном объеме. Из уравнения Клайперона-Менделеева при этом условии следует закон Шарля:
р = [(mR)/МV] Т = const T. (27)
Давление газа при постоянном объеме пропорционально термодинамической температуре. Соответствующие диаграммы приведены на рис. 7. Поскольку изменения объема газа не происходит, работа в этом случае не совершается.
2.4.4. Адиабатический процесс
В некоторых случаях для более полного преобразования тепла в полезную работу систему необходимо теплоизолировать. Термодинамический процесс, протекающий в теплоизолированной системе без обмена теплом cокружающими телами (Q= 0) называетсяадиабатичеким.
Первое начало термодинамики для адиабатического процесса будет иметь вид:
dU+ А = 0 или А = –dU. (28)
При адиабатическом расширении газа А>0, следовательно внутренняя энергия газа уменьшается и в соответствии с (18) (Uм=CVT) температура газа должна уменьшаться, по сравнению с первоначальной. Понижение температуры при адиабатическом расширении происходит более резко, чем при изотермическом процессе, рис. 8. На рис. 8 изображена адиабата 1-2, пересекающая две изотермы при температурах Т1и Т2. Работа, совершаемая газом при адиабатическом расширении от объемаV1до объемаV2равна площади под кривой 1-2.
 При
адиабатическом сжатии газа его внутренняя
энергия будет увеличиваться, и
соответственно будет возрастать
температура. Так резкое сжатие воздуха
в цилиндре дизельного двигателя приводит
к воспламенению топлива, впрыскиваемого
в момент наибольшего сжатия и. Это в
свою очередь ведет к резкому возрастанию
давления и расширению газа, в результате
чего совершается полезная работа.
При
адиабатическом сжатии газа его внутренняя
энергия будет увеличиваться, и
соответственно будет возрастать
температура. Так резкое сжатие воздуха
в цилиндре дизельного двигателя приводит
к воспламенению топлива, впрыскиваемого
в момент наибольшего сжатия и. Это в
свою очередь ведет к резкому возрастанию
давления и расширению газа, в результате
чего совершается полезная работа.
Адиабатический процесс описывается уравнением
рV=const. ()

Рис. 8. Рис. 9.
