
Полезные материалы за все 6 курсов / Ответы к занятиям, экзаменам / Недзьведь_М_,_Черствый_Е_Патологическая
.pdfморрагий, отека, стаза, кровоизлияний, дистрофии и некроза, но и атрофических и склеротических процессов.
Склеротические процессы (изменения), проявляющиеся разрастанием соединительной ткани, обусловлены тем, что хроническая гипоксия стимулирует синтез коллагена фибробластами и фибробластоподобными клетками. Соединительная ткань вытесняет паренхиматозные элементы, в связи с чем развивается застойное уплотнение (индурация) органов и тканей.
Порочный круг при хроническом венозном полнокровии замыкается развитием капиллярно-паренхиматозного блока в связи с утолщением базальных мембран эндотелия за счет повышенной выработки коллагена клетками фибробластического ряда.
Для хронического венозного полнокровия характерны отеки жировой клетчатки кожи (анасарка) и скопление жидкости в серозных полостях: плевральной (гидроторакс), полости перикарда (гидроперикард), брюшной (асцит).
Внутренние органы при хроническом венозном полнокровии увеличиваются в размерах; цвет их становится синюшным из-за повышенного содержания восстановленного гемоглобина; органы плотные вследствие сопутствующего нарушения лимфообращения, отека и разрастания соединительной ткани.
Кожа нижних конечностей у таких больных обычно холодная, приобретает синюшную окраску (акроцианоз), вены расширяются, переполняются кровью. В связи с венозным застоем, отеком и склерозом в коже развиваются воспалительные процессы и язвы, которые плохо заживают.
В слизистых оболочках венозное полнокровие проявляется цианозом, повышенной продукцией слизи, застойным катаральным воспалением.
Хроническая левожелудочковая сердечная недостаточность морфологически проявляется хроническим венозным полнокровием легких с развитием бурой индурации (рис. 22, а на цв. вкл.). В легких отмечается два вида изменений: множественные диапедезные кровоизлияния, возникающие вследствие повышенной проницаемости эндотелия сосудов, обусловливающие гемосидероз легких, и разрастание соединительной ткани (склероз).
Макроскопически легкие становятся большими, на разрезе ткань имеет ржавый цвет, она значительно уплотнена (бурое уплотнение, бурая индурация).
При гистологическом исследовании бурой индурации легких отмечается расширение сосудов межальвеолярных перегородок, в строме легкого и просвете альвеол обнаруживаются скопления сидерофагов (рис. 22, б на цв. вкл.), «нагруженных» гемосидерином, межальвеоляр-
70
ные перегородки утолщены и склерозированы, часть альвеол заполняется отечной жидкостью.
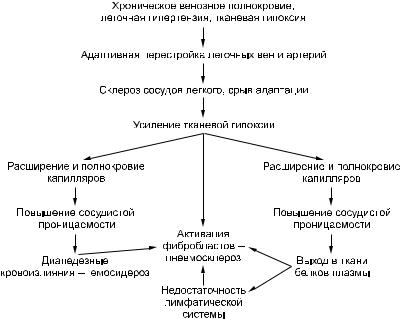
Вморфогенезебурогоуплотнениялегкихосновнуюрольиграютзастойноеполнокровиеигипертензиявмаломкругекровообращения(рис. 23).
Бурой индурации предшествует длительная стадия адаптивной перестройки мелких ветвей легочной артерии и вен, выражающаяся в картине посткапиллярной гипертензии в малом круге. При этом развивается выраженная гипертрофия мышечной оболочки внутридольковых вен, просвет их суживается, что предохраняет капилляры легких от регургитации крови.
Гипертрофия мелких ветвей легочной артерии достигает максимума лишь при давлении в системе легочной артерии, в 3 раза превышающем нормальное. В этот период происходит перестройка по типу замыкающих сосудов, что приводит к еще большему сужению просвета. Со временем адаптивные изменения сосудов легких сменяются склеротическими, развивается декомпенсация легочного кровообращения, капилляры межальвеолярных перегородок переполняются кровью, нарастает гипоксия ткани, в связи с чем повышается сосудистая проницаемость, возникают множественные диапедезные кровоизлияния.
Рис. 23. Морфогенез бурого уплотнения легких (по А.И. Струкову, В.В. Серову)
71
Гемосидерин и белки плазмы «засоряют» строму и лимфатические дренажи в легких, что ведет к резорбционной недостаточности их лимфатической системы, которая сменяется механической. Склероз кровеносных сосудов и недостаточность лимфатической системы усиливают легочную гипоксию, которая становится причиной пролиферации фибробластов и утолщения межальвеолярных перегородок. Возникает ка- пиллярно-паренхиматозный блок, замыкающий порочный круг в морфогенезе индурации легких, развивается застойный фиброз легких. Он обычно более заметен в нижних отделах легких, где сильнее выражен венозный застой и больше скоплений кровяных пигментов (гемосидерина и ферритина).
Хроническая правожелудочковая недостаточность морфологиче-
ски проявляется мускатной печенью, цианотической индурацией кожи, почек и селезенки, отеками на нижних конечностях, асцитом.
Основными причинами правожелудочковой сердечной недостаточности являются: легочная гипертензия, эмболия легочной артерии, пороки трехстворчатого клапана, некоторые виды миокардитов, изредка – инфаркт миокарда с вовлечением правого желудочка.
Макроскопически при хронической правожелудочковой сердечной недостаточности находят увеличенную печень. Она плотная, края ее закруглены, поверхность разреза пестрая, серо-желтая с темно-красным крапом, чем напоминает мускатный орех (рис. 24 на цв. вкл.).
При микроскопическом исследовании печени видно, что полнокровны лишь центральные отделы долек (рис. 25 на цв. вкл.), где отмечаются кровоизлияния, дискомплексация печеночных балок и гибель гепатоцитов. Именно эти отделы на разрезе выглядят темно-красными. На периферии долек гепатоциты находятся в состоянии жировой дистрофии, чем объясняется серо-желтый цвет на разрезе печеночной ткани.
Хроническое венозное полнокровие печени сопровождается веноартериальной реакцией: гипертрофией мелких ветвей печеночных артерий, имеющих узкий просвет вследствие гипертрофии циркулярного и продольного слоев, в дальнейшем стенки сосудов склерозируются.
Морфогенез изменений печени при длительном венозном застое (мускатная печень) сложен (рис. 26).
Избирательное полнокровие центра долек обусловлено тем, что венозный застой печени захватывает, прежде всего, печеночные вены, далее распространяясь на собирательные и центральные вены, а затем и на синусоиды. Последние расширяются, но только в центральных и средних отделах дольки, где встречают сопротивление со стороны впадающих в синусоиды разветвлений печеночной артерии, давление в которой всегда выше, чем в синусоидах. По мере нарастания полнокровия в центре долек появляются кровоизлияния; гепатоциты здесь подвергаются дистрофии, некрозу и атрофии. Гепатоциты периферии долек компенсаторно гипертрофируются. Разрастание соединитель-
72
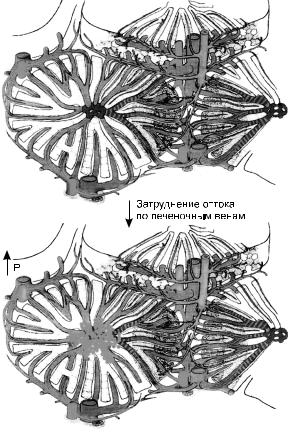
ной ткани в зоне кровоизлияний и гибели гепатоцитов связано с пролиферацией клеток синусоидов – липоцитов, которые могут выступать в роли фибробластов, а вблизи центральных и собирательных вен – с пролиферацией фибробластов адвентиции этих вен.
В результате разрастания соединительной ткани в синусоидах появляется непрерывная базальная мембрана (в норме она отсутствует), возникает капиллярно-паренхиматозный блок, который, усугубляя гипоксию, ведет к прогрессированию атрофических и склеротических изменений в печени.
В финале развивается застойный фиброз (склероз) печени, который называюттакжемускатнымиликардиальным(сердечныйциррозпечени).
Рис. 26. Схема морфогенеза мускатной печени
73
2.1.3. Малокровие
Малокровие – процесс, противоположный полнокровию, может носить как общий, так и местный характер.
Общее малокровие, или анемия, является заболеванием кроветворной системы и характеризуется недостаточным содержанием эритроцитов и гемоглобина в крови. К расстройствам кровообращения анемия отношения не имеет.
Местное малокровие, или ишемия, – это уменьшение кровенаполнения органа, части тела в результате недостаточного притока артериальной крови.
В зависимости от причин и условий возникновения различают следующие виды местного малокровия:
ангиоспастическое – вследствие спазма артерий; обтурационное – вследствие закрытия просвета артерии тромбом
или эмболом; компрессионное – при сдавлении артерии жгутом, лигатурой,
инородным телом, опухолью; вследствие перераспределения крови (например, малокровие го-
ловного мозга при извлечении асцитической жидкости из брюшной полости, куда устремляется большая часть крови).
Изменения ткани при малокровии обусловлены длительностью возникающей при этом гипоксии и степенью чувствительности к ней тканей. При остром малокровии обычно возникают дистрофические и некротические изменения, при хроническом – атрофия паренхиматозных элементов и склероз стромы. Неблагоприятным исходом ишемии является инфаркт, развитие которого зависит от длительности ишемии, быстроты ее развития и типа ткани, которая подвергается ишемии.
2.2. Нарушения проницаемости стенки сосудов
2.2.1. Кровотечение
Кровотечение (геморрагия) – выход крови из просвета кровеносного сосуда или полости сердца в окружающую среду (наружное кровотечение) или в полости (внутреннее кровотечение).
Примерами наружного кровотечения являются: кровохарканье
(haemoptoä), кровотечениеизноса(epistaxis), рвотакровью(haemotemesis),
выделение крови с калом (melena), кровотечение из матки (metrorrhagia). При внутреннем кровотечении кровь может накапливаться в полости перикарда (гемоперикард), плевры (гемоторакс), брюшной полости
(гемоперитонеум).
74
Если при кровотечении кровь накапливается в тканях, то это называется кровоизлиянием. Кровоизлияние – частный исход кровотечения.
Причины кровотечения следующие:
разрыв стенки сосуда при ранении и травме, хирургических операциях либо при развитии в стенке сосуда патологических процессов (атеросклероз с формированием аневризм, артериальная гипертензия – за счет фибриноидного некроза стенки артериол, разрыв сердца при трансмуральноминфарктемиокарда). Кровотечениевовсехэтихслучаях обусловлено разрывом стенки сосуда или сердца (haemorrhagia per rhexin, от лат. rhexo – разрываю);
разъедание стенки сосуда и, как следствие, – кровотечение
(haemorrhagia per diabrosin, от греч. diabrosis – разъедание). Этот вид кровотечения возникает при многих патологических состояниях: разъедание стенки сосуда при язвенной болезни желудка, воспалении (особенно гнойном), некрозе тканей (например, при казеозном некрозе в стенке туберкулезной каверны), при изъязвлении раковой опухоли или ее распаде;
повышение проницаемости стенки сосуда, сопровождающееся диапедезом эритроцитов (diapedesis, от греч. dia – через и pedао – скачу). Эритроциты проходят через сосудистую стенку в местах контакта эндотелиоцитов. Важными факторами в развитии диапедезных кровотечений (haemorrhagia per diapedesin) являются наследственные заболевания крови, такие как геморрагические диатезы, когда возникает спонтанное кровотечение в ответ на незначительное повреждение. Такое состояние может быть обусловлено количественными или качественными изменениями тромбоцитов, недостаточностью одного или более факторов коагуляции, патологической ломкостью или повышенной проницаемостью сосудистой стенки. Кроме того, при ДВС-синд- роме наблюдается выраженный геморрагический синдром, являющийся следствием коагулопатии потребления.
Следствием наружного кровотечения являются кровопотеря и развитие анемии либо гиповолемического шока; внутреннее кровотечение заканчивается кровоизлиянием.
Различают также артериальные, венозные и капиллярные (паренхиматозные) кровотечения. Артериальное кровотечение чаще всего бывает острым, иногда мгновенным, если разрывается аорта, сонная артерия. Кровотечение может быть и хроническим, если оно продолжается длительно или возникает периодически (геморрагические диатезы).
С учетом степени кровопотери выделяют малую кровопотерю – до 10% ОЦК (7–10 мл/кг); умеренную – до 25% (15–25 мл/кг); массивную –
30–45% (20–30 мл/кг) и смертельную – 50–60% (40–60 мл/кг).
75
Кроме того, при ранении сосудов выделяют первичные и вторичные кровотечения. Первичное кровотечение происходит в момент ранения; вторичное – спустя определенный период времени в связи с нагноением тромба, которым был закрыт дефект сосуда.
2.2.2. Кровоизлияние
Различают следующие виды кровоизлияний: гематома, кровоизлияния в полости, геморрагическое пропитывание.
Гематома – скопление свернувшейся крови в тканях с нарушением их целостности и возможным образованием полости. Размеры гематомы различны и зависят от калибра поврежденного сосуда, уровня артериального давления, плотности окружающей ткани. Например, гематома в забрюшинной клетчатке может содержать до двух литров крови, а в ткани головного мозга гораздо меньше.
По периферии гематомы, где происходит свертывание крови, возникает организация свертка – осумкованная, или кистозная, гематома.
Кровоизлияния в различные полости и скопление крови в них называют гемотораксом (грудная полость), гемоперикардом (полость пери-
карда), гемоперитонеумом (брюшная полость), гемартрозом (полость сустава).
Геморрагическое пропитывание – кровоизлияние при сохранении целостности тканевых элементов. Оно может быть в виде скопления эритроцитов вокруг сосуда, так называемые точечные кровоизлияния – петехии (от итал. petechia – пятнышко) и более крупные – экхимозы (от греч. ehymos – сок). Выраженные мелкие точечные кровоизлияния называют пурпурой (например, purpurа cutis, cerebry – пурпура кожи, мозга).
Исходы кровотечений различны:
излившаяся кровь вызывает сдавление ткани, нарушает доставку субстратов, что приводит к гибели клеток и нарушению функции органа. Например, сдавление сердца и крупных сосудов при разрыве сердца и кровотечении в полость перикарда (тампонада полости перикарда приводит к остановке сердца). Свежее кровоизлияние состоит из обычной крови, старое же кровоизлияние представляет собой гемолизированную кровь, частично рассосавшуюся;
потеря крови приводит к гиповолемии, т.е. уменьшению объема циркулирующей жидкости, и анемии; уменьшение венозного возврата обусловливает падение ударного объема крови и последующее уменьшение артериального давления, в результате чего снижается перфузия тканей кровью и развивается шок;
76
уменьшение числа эритроцитов и их разведение вследствие компенсаторного выхода жидкости из тканей в сосуды, что вызывает анемию и последующую гемическую гипоксию, приводящую к альтерации и нарушению функции органов (печень, сердце, мозг, почки);
прекращениекровотеченияврезультатеповышениясвертываемостикровиитромбообразованиявместеповреждениясосудаинормализация объема циркулирующей жидкости;
рассасывание крови с образованием кисты, содержащей жидкость багрового цвета – «ржавая» киста. Бурый цвет обусловлен накоплением пигмента гемосидерина, содержащегося в цитоплазме макрофагов;
возможнаорганизация гематомыи образованиенаееместесоединительной ткани;
присоединение инфекции и нагноение кровоизлияния.
2.2.3. Плазморрагия
Плазморрагия – выход плазмы из кровеносного русла. По своей сути это одно из проявлений повышенной сосудистой проницаемости. Следствием плазморрагии является пропитывание плазмой стенки сосуда и окружающих тканей – плазматическое пропитывание.
При микроскопическом исследовании стенка сосуда вследствие плазматического пропитывания выглядит утолщенной, гомогенной. При крайней степени плазморрагии возникает фибриноидный некроз.
Патогенез плазморрагии и плазматического пропитывания определяется двумя основными условиями: повреждением сосудов микроциркуляторного русла и изменением констант крови.
Повреждение микрососудов обусловлено чаще всего нервно-сосу- дистыми изменениями (спазм, тканевая гипоксия), иммунопатологическими реакциями, действием инфекционных агентов. Кроме того, следует отметить, что даже в норме различные органы отличаются между собой по степени сосудистой проницаемости, что следует учитывать в оценке скорости и степени выраженности плазморрагии. Так печень, селезенка, костный мозг относятся к органам с относительно высокой сосудистой проницаемостью; сердце, легкие, головной мозг – к органам с низкой сосудистой проницаемостью.
Изменения крови, способствующие плазморрагии, сводятся к увеличению содержания в плазме веществ, вызывающих спазм сосудов (гистамин, серотонин), естественных антикоагулянтов (гепарин, фибринолизин), грубодисперсных белков, липопротеидов, появлению иммунных комплексов, нарушению реологических свойств.
77
Наиболее часто плазморрагия встречается при артериальной гипертензии, атеросклерозе, декомпенсированных пороках сердца, инфекционных, инфекционно-аллергических и аутоиммунных заболеваниях.
В исходе плазморрагии и плазматического пропитывания обычно развиваются фибриноидный некроз и гиалиноз сосудов.
2.3. Нарушения течения (реологических свойств) и состояния крови
2.3.1. Ñòàç
Стаз (от лат. stasis – остановка) – резкое замедление и остановка тока крови в сосудах микроциркуляторного русла.
Причиной развития стаза являются нарушения циркуляции крови, возникающие при действии физических (высокая и низкая температура) и химических (токсины) факторов, при инфекционных, инфекци- онно-аллергических и аутоиммунных заболеваниях, болезнях сердца и сосудов.
Механизм развития стаза. В его возникновении большое значение имеют изменения реологических свойств крови, обусловленные развитием сладж-феномена (от англ. sladge – тина), для которого характерно прилипание друг к другу эритроцитов, лейкоцитов или тромбоцитов и нарастание вязкости плазмы, что приводит к затруднению перфузии крови через сосуды микроциркуляторного русла.
Развитию интракапиллярной агрегации эритроцитов способствуют следующие факторы: изменения капилляров, ведущие к повышению их проницаемости и плазморрагии; нарушение физико-химических свойств эритроцитов; изменение вязкости крови за счет грубодисперсных фракций белков; нарушения циркуляции крови (застойный стаз, ишемический стаз и др.).
Стаз – явление обратимое, однако, длительный стаз ведет к необратимым гипоксическим изменениям – некробиозу и некрозу.
2.3.2. Тромбоз
Тромбоз (от греч. trombosis – свертывание) – прижизненное свертывание крови в просвете сосуда или в полостях сердца. Образующийся при этом сверток крови называют тромбом. Хотя тромбоз представляет собой один из важнейших механизмов гемостаза, он может стать причиной нарушения кровоснабжения органов и тканей с развитием инфарктов и гангрены.
78
Нормальное кровообращение и реологические свойства крови поддерживаются системой регуляции, обеспечивающей жидкое состояние крови, влияющей на проницаемость стенки сосудов и предотвращающей выход элементов плазмы в интерстиций.
Нарушение регуляции гемостаза, т.е. сбалансированного взаимодействия четырех систем (коагуляции, фибринолиза, структуры эндотелия и тромбоцитов), приводит к прижизненной патологической коагуляции крови в просвете кровеносного сосуда.
Причины, приводящие к развитию тромбов в артериальном и венозном кровеносном русле, достаточно разнообразны. Немецкий патолог Р. Вирхов еще в XIX в. выделил три группы причин тромбообразования (триада Вирхова):
повреждение структуры и нарушение функции эндотелия; замедление и изменение направления (завихрения) кровотока; изменение состава крови.
В нормальных неповрежденных сосудах эндотелий обладает свойствами атромбогенности, т.е. к нему не прилипают тромбоциты. Кроме того, эндотелий играет роль механического барьера между кровью и тромбогенной субэндотелиальной выстилкой. Эндотелий продуцирует также ряд антитромбогенных факторов, основным из которых является поверхностный белок тромбомодулин, связывающий тромбин, последний инактивируется протеином С плазмы.
Выделяя ингибитор аденозиндифосфата (АДФ) и простациклина, эндотелий тормозит агрегацию тромбоцитов и усиливает фибринолиз за счет продукции активаторов плазмина. Все это обеспечивает скольжение крови по эндотелию, покрывающему базальную мембрану сосудов. В то же время в эндотелии синтезируются вещества, усиливающие адгезию и агрегацию тромбоцитов, так называемые тромбические вещества. К ним относятся фактор Виллебрандта и фактор активации тромбоцитов, а также фибронектин, обеспечивающий адгезию. Однако следует отметить, что на поверхности нормального эндотелия преобладают антикоагуляционные механизмы, а тромботическая активность минимальна. Поэтому при повреждении эндотелия нарушается баланс между тромбогенными и антитромбогенными факторами, что в конечном итоге и ведет к образованию тромба.
Тромбообразование складывается из четырех последовательных стадий: 1) агглютинация тромбоцитов; 2) коагуляция фибриногена и образование фибрина (рис. 27 на цв. вкл.); 3) агглютинация эритроцитов; 4) преципитация белков плазмы.
Морфологическая характеристика тромба. В зависимости от внешнего вида и морфогенеза выделяют четыре основных вида тром-
79
