
Zabolevania_parodonta_-_Danilevsky_N_F
.pdf
Рис. 116. Рентгенограмма, обработанная при помощи компьютера
Рис. 117. ЭхоостеометрЭОМ-01ц
пленке, так и с помошью специальных датчиков, а также в десятки или даже сотни раз уменьшить лучевую нагрузку (дозу облучения), которой подвергает ся пациент при проведении рентгенографического исследования. В дальней шем изображение обрабатывают с помошью специальной программы в ком пьютере и выводят на экран монитора. С помошью компьютера рентгеновское
7* |
99 |
изображение может быть тщательно проанализировано, его можно увеличить, выделив любой нужный участок. При необходимости изображению можно придать объемность, изменить цвет, провести цифровой анализ плотности изображения и т.п. (рис.116). Полученные данные заносятся компьютером в историю больного и могут храниться неограниченно долго, что очень удобно при следующих посещениях пациента и позволяет объективно проследить ди намику патологического процесса.
Электрорентгенография дает возможность получить на обычной бумаге рентгеновское изображение исследуемого объекта. Для этого с помощью спе циального приспособления к рентгеновскому аппарату получают скрытое изо бражение исследуемого объекта на электрически заряженной пластинке. Рент геновское излучение во время экспозиции разрушает заряд пластинки в зависи мости от степени плотности структуры объекта. В результате получается скрытое электростатическое изображение, которое после опыления специаль ным порошком проявляется и переносится на бумагу. На электрорентгенограм ме остается контрастное изображение структуры кости и мягких тканей, что представляет определенную ценность для клиники и экономически выгодно.
Эхоостеометрия позволяет количественно оценить состояние костной ткани челюстей при помощи эхоостеометра ЭОМ-01ц. Передающие и прини мающие эхосигналы датчики для лучшего контакта предварительно смазывают вазелином и плотно прижимают к слизистой оболочке или коже в области ис следуемого участка кости. При заболеваниях пародонта наблюдается увеличе ние времени распространения ультразвуковой волны, что и регистрируется аппаратом. Данный метод можно использовать для дополнения рентгенологи ческого исследования, при массовых обследованиях организованных контингентов населения он может заменить рентгенографию (рис. 117).
ЛАБОРАТОРНЫЕ МЕТОДЫ ДИАГНОСТИКИ
ЦИТОЛОГИЧЕСКИЕ МЕТОДЫ
Цитологический метод используют для исследования содержимого пародонтальных карманов и других очагов поражения пародонта. Содержимое изу чают по методике П.М.Покровской и М.С.Макаровой (1942) в модификации И.А.Бенюмовой (1962). Пародонтальные карманы предварительно промывают изотоническим раствором хлорида натрия, стерильной иглой с турундой про изводят забор материала и переносят его на предметное стекло. Препарат фик сируют смерью Никифорова и окрашивают по Граму и Гимзе—Романовскому.
Микроскопически изучают клеточный состав экссудата, оценка которого позволяет получить представление о защитной реакции тканей пародонта (на личие или отсутствие фагоцитоза, незавершенный фагоцитоз). Определяют качественное состояние и количество нейтрофилов, стадию их дистрофии. Обращают внимание на состояние других клеточных элементов: лимфоцитов, полибластов, эпителиальных и плазматических клеток.
100
Эксфолиативная цитология позволяет вести динамические наблюде ния за течением заболевания, так как степень кератинизаиии слизистой оболочки характеризует ее барьерную функцию. Материал для цитологическо го исследования берут с поверхности межзубных сосочков при помоши рези новых полосок или кубиков и переносят на предметное стекло. Окраска маз ков-отпечатков определяется целью исследования. Для общего обзора мазки окрашивают по методу Романовского—Гимзы. Под микроскопом с помощью иммерсионной системы изучают качественный и количественный состав кле точных элементов крови, эпителиальных клеток. Гистохимические методы исследования позволяют уточнить состояние различных видов обмена веществ в клетках. Для определения индекса кератинизаиии подсчитывают общее количество эпителиальных клеток в поле зрения микроскопа, затем число обнаруженных ороговевших клеток умножают на 100 и делят на общее количе ство. Иногда индекс кератинизаиии высчитывают отдельно для слизистой обо лочки каждой челюсти. Уменьшение степени кератинизаиии свидетельствует о снижении защитной функции.
Ротовая цитодиагностика основана на данных о циклических измене ниях многослойного плоского эпителия полости рта синхронно с менструаль ным циклом. Материал для исследования берут со слизистой оболочки щеки выше линии смыкания зубов — это место, благодаря минимальному травмиро ванию, наиболее удачное для такого исследования. Различают четыре степени эстрогенной насыщенности (М.Г.Синица, 1992):
I степень — резкая недостаточность эстрогенов (в мазках обнаруживают атрофические клетки);
II степень — средняя степень дефицита эстрогенов (мазки состоят преиму щественно из парабазальных клеток с крупными ядрами);
III степень — умеренное снижение эстрогенов. В мазках встречаются про межуточные клетки с ядрами средней величины, единичные парабазальные и поверхностные клетки;
IV степень характерна для хорошей эстрогенной насыщенности (в мазках преобладают поверхностные клетки). Достоверное заключение о функцио нальной активности яичников можно получить при биохимических исследо ваниях гормонального статуса.
Реакция адсорбции микроорганизмов - РАМ (Н.ФДанилевский, А.П.Самойлов, Т.А.Беленчук, 1985; Т.А.Беленчук, 1985) клетками эпителия слизистой оболочки рта может быть применена для комплексного обследова ния больных, определения эффективности предпринятых лечебных меропри ятий, при заболеваниях пародонта и слизистой оболочки полости рта (рис. 118). Путем соскоба берут мазок со здорового участка слизистой оболоч ки альвеолярной части десны и окрашивают по Романовскому, Лейшману или Паппенгейму. В окрашенных мазках изучают взаимоотношение микрофлоры полости рта с эпителиальными клетками слизистой оболочки. Флора полости рта в основном представлена кокками. Подсчитывают количество кокков, адсорбированных на поверхности эпителиальных клеток, и последние делят на 4 группы:
101

Рис. 118. Реакция адсорбции микроорганизмов (РАМ) эпителиальными клетками разных групп, х 200:
I - 1-й группы; 2 - 4-й группы; 3 - 2-й группы: 4 - 3-й группы
1) эпителиальные клетки, на поверхности которых нет адсорбированных микроорганизмов или встречаются единичные кокки;
2)адсорбция эпителиальной клеткой от 5 до 25 кокков;
3)эпителиальные клетки, имеющие на своей поверхности 26—50 кокков;
4)адсорбция 51 и более кокков на поверхности клеток типа муравейника. Расчет производится на 100 эпителиальных клетках. Клетки 1-й и 2-й групп
относят к группе клеток с отрицательной РАМ, 3—4-й — с положительной РАМ. При микроскопии в каждом мазке выводят процент клеток с положи тельной и отрицательной РАМ. По проценту положительной РАМ судят о не специфической резистентности организма: при РАМ 70% и выше функцио нальное состояние организма хорошее, 31—69% — удовлетворительное, 30% и ниже — неудовлетворительное.
Метод последовательных полосканий - миграция лейкоцитов
вполость рта (М.А.Ясиновский, 1931) позволяет судить о защитных реак циях тканей пародонта, степени фагоцитоза, характере воспалительной реак ции. Подсчитывают количество мигрировавших в полость рта лейкоцитов
вединице объема смывной жидкости. Для полоскания рта используют 10 мл изотонического раствора хлорида натрия. Длительность полоскания - 30 с. Промежутки между полосканиями 5 мин. Первые 3 порции выплевывают, 3 следующие собирают в пробирки для исследования. Пробирки закрывают,
102
взбалтывают содержимое. Пипеткой отмеряют 1 мл смыва, переносят в другую пробирку, делают разведение в 9 раз. Тщательно взбалтывают, подкрашивают 1 % водным раствором трипанового синего и 1 % водным раствором конго крас ного (по 1 капле). Пипеткой заполняют камеру для подсчета. Через 5—10 мин после оседания лейкоцитов проводят подсчет в 30 полях зрения. Камера пред ставляет собой предметное стекло, на которое наклеено второе толщиной 1 мм с отверстием в центре. Для работы используют окуляр с ограниченным полем зрения, равным 45 квадратикам по камере Горяева.
Подсчитывают в 10 полях зрения количество живых, мертвых лейкоцитов
иклеток плоского эпителия. Затем производят расчеты:
1)среднее число лейкоцитов в 1 поле зрения (живых и мертвых отдельно)
иклеток плоского эпителия;
2)среднее число лейкоцитов в 1 поле зрения (живых и мертвых отдельно)
иклеток плоского эпителия умножают на 400 и на разведение и делят на 45. Полученное число показывает количество мигрировавших лейкоцитов в 1 мл смывной жидкости по Ясиновскому.
Для суждения о качественном составе клеточных элементов смыва готовят мазки из осадка, которые фиксируют в этиловом спирте и окрашивают по Ро мановскому—Гимзе. Затем в мазках проводят дифференцированный подсчет
относительного количества неизмененных нейтрофилов и находящихся в стадии дистрофии. Учитывают количество фагоцитов и лимфоцитов. Диффе ренцируют эпителиальные клетки по степени зрелости. Определяют количест во ороговевших, промежуточных и парабазальных клеток. Степень ороговения устанавливают по клеточной морфологии в дополнение к реакциям окрашива ния. Всего подсчитывают 100 клеток и выводят их процентное содержание. В норме 80% мигрировавших в полость рта жизнеспособных лейкоцитов со храняют подвижность и функцию фагоцитоза в течение 2,5 ч. По интенсивно сти миграции лейкоцитов и десквамаиии можно судить о реактивности слизи стой оболочки рта, степени тяжести патологического процесса.
Этот метод объективно оценивает результаты различных способов лечения заболеваний пародонта.
Гемограмма — совокупность качественного и количественного исследо вания крови. Для подсчета гемограммы мазки готовят по обычной методике. В морфологической картине периферической крови определяют отклонения от нормы: уменьшение числа эритроцитов, снижение уровня гемоглобина, сдвиг лейкоцитарной формулы, увеличение СОЭ и др.
Моноцитограмма (О.П.Григорова, 1958) — это тест функционального состояния активности мезенхимы, который определяют путем дифференциро ванного подсчета и определения процентного соотношения различных форм (юных и старых) моноцитов в периферической крови. В норме процентное соотношение различных групп моноцитов следующее: промоноцитов 20-23%, собственно моноцитов 26—32%, полиморфноядерных 42—62%, полинуклеаров0,1%.
103

МИКРОБИОЛОГИЧЕСКИЕ МЕТОДЫ
Микробиологическое исследование позволяет установить состав микро флоры в поверхностной и глубоких зонах пародонтального кармана, провести дифференциацию ее, что важно для диагностики и дальнейшего выбора меди каментозных средств лечения. Забор материала и окраска его для микробиоло гического исследования такие же, как для цитологического (рис.119).
Для определения микробного числа используют промывную жидкость (первые две порции), собранную для исследования интенсивности миграции лейкоцитов и десквамации эпителия. Готовят 6 разведений исследуемой жидкости: 10, 102, 103, 104, 105, 106. Из 4 последних разведений берут по 1 мл для
Рис. 119. Микрофлора пародонтальных карманов, х 90:
А — кокки; Б — простейшие; В — грибы; Г - фузобактерии и спирохеты
104
посева на агаре и выращивания в термостате при температуре 37 "С в течение 24—36 ч. Затем производят подсчет абсолютного числа микробных тел в 1 мл промывной жидкости.
Показатель обсемененности пародонтального кармана микроорганизмами отражает характер течения дистрофически-воспалительного процесса и эф фективность лечения. Забор материала производят стерильной ватной турундой на глубине 2 мм. Затем концевую часть турунды промывают 10 мл изото нического раствора хлорида натрия и получают взвесь микроорганизмов. По сев культуры проводят в чашке Петри на мясопептонный агар, добавляя 1 мл взвеси культуры микроорганизмов, разведенной в 100 раз, затем помешают в термостат при температуре 37 °С на 48 ч, после чего подсчитывают количест во колоний на поверхности и в толше агара.
У больных с хроническим и обострившимся течением заболеваний пародонта эти показатели коррелируют с характером течения: при хроническом они составляют до лечения примерно 36 колоний на 1 см2 поверхности агара; при обострившемся течении — в 10 раз больше. После проведенного курса ле чения их содержание не превышает 1—2 колоний на 1 см2.
Исследование десневой жидкости цитологическими, гистохимическими, микробиологическими, иммунологическими методами способствует уточне нию диагноза и динамическому контролю за эффективностью проводимого лечения. Ее собирают с помощью трубочек или фильтровальной бумаги, кото рую продвигают под десну на 1 мм и держат 3—5 мин. Материал для цитологи ческого или микробиологического исследования берут с помощью платиновой петли и переносят на предметное стекло или питательную среду. Благодаря им мунологическим свойствам и фагоцитарной активности клеточных элементов десневая жидкость составляет важную часть зашитного механизма тканей пародонта. В десневой жидкости могут быть обнаружены клетки эпителия борозды, бактерии, лейкоциты, лимфоциты, моноциты, тканевые базофилы, электролиты, глюкоза, мочевина, бактериальные эндотоксины, ферменты, иммунные тела и др.
БИОХИМИЧЕСКИЕ И ИММУНОЛОГИЧЕСКИЕ МЕТОДЫ
Биохимические методы. Для ранней диагностики болезней пародонта в последние годы используют определение в сыворотке крови и слюне содер жания нейраминовой кислоты, фукозы, оксипролина в моче, содержание фер ментов и их ингибиторов в сыворотке крови и слюне. Сравнительная оценка этих цифровых показателей до и после лечения рассматривается как тест эффективности лечения.
Содержание витамина £в крови в определенной мере отражает содержание токоферола в организме. Его определение показано у подростков при физио логическом и особенно патологическом половом созревании. Концентрация токоферола при генерализованном пародонтите у подростков при физиологи ческом половом созревании (Н.Ф.Данилевский, Г.Н.Вишняк, А.М.Политун, 1981) составляет 0,67 мг% + 0,01 мг%, что по сравнению с контрольными данными (0,89 мг% + 0,05 мг%) свидетельствует о его дефиците.
105
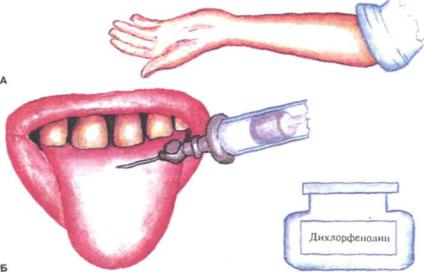
Рис. 120. Определение насыщенности тканей аскорбиновой кислотой:
А - внутрикожная проба; Б - языковая проба
Насыщение тканей аскорбиновой кислотой уменьшает проницаемость капилляров, стимулирует функциональную деятельность органов и тканей, оказывает положительное влияние на обмен коллагена и др. Для определения тканевой насыщенности витамином С на слизистую оболочку спинки языка инъекционной иглой наносят каплю индикатора (0,06% раствор натриевой со ли 2,6-дихлорфенолиндофенола), который восстанавливается аскорбиновой кислотой при комнатной температуре, - индикатор обесцвечивается. Время обесцвечивания раствора определяется в секундах. При анализе результатов языковой пробы следует учитывать сезонные колебания содержания в тканях аскорбиновой кислоты (рис.120).
Радиоизотопное исоїедование применяется для изучения обменных процес сов в тканях пародонта. Используются меченые вещества, активно участвую щие в метаболизме (24Na, 45Ca, 3 2 Р и др.), что позволяет диагностировать ранние патологические нарушения в тканях пародонта и оценить эффектив ность различных методов лечения.
Иммунологические методы. Неспеиифическая резистентность ор ганизма снижается соответственно степени тяжести патологического про цесса в пародонте: угнетена функциональная активность соединительной тка ни, снижены титр лизоиима, фагоцитарная активность лейкоцитов, ком плементарная активность сыворотки крови, активность макрофагов; повы шена повреждаемость нейтрофилов, высокие показатели лейкергии или реакции агломерации лейкоцитов (РАЛ). При заболеваниях пародонта уве личивается титр противодесневых аутоантител, количество тканевых базофилов, повышается митотическая активность клеточных элементов меж-
106
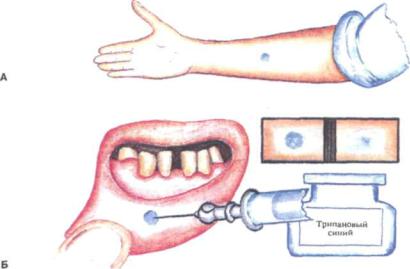
Рис. 121 . Проба Кавецкого:
А - внутрикожная проба; Б - внутрислиэистая проба
альвеолярных сосочков и др. Неспецифическими тестами аллергологического статуса организма являются также эозинофилия в периферической крови и тканях патологического очага десны, тромбопения, лейкопения, агранулоцитоз, изменение протеинограммы, реакция адсорбции микро организмов.
Кожная проба по Р.Е.Кавецкому в модификации С.М.Базарновой помогает определить функциональное состояние соединительной ткани. Проба основа на на способности ткани задерживать индифферентные красители. В слизис тую оболочку нижней губы вводят 0,1 мл 0,25% раствора трипанового синего. О распространении краски судят по размеру пятна. Его диаметр измеряют сразу после инъекции и спустя 3 ч. Отношение квадрата радиуса пятна в мо мент введения краски к квадрату его радиуса через 3 ч является коэффициен том пробы. В норме он равен от 5 до 7. Значение ниже 5 свидетельствует об угнетении, выше — об активности функционального состояния системы соединительной ткани организма.
При внутрикожном введении указанного раствора в количестве 0,2 мл коэффициент вычисляют как отношение квадрата радиуса пятна через 24 ч после инъекции краски к квадрату радиуса сразу же после введения краски. При патологии пародонта наблюдается угнетение функционального состояния системы соединительной ткани (рис. 121).
Определение уровня лизоцима в аіюне (метод Лоури) основан на способности лизоиима слюны расщеплять полисахариды клеточной оболочки бактерий. Активность фермента определяется нефелометрически по изменению мутности суспензии Micrococcus lysodectius и выражается в микрограммах
107
кристаллического лизоцима на 1 мг белка за 30 мин инкубации при температу ре 37 °С; также определяют его содержание в 1 мл слюны.
Фагоцитарная активность лейкоцитов характеризует неспецифическую резистентность организма. Двухмиллиардную взвесь убитой нагреванием су точной культуры стафилококка (штамм 209) смешивают с 0,1 мл цитратной крови больного. Смесь инкубируют в термостате при температуре 37° С в тече ние 30 мин и 2 ч, затем готовят мазки, подсчитывают число клеток, поглотив ших микроорганизмы, — фагоцитарный индекс (ФИ).
МОРФОЛОГИЧЕСКИЕ МЕТОДЫ
Биопсию проводят в случаях, если затруднена дифференциальная диагнос тика заболеваний пародонта (болезни крови, злокачественные новообразова ния и др.). Иссеченные участки пораженных тканей подвергают гистологичес кому исследованию. Под проводниковой или инфильтрационной анестезией с помощью ножниц, скальпеля или специальных инструментов иссекают участок пораженной ткани. Материал для исследования по возможности сле дует брать с пограничного участка между видимо здоровой и патологической тканью. Кусочек ткани размером 3-5 мм берут с подслизистой основой и под лежащими тканями, рану ушивают (рис. 122). Биопсийный материал помеша ют в пробирку с фиксирующим раствором и направляют в патологоанатомическое отделение для исследования. В сопроводительном направлении указыва ют краткие анамнестические данные, данные объективного исследования и предполагаемый диагноз.
Морфологические изменения при болезнях пародонта разнообразны и вы являются во всех тканях пародонта. Преимущественно наблюдаются дистро фически-воспалительные и воспалительные процессы. При гингивите преоб ладают воспалительные изменения, при пародонтите — дистрофически-воспа лительные, а при пародонтозе - дистрофические. При воспалительных про цессах превалируют гиперемия, отек, лейкоцитарная или мелкоклеточная лимфоидная инфильтрация, накопление размножающихся соединительно тканных клеток, преимущественно лимфоцитов, фибробластов, плазматичес
ких клеток, и формирование зрелой соединительной ткани, макрофагальная или остеокластическая резорб ция альвеолярной кости.
|
Дистрофические |
изменения |
|
в эпителии проявляются нарушением |
|
|
ороговения, вакуольной и баллони- |
|
|
руюшей дистрофией клеток. В соеди |
|
|
нительной ткани и сосудах наблюда |
|
|
ются мукоидное набухание, фибри- |
|
|
ноидные изменения, фрагментация |
|
Рис. 122. Инструмент для забора био- |
и глыбчато-зернистый распад воло- |
|
кон, гиалиноз и склероз, в костной |
||
птатов слизистой оболочки |
ткани — остеопороз и остеосклероз. |
|
