
Монография. Производственные аптеки (изготовление лекарственных препаратов в США, Европе)
.pdf
снижения негативного влияния токсичных препаратов и управлять качеством восстановленного (разведенного) ЛП, для чего оборудуется комплекс выделенных помещений в медицинской организации и создаются контролируемые условия восстановления (разведения) и маркировки ЛП, которые осуществляет обученный персонал.
Так, например, противоопухолевые лекарственные препараты являются неотъемлемым элементом оказания онкологической помощи и применяются в различных схемах лекарственной терапии пациентов. Такого вида ЛП являются токсичными и большинство из них вводятся внутривенно в виде растворов, приготовленных ex tempore. При этом контакт слизистых или кожных покровов, или попадание даже незначительных количеств цитостатических препаратов в организм представляют опасность для сотрудников, которые участвуют в их приготовлении. Второй особенностью большинства противоопухолевых ЛП является необходимость точного индивидуального дозирования в соответствии с площадью поверхности тела, весом или на основании индивидуальных особенностей метаболизма. Вследствие этого большинство таких препаратов регистрируются и поставляются в медицинские организации в форме лиофилизированных порошков или концентрированных растворов, которые необходимо дозировать и переводить в форму инъекционного или инфузионного раствора перед введением в организм пациента посредством восстановления (разведения). В соответствии с исследованием, результаты которого представлены в British Medical Journal [204], страховые компании США теряют порядка 2 млрд долл. ежегодно, оплачивая лекарственную терапию для онкологических пациентов и закупаемую в виде готовых лекарственных форм (флаконах), в связи с тем, что использование препаратов не осуществляется в полном объеме. В исследовании рассчитывается количество остатков лекарственного препарата, отправляемое на утилизацию, при этом, в зависимости от ЛП, доля неиспользуемых остатков составляет более 10%.
Одним из важнейших эффектов централизации является снижение количества неиспользуемых остатков лекарственных препаратов, и, как следствие, экономия затрат на лекарственную терапию. Экономия возникает благодаря тому, что при децентрализованном разведении в каждом отдельно взятом отделении ежедневная потребность в препаратах ниже, по сравнению с суммарной потреб-
111

ностью всех отделений. Нередки случаи, когда на одного пациента осуществляется разведение целого флакона с препаратом, при этом существенная часть препарата утилизируется, так как пациенту требуется только часть, но после вскрытия первичной упаковки и восстановления срок хранения готового раствора составляет менее суток, что, как правило, отражено в инструкции по медицинскому применению. Объединение потребности нескольких пациентов позволяет сократить неиспользуемые остатки и количество вскрываемых флаконов, обеспечивая экономию. Тем не менее при наличии внушительных успехов по оптимизации затрат, часть ЛП подлежит утилизации. Например, если запланирована химиотерапия для трех пациентов с суммарной потребностью в действующем веществе в размере 134 мг (48+42+44), утилизируется 16 мг.
Практика централизованного разведения ЛП широко распространена во всем мире, в том числе в странах СНГ [205, 206]. В качестве одного из самых значимых примеров в Российской Федерации можно привести сведения об эффективности организации процесса централизованного разведения, реализованного государственным бюджетным учреждением здравоохранения «Санкт-Петербургский клинический научно-практический центр специализированных видов медицинской помощи (онкологический)» (далее — ГБУЗ «СПБ КНПЦСВМП(о)»). Медицинской организации удалось за 3 года достичь существенной экономии затрат на лекарственную терапию
вразмере более 300 млн рублей [207].
Врамках научно-практического сотрудничества между ФГБОУ ВО СПХФУ Минздрава России и ГБУЗ «СПБ КНПЦСВМП(о)» проанализирована деятельность отдела централизованного разведения противоопухолевых лекарственных препаратов (далее — ОЦРПП). Проведено изучение подходов к организации и документальному оформлению процессов, осуществлен анализ базы данных выполненных разведений противоопухолевых ЛП, рассчитан экономический эффект от централизации. Объемы реализации готовых лекарственных форм на территории Российской Федерации получены из базы данных DSM Group.
В2020 году, вследствие пандемии новой коронавирусной инфекции, общее число проведенных восстановлений уменьшилось на 13% относительно 2019 года — до 34,3 тысяч. Масса ЛП в пересчете на вес фармацевтической субстанции, которая требовалась для осуществления процесса восстановления (разведения), снизи-
112

лась на 12,6%. За 8 месяцев 2021 года объем и число разведений показали положительную динамику относительно аналогичного периода 2020 года, приблизившись к доковидному уровню. В суммарной потребности клинических отделений на протяжении 4 лет выделялась потребность трех: «Дневной стационар с койками для химиотерапии» с долей 40% от всего количества разведений
в2020 году, «Отделение солидных опухолей» с долей 23%, «Отделение биотерапии» с долей 22%, доля прочих 14 отделений составили 15% спроса. В медицинской организации большая часть восстановлений для несовершеннолетних пациентов осуществляется непосредственно в «Детском отделении», однако часть разведений проводится в ОЦРПП, с долей около 2% в 2020 году. По итогам 8 месяцев 2021 года топ-3 отделения ГБУЗ «СПБ КНПЦСВМП(о)» увеличили спрос относительно аналогичного периода в 2020 году на 15–20%. Число новых пациентов в 2019 году увеличилось относительно 2018 года на 35% — до 18,3 тысяч человек, в 2020 году пациентопоток снизился на 13%, в 2021 году началось восстановление к доковидному уровню. В исследуемом периоде осуществлено разведение для 60,2 тысяч пациентов, среди которых 69% — женского пола. Медиана возраста взрослых пациентов почти не изменилась за последние несколько лет: 59 лет в 2018 году и 60 лет в 2021 году. Медиана возраста несовершеннолетних пациентов составила 8 лет
в2021 году и варьировала несущественно. Из 26,3 тысяч разведений для различных нозологий по группам Международной классификации болезней (далее — МКБ) за 8 месяцев 2021 года топ-5 групп составляют более половины, наибольшую долю имеют злокачественные новообразования молочной железы — 24%. Структура топ-5 МКБ-групп относительно стабильна по годам.
Экономия от централизованного разведения была рассчитана на основании разницы между количеством флаконов ЛП, указанных врачами клинических отделений при назначении лекарственной терапии (это количество флаконов было бы израсходовано при осуществлении разведения децентрализованно в каждом отделении), и количеством фактически израсходованных флаконов препаратов в ОЦРПП. Эта разница умножалась на стоимость закупки флакона и суммировалась.
Сточки зрения затрат на лекарственную терапию, топ-5 международных непатентованных наименований (далее — МНН) составляют порядка 66% от общей стоимости ЛП. На наиболее затратное
113

МНН приходится 23%, экономия от централизованного разведения по данному МНН составляет 3,2% от стоимости. По итогам 2020 года стоимость сэкономленных за счет централизованного разведения препаратов составила 114,1 млн руб. Группа топ-5 МНН составляет порядка 80% всей экономии. За 8 месяцев 2021 года объем экономии составил 88 млн руб. с увеличением относительно аналогичного периода 2020 года на 7,2% прежде всего за счет общего увеличения числа разведений.
В результате проведенного исследования подтверждено, что централизация разведения противоопухолевых лекарственных препаратов позволяет обеспечить экономию в размере от 10% издержек на лекарственную терапию в медицинской организации ежегодно, относительно децентрализованного разведения, при сохранении объемов оказания медицинской помощи. В случае экстраполяции на потребность в ЛП исследуемой выборки всей России уровень экономии затрат, на который можно рассчитывать, в денежном выражении может составлять порядка 10,5 млрд руб. При оптимизации процессов возможно добиться даже большей экономии, для этого необходим непрерывный анализ потребности и осуществляемых разведений противоопухолевых ЛП в медицинской организации.
Централизация процесса разведения противоопухолевых ЛП является непосредственным способом достижения цели по рациональному использованию ЛП при сохранении объема государственных гарантий. Одним из ключевых факторов является возможность обеспечить повышенную безопасность персонала, так как в каждом отдельно взятом клиническом отделении сложнее поддерживать соблюдение необходимых требований асептики и гигиены. Тем не менее отмечается необходимость совершенствования материаль- но-технической базы, прежде всего в области инженерных систем, технологических решений и оснащении оборудованием, позволяющем повысить уровень контроля качества восстанавливаемых ЛП. В целом для деятельности ОЦРПП в РФ фактически отсутствует нормативная правовая база. На момент публикации монографии оборудование ОЦРПП регламентируется Приказом Министерства здравоохранения от 19 февраля 2021 г. № 116н (ред. от 24.01.2022) [208], где среди технологического оборудования предусмотрено наличие в МО, оказывающих медицинскую помощь по профилю «Онкология», ламинарной камеры для стерильного разведения ЛП в виде собственно ламинарного бокса или бокса биологической без-
114

опасности класса 2 класса, что существенно отличается от подходов к работе с высокоопасными ЛП в развитых системах здравоохранения в рамках учреждений здравоохранения, а также увеличивает риски токсического воздействия на медицинских и фармацевтических работников, о чем говорилось в подразделе 1.1.2 настоящей монографии [209, 210, 211].
Осуществление операций по восстановлению (разведению) ЛП предусмотрено инструкциями по медицинскому применению лекарственных препаратов, однако положениями Решения Коллегии ЕЭК от 10 мая 2018 г. № 69 (ред. от 30.06.2020) «Об утверждении Требований к исследованию стабильности лекарственных препаратов и фармацевтических субстанций» отмечается что в целях составления информации о применении, условиях хранения и периоде применения восстановленного или разведенного ЛП необходимо изучить его стабильность после восстановления или разведения [212, 213]. Проведение исследований и испытаний на стабильность необходимо проводить на первичных сериях восстановленного или разведенного ЛП на протяжении предлагаемого периода применения в рамках формализованных исследований в начальной и конечной временных точках и, если до начала регистрации данные долгосрочных исследований о полном сроке годности отсутствуют, на 12-м месяце или в последней временной точке, для которой будут доступны данные, что технически невозможно в условиях медицинской организации.
Внедрение практики централизованного разведения ЛП в деятельность МО требует создания нормативно-правового поля, регламентирующего организацию и ведение такой деятельности. Наиболее близким примером регулирования является Приказ Министерства здравоохранения РФ от 27 апреля 2015 г. № 211н [214], который утверждает порядок изготовления радиофармацетвических препаратов в медицинских организациях и впоследствии замененный Приказом Министерства здравоохранения РФ от 12 октября 2020 г. № 1218н (далее — Приказ № 1218н) [215]. Стоит отметить, что Приказ № 1218н напрямую ссылается на Приказ № 751н, регулирующий правила изготовления лекарственных препаратов в аптечных организациях. При этом в соответствии с действующей редакцией и вступающей в силу с 1 сентября 2023 года новой редакцией ч. 2 ст. 56 ФЗ-61 не допускается аптечными организациями изготовление лекарственных препаратов, зарегистрированных в Российской Федера-
115

ции, что очевидно приводит к правовой коллизии. Одновременно с этим в рамках Приказа № 751н деятельностью производственных аптек уже предусмотрено выполнение операций изготовления лекарственных препаратов из концентратов. Таким образом, в соответствии с нормативным регулированием, использование зарегистрированных лекарственных препаратов допускается в медицинской организации с учетом правил, регулирующих деятельность аптечных организаций (с правом на изготовление лекарственных препаратов), однако в аптечных организациях такая деятельность не напрямую, но ограничена.
Стоит отметить, что с точки зрения обеспечения качества и безопасности деятельности, любое качественное и количественное изменение состава ЛП, которое наблюдается при осуществлении процедур по восстановлению (разведению) ЛП, непосредственно относится к предмету фармацевтической деятельности, как и нарушение первичной упаковки ЛП при его отпуске по требованию медицинской организации — допускается аптечной организацией, имеющей лицензию на фармацевтическую деятельность с правом изготовления и отпуска лекарственных препаратов [216]. При отсутствии обязательных требований к санитарно-эпидемиологическим правилам, требованиям к помещениям, качеству восстановленного (разведенного) ЛП, в высокой степени могут отмечаться риски для здоровья сотрудников (токсичность активных веществ в составе ЛП) [217, 218]. Возможное снижение качества ЛП и потенциальные ошибки при маркировке каждого осуществляемого разведения могут наблюдаться в том числе в силу отсутствия необходимого инженерного, технологического, контрольно-аналитического оборудования и надлежащих компетенций персонала. Многочисленные исследования [219, 220] показывают высокие риски загрязнения противоопухолевыми ЛП на различных рабочих поверхностях при осуществлении восстановления (разведения) ЛП в МО. Возникновение данных рисков также установлено в ходе крупномасштабного исследования MASHA [221, 222], проведенного Европейским обществом онкологической фармации (англ. «The European Society of Oncology Pharmacy», ESOP). В исследовании подчеркивается, что деятельность производственных аптек позволяет нивелировать данные риски и повысить эффективность процессов обеспечения лекарственными препаратами в виду наличия необходимой квалификации и опыта обращении
116

сцитотоксическими ЛП фармацевтическими работниками, а также соблюдения требований надлежащих практик.
Учитывая уже существующий комплекс требований, систему лицензирования и надзора за деятельностью производственных аптек и медицинских организаций, необходимо дополнить основные нормативные акты РФ, которые конкретизируют правила работы
свысокоопасными ЛС для аптечных и медицинских организаций, а также определят границы процессов разведения (восстановления) зарегистрированных лекарственных препаратов, фасовки (переупаковки) ГЛФ и непосредственно деятельности по изготовлению ЛП.
Вслучае, если органами управления в сфере здравоохранения принимается решение о сохранении такого вида деятельности в МО, то подобные требования Приказа № 1218н необходимо разработать и внедрить для процесса разведения (восстановления) любого вида ЛП, положения которого должны предусматривать требования к помещениям и оборудованию, материальным и информационным потокам, санитарно-эпидемиологическим правилам и гигиеническим нормативам, требования к персоналу, порядкам изготовления и контроля качества, маркировке, упаковке и ведению документации.
Втаком контексте еще раз стоит подчеркнуть значимость фармацевтической службы, соответствие законодательству, квалификацию фармацевтических работников и персонала производственных аптек, которые способны обеспечить точность дозирования и отсутствие потерь, возникающих в результате разведения ГЛФ в рамках медицинской деятельности, обеспечить безопасность персонала и надлежащий контроль качества изготавливаемых ЭЛП, за счет внедрения передовых технологических решений и наличия необходимого современного оборудования. Развитие логистики лекарственных препаратов и современные требования, предъявляемые к АО, предоставляют возможность ежедневно обеспечивать МО готовыми для введения, персонифицированными инъекциями и инфузиями, а также любыми другими, необходимыми для клинической практики лекарственными формами. Кроме того, агрегация потребности нескольких медицинских организаций позволит еще больше сократить объем неиспользуемых остатков и увеличить экономию затрат бюджетов системы здравоохранения на региональном уровне субъекта РФ.
Всоответствии с указанными в подразделе исследованиями подтверждается, что затраты страховых компаний превышают за-
117

траты на фактически применяемый объем лекарственной терапии для онкологических пациентов, при закупках МО лекарственной терапии в неперсонализированных дозировках (флаконах), а не в соответствии с курсовыми назначениями. В самостоятельно проведенном исследовании наглядно показано и рассчитано количество неиспользуемых (утилизируемых) остатков ЛП.
Помимо вышесказанного, из-за высокой стоимости лекарственных препаратов онкологического профиля возникает риск их преднамеренного хищения [223, 224], однако для устранения таких факторов за последние годы запущена информационная система «Мониторинг движения лекарственных препаратов». В случае с ЭЛП, в частности, с жидкими лекарственными формами, изготовленные ЛП отпускаются в виде готовых для введения инфузионных и инъекционных растворов, персонифицированы по дозировке (предназначены для конкретного пациента с учетом его пола, возраста, массы и площади тела) и обладают ограниченным сроком годности, что полностью устраняет возможность их повторного введения в оборот.
1.7.Правила изготовления и отпуска лекарственных препаратов
вРоссийской Федерации
Одним из основных документов, требующих особого внимания, является Приказ № 751н, который на текущий момент не соответствует современным подходам развитых систем здравоохранения к организации изготовления и отпуска лекарственных препаратов и требует приведения в соответствие с современными подходами.
Постановлением Правительства РФ от 13 июня 2020 г. № 857 (ред. от 11.07.2020) [225] в рамках регуляторной гильотины были отменены четыре приказа Министерства здравоохранения РФ, регламентирующих деятельность производственных аптек. В оставшемся Приказе № 751н, с одной стороны, предпринята попытка собрать в один документ существовавшие ранее приказы, методические рекомендации и указания, касающиеся изготовления лекарственных препаратов в аптечных организациях, а с другой стороны, осталась без внимания существующая мировая практика и подходы к процессам аптечного изготовления, контроля качества, изучения стабильности и процедурам соответствия надлежащим практикам. На рис. 5 отражены основные этапы нормативного правового регулирования в РФ.
118
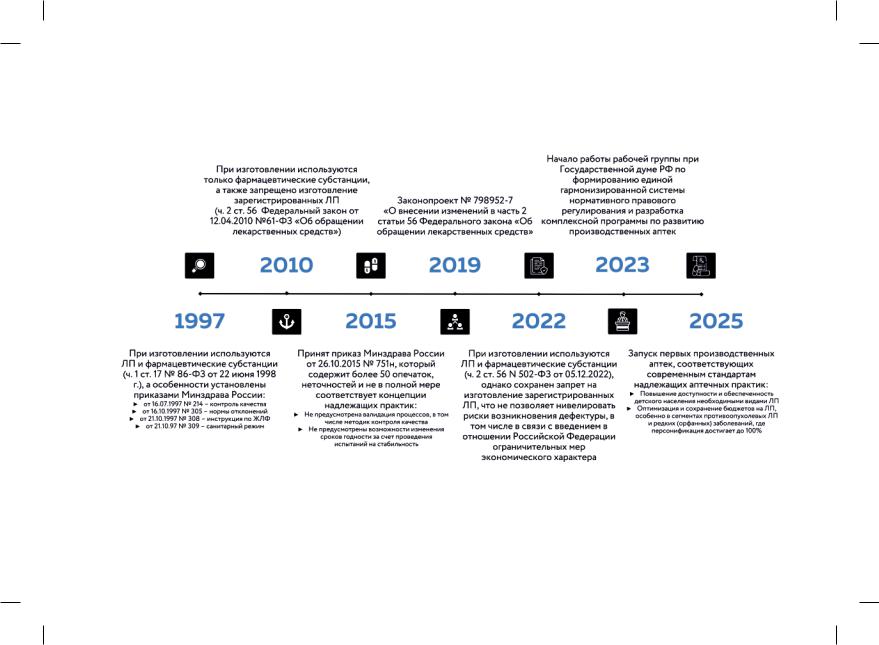
Рис. 5. Изменение регулирования аптечного изготовления лекарственных препаратов в РФ
119

Контент-анализ исследований [226, 227, 228], посвященных развитию системы обеспечения качества лекарственных средств
вСоюзе Советских Социалистических Республик (далее — СССР),
демонстрирует фокусировку на требованиях к выпускаемой продукции, а не на надлежащем процессе, что нашло свое отражение
врамках аптечного изготовления ЛП, где контроль качества ЭЛП также концентрировался на финальном продукте, а не на процессах обеспечения надлежащего качества на всех этапах.
Начиная с 1968 по 2015 год было введено пять приказов, описывающих контроль качества ЭЛП на территории СССР и РФ: приказ Министерства здравоохранения СССР от 29 октября 1968 г. № 768 [229], приказ Министерства здравоохранения СССР от 30 апреля 1985 г. № 582 [230], приказ Министерства здравоохранения СССР
от 3 апреля 1991 г. № 96 [231], Приказ № 214, Приказ № 751н. Динамика изменения показателей химического контроля качества изготавливаемых ЛП отражена в табл. 10 и табл. 11 (текст в таблицах приведен с оригинальной орфографией и пунктуацией указанных литературных источников), из которых следует, что за прошедшие более чем пятьдесят лет подходы к обеспечению качества экстемпоральных лекарственных препаратов не изменились.
Содержание Приказа № 751н на текущий момент не в полной мере позволяет развивать аптечное изготовление. В частности, содержатся: технологические ограничения; параметры морально устаревших подходов к обеспечению контроля качества изготавливаемых ЛП; консервативный подход к определению сроков годности изготавливаемых лекарственных препаратов; также содержится существенное количество синтаксических и лексических ошибок [232].
По тексту Приказа № 751 упоминаются ступки, бюреточные системы, смесители, измельчители, при этом отдельными пунктами устанавливаются требования по использовании в процессе изготовления или контроля качества исключительно вышеуказанного оборудования, что полностью нивелирует вариативность процессов аптечной технологии изготовления лекарственных препаратов, а также не позволяет осуществлять автоматизацию деятельности производственных аптек.
Так, например, в развитых системах здравоохранения при изготовлении ЛП используют: фармацевтические насосы [233], дозиру-
120
