
bkh_dlya_tebya
.pdf
Учебник для студентов медицинских учреждений, а также любознательных
БИОХИМИЯ.
ПОДРОБНО И ПРОСТО
Автор: Яковенко Никита Сергеевич
2019 год
1
Оглавление 1 |
|
Белки................................................................................................................................................ |
5 |
Классификация белков........................................................................................................................... |
6 |
Аминокислоты ........................................................................................................................................ |
7 |
Связи...................................................................................................................................................... |
10 |
Структура белка .................................................................................................................................... |
11 |
Физико-химические свойства белков................................................................................................. |
17 |
Ферменты ...................................................................................................................................... |
20 |
Строение ферментов............................................................................................................................ |
20 |
Активность ферментов......................................................................................................................... |
25 |
Витамины .............................................................................................................................................. |
26 |
Водорастворимые витамины: ............................................................................................................. |
27 |
Жирорастворимые витамины: ............................................................................................................ |
30 |
Кинетика ферментативных реакций.......................................................................................... |
32 |
Введение в обмен веществ. Биоэнергетика клеток....................................................................... |
43 |
Катаболизм ........................................................................................................................................... |
46 |
Цикл Кребса ............................................................................................................................... |
50 |
Цепь переноса электронов......................................................................................................... |
54 |
Гормональная регуляция............................................................................................................... |
61 |
Классификация гормонов .................................................................................................................... |
62 |
Белковый и аминокислотный обмен. ........................................................................................... |
74 |
Переваривание ..................................................................................................................................... |
76 |
Гниение аминокислот в кишечнике.................................................................................................... |
78 |
Нарушения ............................................................................................................................................ |
79 |
Катаболизм аминокислот .................................................................................................................... |
81 |
Фенилаланин ........................................................................................................................................ |
86 |
Тирозин ................................................................................................................................................. |
87 |
Временное обезвреживание аммиака............................................................................................... |
91 |
Креатин.................................................................................................................................................. |
96 |
Монооксид азота.................................................................................................................................. |
98 |
Нуклеиновые кислоты ................................................................................................................. |
102 |
Строение ДНК...................................................................................................................................... |
104 |
РНК ....................................................................................................................................................... |
105 |
Репликация ......................................................................................................................................... |
106 |
Репарация............................................................................................................................................ |
110 |
Транскрипция...................................................................................................................................... |
112 |
2
Посттранскрипционный процессинг................................................................................................. |
112 |
Трансляция.......................................................................................................................................... |
114 |
Посттрансляционный процессинг..................................................................................................... |
115 |
Механизмы генетической изменчивости......................................................................................... |
117 |
ДНК-технологии .................................................................................................................................. |
119 |
Обмен нуклеотидов ........................................................................................................................... |
119 |
Пиримидиновые нуклеотиды ........................................................................................................... |
121 |
Пуриновые нуклеотиды ..................................................................................................................... |
124 |
Катаболизм пуриновых нуклеотидов ............................................................................................... |
125 |
Катаболизм пиримидиновых нуклеотидов...................................................................................... |
128 |
Катаболизм дТМФ .............................................................................................................................. |
129 |
Углеводный обмен ...................................................................................................................... |
130 |
Крахмал ............................................................................................................................................... |
135 |
Синтез гликогена ................................................................................................................................ |
137 |
Распад гликогена ................................................................................................................................ |
138 |
Метаболизм глюкозы......................................................................................................................... |
139 |
Метаболизм галактозы ...................................................................................................................... |
149 |
Пентозо-фосфатный путь ПФП........................................................................................................... |
149 |
Глюконеогенез.................................................................................................................................... |
151 |
Цикл Кори............................................................................................................................................ |
154 |
Пути утилизации глюкозы.................................................................................................................. |
155 |
Гормональная регуляция................................................................................................................... |
158 |
Работа почек. Глюкоза в моче........................................................................................................... |
161 |
Липидный обмен......................................................................................................................... |
168 |
Переваривание и всасывание липидов............................................................................................ |
172 |
Транспорт липидов. Липопротеины ................................................................................................. |
175 |
Хиломикроны ХМ ............................................................................................................................... |
177 |
Липопротеины очень низкой плотности. ЛПОНП............................................................................ |
178 |
Липопротеины низкой плотности. ЛПНП ......................................................................................... |
178 |
Липопротеины высокой плотности. ЛПВП ....................................................................................... |
179 |
Атеросклероз ...................................................................................................................................... |
183 |
Катаболизм липидов.......................................................................................................................... |
186 |
Кетоновые тела................................................................................................................................... |
194 |
Связь углеводного и липидного обменов........................................................................................ |
197 |
Синтез жирных кислот ....................................................................................................................... |
199 |
3
Синтез глицерофосфолипидов.......................................................................................................... |
203 |
Липотропные вещества...................................................................................................................... |
205 |
Холестерол .......................................................................................................................................... |
206 |
Синтез сфинголипидов....................................................................................................................... |
208 |
Ацетил-КоА.......................................................................................................................................... |
209 |
Строение мембран ............................................................................................................................. |
210 |
Свободнорадикальное окисление.................................................................................................... |
218 |
Биохимия печени......................................................................................................................... |
224 |
Желтухи ............................................................................................................................................... |
228 |
Биохимия соединительной ткани................................................................................................ |
236 |
Биохимия мышечной ткани......................................................................................................... |
240 |
Биохимия крови........................................................................................................................... |
245 |
Биохимия мочи............................................................................................................................ |
253 |
Биохимия нервной ткани............................................................................................................. |
256 |
4
Белки
Прежде всего, нужно сказать, что из себя представляют белки. Белки – это биологические полимеры, мономерами которых являются протеиногенные альфа-аминокислоты. Белки и выполняемые ими функции крайне разнообразны, в общем-то почти все функции, которые существуют в клетке, так или иначе присущи белкам. Самая главная функция белков – ферментативная. Почему? Существование живого организма заключается в его постоянном обмене энергией, веществом и информацией с окружающей средой, всё это обеспечивается метаболизмом. Метаболизм – это просто совокупность всех химических реакций, протекающих в нашем организме. Но фишка в том, что почти везде в нашем организме невысокая температура
и нейтральная среда – в таких условиях все реакции протекали бы годами, но у нас есть ферменты, которые позволяют работать этим реакциям за доли секунды. Таким образом, ферменты обеспечивают возможность метаболизма, обеспечивающего возможность жизни, поэтому ферментативная функция у белков главная.
Что касается других функций? Их больше двадцати, перечислю основные:
•структурная (коллагеновые волокна придают прочность соединительным тканям),
•двигательная (за счёт актина, миозина, тропонина и тропомиозина образуются миофибриллы, которые позволяют сокращаться мышечным волокнам),
•транспортная функция (это может быть транспорт по ткани, например, кислород переносится гемоглобином, а может быть транспорт через клеточную мембрану, например, ионные каналы, транслоказы, натрий-калиевая атфаза и тд, а также транспорт внутри клеток),
•регуляторная (многие гормоны имеют белковую или пептидную структуру, например, белок соматотропин, помимо этого все клеточные рецепторы являются гликопротеинами),
•защитная (антитела, или как их ещё называют гамма-глобулины крови, являются эффекторами гуморального иммунитета),
•также белки могут выполнять энергетическую (при сильном голодании печень забирает из крови белки-альбумины, гидролизует их до аминокислот, которые пускает на глюконеогенез, то есть синтез глюкозы, которая используется для энергетических нужд) и многие другие функции.
Как я и сказал, белки выполняют практически все функции в нашем организме, поэтому они являются важнейшим структурно-функциональным
5
компонентом клеток и тканей. Локализованы белки в межклеточном веществе, мембранах клетки, органеллах, цитоплазме и ядре. Если у органов есть специфическая функция, значит, у них есть и специфические белки. Что касается белкового состава организма, то существуют неспецифичные белки, которые есть в любых клетках, а есть тканеспецифичные, то есть те, которые присутствуют только в этой ткани. Как изменится белковый состав тканей при болезни? Ну например, в сердце есть фермент лактатдегидрогеназа изоформ 1 и 2, а в, крови его нет, но если у вас произошёл инфаркт, то ткани разрушены и этот фермент попадает в кровь, таким образом меняется белковый состав крови. Также некоторые белки могут резко менять своё количество в ответ на какой-то процесс. Например, у вас инфекция, поэтому
в крови резко возрастает количество антител. Таким образом, основные изменения белкового состава организма при болезни это появление белков там, где их быть не должно, либо сильные изменения их количества (увеличение или уменьшение). Про изменения белкового состава рассказал, потому что это иногда спрашивают на семинаре, так что знайте.
Это была прелюдия, которая не очень-то и важна, но спросить её могут. Многим кажется, что это просто и учить не надо, но, когда их это спрашивают на семинаре, они не могут связать и двух слов, так что, пожалуйста, не поленитесь запомнить этот раздел. Теперь к более важному.
Классификация белков.
Первый признак классификации – сложность. Белки бывают сложные и простые. Простые белки в своём составе имеют только аминокислоты, т.е. только белковый компонент (пример – пепсин, да и любой гидролитический фермент, ещё пример – альбумин). Сложные белки в своём составе, помимо белкового компонента, имеют небелковый компонент, например, гемоглобин имеет небелковую часть – гем.
Второй признак классификации – третичная структура. Белки бывают глобулярные (большинство) и фибрилярные. Глобулярные белки в третичной структуре имеют форму шара, они хорошо растворимы в воде (пример – любой фермент), а фибрилярные (коллаген) белки имеют структуру, похожую на пластинку, плохо растворимы в воде, часто выполняют структурные функции.
Третий признак классификации – количество мономеров. Белки бывают мономерными и олигомерными. Мономерный белок состоит из всего одной полипептидной цепи, то есть образуется всего один протомер, пример – миоглобин. Олигомерный белок состоит из нескольких полипептидных цепей и, соответственно, протомеров, чаще из чётного количества, пример – гемоглобин (4 субъединицы). Если что, субъединица =
6
протомер. Это три главных пункта классификации белков. Важный момент. Третичная структура – глобула, образуется одной полипептидной цепью, а четвертичная структура – это комплекс глобул, а несколько глобул, значит, и несколько полипептидных цепей, то есть только олигомерный белок. Следовательно, высшая структура для мономерного белка – третичная, а для олигомерного – четвертичная. И ещё важный момент: как различить олигопептид, полипептид и белок? Всё просто – по количеству аминокислотных остатков. До 10-ти аминокислот – олигопептид, до 50 аминокислот – полипептид, свыше 50-ти аминокислот – белок.
Аминокислоты
Теперь другой, не менее важный момент, аминокислоты. Всего протеиногенных аминокислот 20 штук, все они являются L-альфа- аминокислотами, то есть от углерода номер два отходит обязательно аминогруппа. Учить ли все формулы? Вообще-то стоит, это ни раз пригодится, но если совсем лень, то обычно в кабинетах кафедры биохимии на стене сверху висят все эти формулы. Однако классификацию вам выучить придётся, а выучить её легче, поняв. По физико-химическим свойствам
аминокислоты, а точнее их радикалы, разделяют на гидрофобные/неполярные и гидрофильные/полярные, последние разделяются на нейтрально, отрицательно и положительно заряженные. Для начала стоит разобраться с тем, что такое полярность. Вспомните, что атомы разных элементов имеют разную электроотрицательность. В чём она выражается? Ну вот два атома образуют между собой ковалентную полярную связь – получается общая орбиталь, по которой гуляет два электрона, но если один атом более электроотрицательный, то около него эти электроны будут ошиваться чаще, а электроны вообще-то имеют отрицательный заряд, а значит, над этим атомом будет создаваться частично отрицательный заряд, например, -0,5, а на другом атоме, соответственно +0,5. Вот отсюда берётся полярность. Если разница в электроотрицательности атомов достаточно велика, то полярность будет, например, между кислородом и водородом эта разница огромная, поэтому гидроксильная группа является полярной. Но есть ещё и ионы, это атомы/молекулы, которые полностью отдали или приняли электрон, поэтому они имеют полный, а не частичный заряд, например, -1 или +1. Таким образом, некоторые группировки и, соответственно, аминокислоты могут быть полярными (гидроксильная группа у серина, треионина, тирозина и амидные группы у аспаргина и глутамина обвелены в кружочек карандашом; пиридиновый азот у гистидина, гуанидиновая группировка у аргинина, аминогруппа у лизина обведены в зелёный кружочек; карбоксильная группа аспаргиновой и глутаминовой кислоты обведены в красный кружочек) – 10
7
полярных аминокислот. Среди них есть заряженные, то есть те, которые могут отдавать/принимать протон и приобретать полный заряд, они подразделяются на положительнозаряженные (лизин, аргинин, гистидин) и отрицательнозаряженные (аспаргиновая и глутаминовая кислоты), а остальные 5 нейтральнозаряженные, так как не могут принимать или отдавать протон. Что касается остальных 10-ти аминокислот? Они все неполярные, то есть гидрофобные. Почему? А разница в электроотрицательности между углеродом, водородом и серой невелика, поэтому частичные заряды практически не формируются. Да, вы скажете, что есть же ещё азот в триптофане, но он пиррольный, у него тоже низкая полярность связей. Таким образом, чтобы понять, является ли аминокислота полярной или нет, ищите в её радикале соответствующую группировку, а, чтобы понять, нейтральная, положительная или отрицательная, тоже смотрите на группировку.
8

Теперь давайте поговорим о том, как себя ведут в растворе полярные и неполярные молекулы. Обычно молекулы отталкиваются и держатся друг от друга на расстоянии, но полярные молекулы за счёт своих зарядов могут притягиваться друг к другу (плюс к минусу). Например, вода является высокополярной молекулой – над кислородом частично отрицательные заряды, а над водородом частично положительные. На картинке я изобразил сверху слева, как близко прилегают друг к другу молекулы воды, а справа изобразил взаимодействие между этими молекулами. С полярными молекулами всё ясно – тянутся друг к другу за счёт электростатических взаимодействий (плюс к минусу). А что с неполярными? На той же картинке под чертой под номером 1 я нарисовал две отдельные неполярные молекулы. Вода к ним не притягивается, ибо нет никакого заряда у этана, поэтому вода держится от него на расстоянии. Но, чтобы одни молекулы держались так далеко от другой, молекулы должны иметь много свободной энергии, а, согласно законам термодинамики, вещества стремятся отдать свободную энергию во внешнюю среду. Как быть? Смотрите на рисунок
9
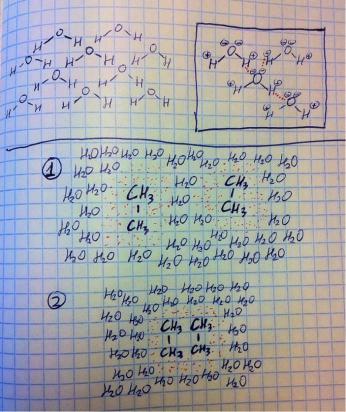
номер два. Когда две неполярные молекулы собираются вместе, то пространство, на которое не смеет заходить вода, уменьшается (я красными точками пометил, включайте пространственное мышление), а значит, молекулам нужно меньше свободной энергии. Получается, что неполярным/гидрофобным молекулам термодинамически выгодно объединяться и прятаться от воды!
Всё это я говорил, чтобы перейти к теме химических связей в молекуле белка. Но сначала пару слов о заменимых и незаменимых аминокислотах,
чтобы закончить с этим вопросом. Незаменимыми называются те аминокислоты, которые наш организм синтезировать никак не может – он получает их только с пищей, представители: валин, лейцин, изолейцин, метионин, фенилаланин, триптофан, треонин, лизин. Есть условно заменимые – тирозин и цистеин – они могут синтезироваться в нашем организме, но только из незаменимых, поэтому они условно заменимы. Есть частично заменимые – это те, которые детский организм синтезирует сам, но недостаточно, поэтому их надо получать дополнительно с пищей. Ну и полностью заменимые: глицин, аланин, пролин, серин, глютамин, глутаминовая кислота, аспаргин, аспаргиновая кислота.
Связи
Ну а теперь о связях. Связи разделяются на слабые и сильные. К сильным относятся ковалентные, в случае с белками это пептидные связи
10
