
bkh_dlya_tebya
.pdfсадится mutH, а между этими мутами встаёт как бы мостиком mutL, таким образом, на дочерней цепи собран комплекс, который разрывает цепь около неправильной пары, затем приходит экзонуклеала и вырезает все нуклеотиды дочерней цепи на протяжение всего мут-комплекса, образовавшуюся брешь заполняет бета-ДНК-полимераза, которая, как вы помните, оставляет одну несшитую фосфодиэфирную связь, которую сшивает ДНК-лигаза. Всё, работа сделана – белки расходятся.
Депуринизация. Действительно, случается такое, что пуриновое азотистое основание просто отсоединяется от дезоксирибозы, уходит и оставляет пустое место, которое называется АП-сайтом, которые замечает фермент-инсертаза, которая вставляет нужное азотистое основание и встраивает его в АП-сайт, образуя нуклеотид.
Дезаминирование – неферментативный процесс, в результате которого на место аминогруппы приходит атом кислорода, что нарушает комплиментарность (характерно для гуанина, аденина и цитозина), из гуанина и аденина образуются нетипичные азотистые основания, что замечает фермент ДНК-N-гликозилаза, которая вырезает неправильное основание, образуя АП-сайт, после чего действует инсертаза. Но если дезаминируется цитозин, то он превращается в урацил, а это нормальное для нуклеиновых кислот азотистое основание, поэтому ДНК-N-гликозилаза его не распознаёт – такая ошибка рискует быть неисправленной.
Переходим к индуцированным повреждениям. Под воздействием ультрафиолетового облучения пиримидиновые основания приобретают дополнительную энергию, что позволяет им соединяться друг с другом ковалентными связями друг с другом, если они соседи по одной цепи. Из-за такого соединения азотистые основания не могут образовывать водородные связи с основаниями другой цепочки – они смещены друг к другу. Ферментфотолиаза, пользуясь тем же самым ультрафиолетовым излучением, разрывает эти ковалентные связи и приводит в норму пиримидиновые основания.
Под действием ионизирующего излучения, химических и биологических агентов возможна химическая модификация азотистых оснований, они ненормальные для нуклеиновых кислот, а потому распознаются ДНК-N-гликозилазой и вырезаются, образуется АП-сайт, потом приходит инсертаза и вставляет нужное азотистое основание.
Это основные виды репарации ДНК. ДНК очень часто повреждается, поэтому системы репарации крайне востребованы и их дисфункция может приводить к серьёзным заболеваниям. В митохондриях есть своя ДНК, есть активные формы кисллорода, способные её повреждать, но нет своих систем репарации, поэтому существуют митохондриальные болезни.
111
Транскрипция
Теперь переходим к реализации наследственной информации. Первый шаг – транскрипция – перевод информации с гена (участок ДНК, несущий информацию о планируемой последовательности аминокислот в полипептиде) на прематричную РНК, матрица – нить ДНК, процесс предполагает создание РНК полностью комплементарной гену ДНК. Как это происходит?
Инициация транскрипции. На ДНК существует множество регуляторных
последовательностей, обсудим некоторые. На ТАТА-блок (последовательность ДНК с чередованием тиминовых и адениновых нуклеотидов) должен сесть ТАТА-фактор, без этого транскрипция вообще не возможна. Если на операторе (последовательность между промотором и геном) сидит белок-репрессор, то он должен уйти, чтобы на промотор (посадочная площадка) могла сесть РНК-полимераза. ДНК-зависимая РНКполимераза состоит из двух альфа, одной бета, одной бета-штрих и сигма субъединиц, именно сигма узнаёт промотор и позволяет РНК-полимеразе на него сесть, раскрутить ДНК, потом к ферменту присоединяются факторы инициации, после чего фермент синтезирует цепь из 10-ти рибонуклеотидов.
Элонгация – основная часть синтеза. Сигма-субъединица и факторы инициации отсоединяются от РНК-полимеразы, а присоединяются факторы элонгации, идёт синтез. Как и в репликации, и субстратом и источником энергии являются нуклеозидтрифосфаты и происходит всё комплиментарно.
Терминация – окончание. Когда РНК-полимераза раскручивает на ДНК последовательность-терминатор, на эту область садятся факторы терминации, позволяющие РНК-полимеразе соскочить с ДНК, после этого РНК-полимераза отсоединяет от себя факторы элонгации и возвращается сигма-субъединица.
Всё закончено, премРНК готова, но использовать такую для трансляции нельзя – нужно, чтобы она созрела, т.е. нужен посттранскрипционный процессинг, его сейчас и обсудим.
Посттранскрипционный процессинг
1.Первый этап – кэпирование. Кэп – головка будущей матричной РНК.
К5’-концу нити РНК присоединяется гуанидиндифосфат, в котором гуанин метилированный, причём ГДФ присоединяется к 5’-концу (а это ортофосфат, если не забыли) не гидроксильной группой, а тоже ортофосфатом, таким образом, РНК лишается 5’-конца, что защищает её от экзонуклеаз (гидролитические ферменты, разрушающие нуклеиновые кислоты), помимо этого, КЭП необходим для инициации трансляции.
112
2.Второй этап – полиаденилирование. Если в премРНК встречается последовательность ААУААА, то полиА-полимераза откусит один нуклеотид,
апотом присоединит 150-200 адениновых нуклеотидов (к 3’-концу). Такой хвост поможет мРНК выйти из ядра и защитит от экзонуклеаз.
3.Третий этап – сплайсинг. Дело в том, что в гене ДНК и, соответственно, премРНК есть не несущие информацию о первичной последовательности аминокислот в полипептиде участки – интроны, а есть экзоны – они несут информацию. С помощью комплекса белков и малой ядерной РНК интроны вырезаются, а соседние экзоны сшиваются друг с другом.
4.Четвёртый этап – альтернативный сплайсинг – есть не всегда, но часто. Вырезаются и некоторые экзоны. Почему? Это экономит место. Ибо проще сделать один большой ген, кодирующий три разные белка, чем делать три небольших гена. Как один ген кодирует несколько белков? Просто: есть экзоны 1, 2, 3, 4, 5, 6, а белки – 123, 145, 156 – это разные белки из разных цепей и с разными свойствами, но с одного гена.
После всех этих этапов премРНК созрела в мРНК, т.е. она может выйти из ядра, она может защищаться от ферментов, она может взаимодействовать с рибосомами и быть правильно прочитанной и реализованной.
Следующий этап в реализации наследственной информации – трансляция, но перед ней необходимо немного поговорить об этой самой наследственной информации, её организации и носителях (это желательно знать и понимать, но это не сложно, так что не поленитесь). Информация на данный момент считается вещью нематериальной, однако зависимой от материи – ей нужен источник, носитель. Информация всегда записывается знаками, грубо говоря информация – язык, а языку нужны свои алфавит и слова. По большому счёт у нас есть три языка – ДНК, РНК, пептидный; буквы в них: дезоксирибонуклеотиды у ДНК, рибонуклеотиды у РНК, аминокислоты у пептидов; слова у них: гены у ДНК, целые РНК (премРНК) у РНК, белки у пептидов – а вот речью является совокупность белков (слов) и того, что они делают (всё в клетке и организме по сути). Таким образом, формируя определённую последовательность нуклеотидов в ДНК, мы формируем белки и фенотипы организма. Кто является источником наследственной информации? Конечно, ДНК, а белки – реализаторы, РНК – реализаторыпосредники. ДНК сосредотачивает в себе всю информацию, имеет невероятно долгий срок жизни, постоянно защищается от повреждений и передаётся от организма к организму.
113
Так как есть несколько языков, существует необходимость перевода из одного в другой, а потому должно существовать универсальное правило перевода – генетический код. В свою очередь тот имеет ряд свойств: универсальность (язык РНК абсолютно одинаково переводится в язык пептидов во всех организмов, хотя есть редчайшие исключения), триплетность (одна аминокислота соответствует сочетанию из трёх определённых нуклеотидов), специфичность (одному триплету/кодону соответствует строго одна аминокислота, чтобы для одной мРНК был строго один единственный правильный пептид), вырожденность/избыточность (одна аминокислота может кодироваться рядом кодонов – мера безопасности, типа если ДНК мутирует, то в РНК один кодон превратится в другой, но оба кодона будут соответствовать одной аминокислоте, поэтому, несмотря на мутацию, белок в порядке), неперекрываемость (один нуклеотид не может входить в два кодона одновременно – они не накладываются друг на друга), знаки препинания (не могут располагаться посреди кодирующей части, вместо этого, они есть в её конце).
Геном – совокупность всей наследственной информации в организме (у животных ядро + митохондрии, у растений ядро + митохондрии + хлоропласты, у бактерий нуклеоид + плазмиды). Человеческий геном содержит около 30000 генов, кодирующих белки, что составляет около 2% всего генома, остальные 98% отвечают не за белки. Помимо кодирующих белок последовательностей, существует множество регуляторных. Многие наши гены способны кодировать несколько генов за счёт альтернативного сплайсинга. Ген – участок ДНК, несущий информацию о первичной последовательности аминокислот в пептиде.
Трансляция
Теперь о трансляции. Трансляция – матричный синтез белка, сложный ферментативный процесс сборки полипептида по матрице Мрнк, согласно правилам генетического кода, при участии трёх основных видов РНК (транспортные, матричная, рибосомальные). Разберём постадийно.
0.Нулевой этап – рекогниция – присоединение аминокислот к их транспортным РНК. Для каждой аминокислоты есть своя личная амино-ацил- тРНК-синтетаза, которая к каждой аминокислоте присоединяет соответствующие транспортные РНК. Как и куда? Альфа-карбоксильной группой аминокислоты к гидроксильной группе 3’-конца тРНК, при этом образуется макроэргическая связь, ибо гидролизуется АТФ до АМФ и пирофосфата, содержащая энергию, которая будет использована в будущем для создания пептидной связи.
1.Первый этап – инициация. Малая субъединица рибосомы (одинокая) присоединяет к себе факторы инициации, ГТФ и метионил-тРНК, затем
114
приходит мРНК и с помощью КЭПа и 4-го фактора инициации соединяется с малой субъединицей – соединяются. Дальше малая субъединица с факторами инициации и одним ГТФ ползут вдоль мРНК до первого её кодона, гидролизуя АТФ (источник энергии для движения), как только доползают, ГТФ гидролизуется, высвобождая энергию, которая позволяет факторам инициации отвалить от субъединицы, ибо больше в них нет нужды. После этого к малой субъединицы присоединяется большая – рибосома собрана и готова к работе. В отличии от предыдущих матричных реакций, трансляция идёт от 5’-конца к 3’-концу.
2.Второй этап – элонгация (собственно синтез). В рибосоме есть Е-сайт, Р-сайт и А-сайт. В Р-сайте расположена транспортная РНК с аминокислотой, в А-сайт приходит аминокислота с транспортной РНК, ГТФ и факторами элонгации, если антикодон тРНК подходит комплиментарно кодону мРНК, то гидролизуется ГТФ, что позволяет рибосоме двигать мРНК и тРНК из Р-сайта идёт в Е-сайт, а вторая из А в Р, одновременно пептидилтрансфераза переносит первую аминокислоту от тРНК из Р-сайта на аминокислоту в А- сайт, образуется дипептид, таким образом, из А-сайта в Р-сайт приползёт дипептид-тРНК, а в Е-сайт приползёт пустая тРНК и выйдет из хромосомы вместе с её факторами элонгации. Потом дипептид перенесут на следующую аминокислоту и получится трипептид, его перенесут на следующую и получится тетрапептид. Так постепенно нарастает полипептидная цепь.
3.Третий этап – терминация (завершительный). В один момент в А-сайт приходит стоп-кодон, которому не соответствует ни одна тРНК, тогда туда приходят два релизинг-фактора. Первый отрезает полипептид от тРНК, чтобы тот был свободен, а второй фактор гидролизует ГТФ, чтобы с её энергией позволить рибосоме продиссоциировать.
Так синтезируются полипептиды. Однако для быстроты и эффективности на одну мРНК нанизывается много рибосом – полисома. Однако полипептид это ещё не белок – нужен посттрансляционный процессинг.
Посттрансляционный процессинг.
Сначала полипептид встречается с шипперонами, которые обеспечивают ему правильный фолдинг – полипептид приобретает третичную или четвертичную структуру. Далее при необходимости белки отправляются в комплекс Гольджи на химическую модификаю и досборку – они могут гликозилироваться, радикалы их поверхностных аминокислот могут изменяться, в белки встраиваются лиганды – теперь они готовы к использованию. Однако на этом изменения не закончены – если это фермент, то у него существует активация путём ограниченного протеолиза и химической модификации, что также изменяет конструкцию белка.
115
Теперь обсудим регуляцию реализации наследственной информации.
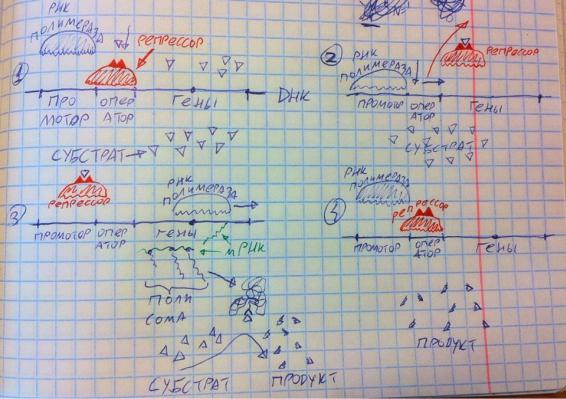
Прокариоты в основном используют регуляцию на уровне транскрипции, пример – лактозный оперон. Некоторые бактерии в обычных условиях не занимаются перевариванием лактозы, поэтому у них нет соответствующего фермента, её расщепляющего. Но если им дать лактозу и подождать, то этот фермент появится. Как это работает? Смотрим на рисунок. Перед геном (у бактерий гены идут по несколько подряд) есть промтор, на который обычно садится РНК-полимераза, а ещё есть оператор, на котором сидит белок репрессор, который немного выходит за пределы оператора и закрывает промотор, не давая садиться РНК-полимеразе – транскрипция невозможна. Но, когда в клетку бактерии попадает лактоза, она связывается со специальным кластером на белке-репрессоре, тот меняет конформацию и отстаёт от ДНК, после чего возможна транскрипция, при этом у бактерий сразу вырабатывается мРНК, на которую сразу садятся рибосомы, сразу синтезируется полипептид, формируется фермент, расщепляющий галактозу (показано на рисунке под цифрой 3 и стрелочкой). По мере того, как весь субстрат превратится в продукт, он перестанет связываться с белкомрепрессором, тот вернёт свою конформацию, сядет на своё место и снова прекратит производство белка через транскрипцию. Примерно так вырабатываются индуцибильные белки.
У эукариот куда более сложный геном и реализация наследственной информации, в связи с этим и механизмы регуляции поразнообразнее. Вопервых, регуляция на уровне хроматина, а именно, путём метилирования
116
эухроматин, доступный для транскрипции, конденсируется (принимает третичную структуру), превращаясь в гетерохроматин, недоступный для ферментов, так мы выключаем целые хромосомы в тех клетках, где они не нужны. Во-вторых, регуляция на уровне транскрипции – на ДНК множество регуляторных последовательностей: ТАТА-блок (вкл/выкл), оператор (индуцируемый прямо вкл/выкл), энхансер (ускорение), сайленсер (замедление). В-третьих, регуляция на уровне посттранскрипционных преобразований (альтернативный сплайсинг). Также ещё регулируется трансляция и посттрансляционные изменения с помощью определённых факторов, но это уже менее значимо. А инициаторами этих механизмов регуляции выступают различные гормоны и интерлейкины, взаимодействующие с цитозольными рецепторами, контактирующими с геномом.
А имеют ли какое-то клиническое значение для нас все эти процессы матричных синтезов? На самом деле да. Действие ряда антибиотиков и химиотерапевтических препаратов построено на принципе прекращения репликации (не даст размножаться вирусам, туберкулёзу и опухолевым клеткам) и синтеза белка (остановить можно на разных уровнях, если клетка не синтезирует белок, она умирает). Дауномицин, доксорубицин, актиномицин D встраиваются в ДНК и делают невозможными её репликацию
и транскрипцию (и не размножиться клеткам, и не выжить). Вещество мелфалан приводит к алкилированию азотистых оснований, чем существенно осложняет протекание матричных синтезов, т.е. результат тот же. Рифамицин – антибиотик, который ингибирует только бактериальную РНК-полимеразу, т.е. в отличии от предыдущих препаратов, действуют только на бактериальные клетки, а клетки хозяина не трогают. Тетрациклин встаёт в А-сайт бактериальных рибосом и блокирует трансляцию. Левомицин блокирует пептидилтрансферазу в рибосомах бактерий.
Механизмы генетической изменчивости
Теперь поговорим о механизмах генетической изменчивости. Этих механизмов много и классификаций много, разные преподаватели могут спрашивать по-разному, хотя часто этот вопрос, как и половину вопросов из темы матричных синтезов, пропускают, поэтому я предложу вам ту классификацию, которая будет понятна и полезна для вас. Вообще изменчивость – это свойство живого, без этого свойства не было бы развития, как и самой жизни. Прежде всего изменчивость нужно разделить на физиологическую и нефизиологическую. К физиологической относится репродуктивная и нерепродуктивная. Касательно репродуктивной, во время первой профазы мейоза происходит кроссинговер, затем в две анафазы «независимое» распределение хромосом/хроматид, таким образом генетический материал перераспределяется, плюс есть «независимое»
117
слияние гамет, т.е. в разных сперматозоидах немного разные геномы по вариантам генов, и любой из них имеет шанс соединиться с яйцеклеткой. Таким образом, геном ДНК ребёнка не идентично родительским – вот вам и изменчивость. Что касается нерепродуктивной изменчивости, то их можно подразделить на качественные и количественные. Количественные предполагают, что какой-то участок ДНК или все молекулы ДНК (многоядерные клетки или полиплоидные ядра) увеличиваются в числе, это делается в связи с крайне интенсивным их использованием. Качественные – меняются последовательности в ДНК либо одна последовательность перескакивает с места на место (транспозоны). Зачем менять последовательности? Существуют антитела – белковые молекулы, специфичные для каждого антигена, коих миллиарды, но генов, кодирующих антитела у нас меньше. Просто в антителах есть гипервариабильные участки, т.е. именно в них (соответствующие участки на ДНК) постоянно меняются, чтобы в антителах получались разные структуры для разных антител. Ну а теперь к нефизиологической изменчивости – это всевозможные мутации генные, хромосомные и геномные. Генные, в свою очередь, делятся по результату в гене и результату в белке. По результату в гене: вставка или выпадение нуклеотида/нуклеотидов (сдвиг рамки считывания приводит к изменению всех кодонов и влечёт море ошибок, хотя количество ошибок зависит от места мутации в гене) и замена оснований без сдвига рамки считывания. По результату в белке: сайленс (изменения ДНК не повлекли изменений в аминокислотной последовательности – спасибо вырожденности генетического кода), миссенс (есть ошибка в полипептиде), нонсанс (в результате мутации один кодон в мРНК превращается в стопкодон, в итоге, полипептид в каком-то месте просто обрывается). Физиологическая изменчивость запрограммирована в нашем организме, а нефизиологическая вызывается факторами физическими (температура, ионизирующее излучение), химическими (яды и токсины) и биологическими (паразитические существа вроде гибка, вирусов, бактерий и не только и их токсинов).
Из темы изменчивости ДНК вытекает тема полиморфизма белка. Что означает полиморфизм белков? Это означает, что существуют белки, отличающиеся друг от друга по физико-химическим свойствам, но выполняющих одну функцию или варианты одной функции. Изначально существовал или существует один белок, но в следствие изменчивости ДНК физиологической или нет появляются варианты одного белка, иногда это просто маркёры (тканеспецифичны, а реакция одна и та же, например, креатинкиназа в разных тканях делает одну и ту же работу, но по строению отличается), иногда они различны по функции (разные изоформы лактатдегидрогеназы отличны не только тканеспецифичностью, но и тем, что
118
катализируют одну реакцию в противоположенных направлений в связи с отличием метаболизма в разных тканях), а иногда это просто патология.
И завершая тему изменчивости, скажу, что нефизиологическая изменчивость, т.е. мутации, приводит к формированию наследственных заболеваний. Как и почему? Вообще наш организм следит за постоянством своего генетического материала, потому что он должен передаваться в целости и сохранности, неизменным, чтобы наши поколения работали «правильно», как мы. Однако происходят нарушения в структуре ДНК, их исправляют, но если их не успели исправить системы репарации, то так они там и останутся, будут приняты за своих и также репарироваться, т.е. мутация
– закрепившееся изменение ДНК, часто они бывают вредные, вызывают ошибки в белке утрата нативной структуры) и, соответственно, его дисфункцию (потерю активности и свойств), проявляющуюся в фенотипе болезнью.
ДНК-технологии
Ну и в завершение темы ДНК, поговорим о ДНК-технологиях. Их сейчас великое множество, если вам интересно, узнавайте про них сами, я же обрисую основные направления, которых достаточно знать для семинарских занятий и формирования общих представлений. ДНКтехнологии можно разделить на три больших направления: диагностика/исследование, терапия, инженерия. Ряд генетических заболеваний проверяется с помощью различных анализов ДНК, это имеет смысл потому, что наследственные заболевания представляют собой изменения в ДНК, поэтому там их и ищут. Помимо, диагностики есть исследования научные (расшифровка ДНК с целью понятия её функций или определение родства между различными биологическими видами с целью определения путей их развития и эволюции) и криминалистические (определение родства и принадлежности генетического материала с мест преступлений конкретным лицам). Терапия предполагает занесение генетического материала в тело человека, чтобы тот выполнял функцию, которую не способен выполнять собственный геном пациента. Инженерия – использование ДНК для синтеза определённых белков, которые будут использованы в терапии или науке, например, тот же самый инсулин для больных диабетом первого типа.
Обмен нуклеотидов
И теперь наконец мы можем перейти к собственно обмену нуклеотидов. И как всегда начнём с их переваривания в жкт. Происходит довольно просто. В желудке под действием кислой среды РНК и ДНК
119
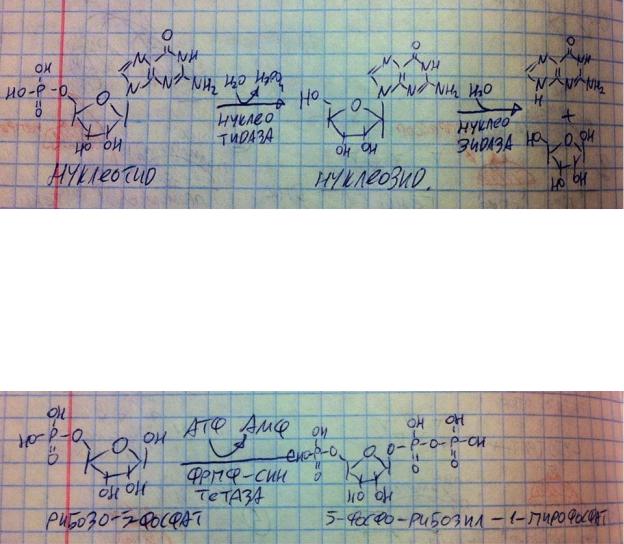
денатурируют, чтобы стать более доступными для действия ферментов. В 12типерстной кишке нуклеиновые кислоты встречаются с эндо- и экзонуклеазами из поджелудочной железы. Эндонуклеазы нарезают длинные нуклеиновые кислоты на короткие фрагменты, а те в свою очередь гидролизуются до нуклеотидов экзонуклеазами, которые действуют с конца фрагментов – чем больше фрагментов и их концов, тем больше экзонуклеаз могут взяться за дело и быстрее справиться. Ну вот мы получили нуклеотиды, но всосать их не можем, ибо они всё ещё являются сложными веществами, поэтому они расщепляются дальше. Сначала нуклеотидазы расщепляют нуклеотид на нуклеозид и ортофосфат, затем нуклеозидазы расщепляют нуклеозид на пентозу и азотистое основание. И только после этого продукты гликолиза могут всасываться (пентоза и азотистые основания в основном активным транспортом). На рисунке представлены реакции, которые необходимо уметь писать по вопросу переваривания – остальное схемой.
В обмене нуклеотидов существует очень важная молекула – 5-фосфо- рибозил-1-пирофосфат ФРПФ, она используется в синтезе всех нуклеотидов и реутилизации пуриновых оснований, поэтому мы должны знать формулу этого вещества и реакцию образования. Рибозо-5-фосфат поступает из пентозофосфатного пути (подробнее в теме углеводов). Данный фермент аллостерически ингибируется всеми нуклеотидами и активируется ортофосфатом.
120
