
bkh_dlya_tebya
.pdfТе же самые агликогенозы и гликогенозы. При гликогенозах не синтезируется гликоген, так как для него больше нет места, он и так почти всё заполонил в клетке, а при агликогенозе не синтезируется гликоген, потому что нет соответствующего фермента, и так, и так не работает один из способов утилизации глюкозы, что приводит к развитию гипергликемии в абсорбтивный период. Второй вариант патологий, вызывающих гипергликемию – патологии эндокринной системы, в частности сахарный диабет, но о нём будет сказано чуть позже.
Работа почек. Глюкоза в моче
Мы поговорили о глюкозе в крови, а что касается глюкозы в моче? Давайте немного вспомним, как вообще работают нефроны в почках. Сначала кровь проходит клубочковую фильтрацию, т.е. из крови в первичную мочу попадают все вещества крови, кроме форменных элементов и белков (маленькие белки, правда, просачиваются), а некоторые ионы проходят фильтрацию не на 100% потому, что часть этих ионов находится в связанном виде с белками, а белки в первичную мочу ну почти не попадают, глюкоза проходит фильтрацию на 100%. Дальше из канальца нефрона реабсорбируются вещества, которые нашему организму нужны, некоторые реабсорбируются частично (позволяет регулировать их выведение с мочой),
а некоторые на 100% всасываются, глюкоза в том числе. А некоторые, особо вредные вещества дополнительно секретируются в первичную мочу, не глюкоза. Ну и вот, после того, как в раствор скинули всё, что не нужно и забрали из него всё, что нужно, получается вторичная моча, которая выводится из организма. Глюкозы в моче в норме нет – она полностью реабсорбируется и нисколько не секретируется, потому что она нужна организму. Однако количество переносчиков глюкозы в почках ограничено и сами они имеют максимальную скорость, т.е. существует такая концентрация глюкозы в первичной моче и в крови, соответственно (они равны всегда, ибо глюкоза проходит клубочковую фильтрацию на 100%), при которой все переносчики глюкозы в почках работают на максимум и быстрее уже не могут (все заняты и все на максимальной скорости) – это пороговая концентрация, если её превысить, то лишняя глюкоза просто не будет успевать реабсорбироваться и будет попадать во вторичную мочу, что поможет нам выявить клинический анализ мочи. Итак, пороговая концентрация для веществ крови – это такая концентрация, при превышении которой вещество попадает во вторичную мочу. Для глюкозы порог составляет 10 ммоль/л. Обнаружение глюкозы в крови может нам сказать о гипергликемии (концентрация глюкозы в крови явно не меньше 10 ммоль/л), причём анализ делается натощак, т.е. гипергликемия в постабсорбтивный период, а это очень серьёзно. Но также глюкоза в крови может быть признаком патологии самих почек, в результате которой уменьшается
161
реабсорбция веществ из первичной мочи, а потому они начинают обнаруживаться во вторичной моче.
Теперь пару слов о роли АТФ/АДФ в регуляции углеводного обмена. Как я и говорил ранее, АТФ – показатель того, что энергии в клетке предостаточно и получать новую путём катаболизма ни к чему, поэтому АТФ тормозит катаболизм глюкозы – аллостерически ингибирует гликолиз через глюкокиназу, фосфофруктокиназу и пируваткиназу, также ингибирует ЦТК
через цитратсинтазу, изоцитратдегидрогеназу, альфакетоглутаратдегидрогеназу, а вот АДФ же, как показатель недостатка энергии
в клетках, аллостерически активирует эти процессы. А вот синтетически процессы, требующие энергии и работающие только, если в клетки эта энергия в форме АТФ есть, аллостерически активируются АТФ, например,
глюконеогенез через пируваткарбоксилазу, фосфоенолпируваткарбоксикиназу и фруктозо-1,6-бисфосфатазу, а АДФ их, соответственно, аллостерически ингибирует.
Теперь ещё немного подробностей о регуляции углеводного обмена. Гликолиз и глюконеогенез являются процессами-антагонистами, регулируются отношением инсулина и глюкагона, а главная точка приложения – регуляция ключевых ферментов этих процессов с помощью мощнейшего аллостерического эффектора – фруктозо-2,6-бисфосфата – подробности см. в теме регуляции гликолиза.
Разберём механизмы влияния инсулина, глюкагона и адреналина на синтез и распад гликогена. Адреналин и глюкагон работают по уже знакомой вам аденилатциклазной системе, т.е. гормон связывается с рецептором, образуется гормон-рецепторный комплекс, изменяется конформация, эти изменения передаются на G-белок (он мембранный, как и рецептор), его альфа-субъединица отсоединяется, выбрасывает из своего активного центра ГДФ, заменяет на ГТФ, движется по мембране к аденилатциклазе, активирует её, через некоторое время альфа-субъединица гидролизует ГТФ до ГДФ и ортофосфата, высвободившаяся энергия помогает альфа-субъединице подолзти до G-белка и обратно к нему присоединиться, при это после гидролиза ГТФ в активном центре остаётся ГДФ, затем цикл может повториться. Активированная аденилатциклаза превращает АТФ в цАМФ и пирофосфат, цАМФ соединяется с регуляторными центрами протеинкиназы- А, та (2 регуляторных и 2 каталитических субъединицы) диссоциирует, становясь активной, она фосфорилирует гликогенфосфорилазу (ключевой фермент мобилизации гликогена), активируя её и сам процесс мобилизации гликогена, также протеинкиназа-А фосфорилирует гликогенсинтазу (ключевой фермент синтеза гликогена), ингибируя его и сам процесс синтеза
162
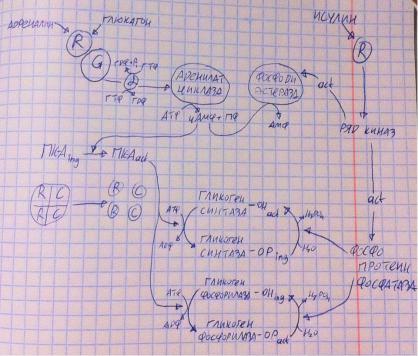
гликогена. Однако цАМФ попадает в фосфодиэстеразу, которая превращает его в АМФ, концентрация цАМФ падает, протеинкиназа-А ассоциирует и теряет активность, распространение гормонального сигнала ограничивается. Вот так адреналин и глюкагон активируют мобилизацию гликогена и ингибируют синтез гликогена.
А что делает инсулин? Когда инсулин соединяется со своим рецептором, также образуется гормон-рецепторный комплекс, изменяется конформация, рецепторная часть, которая контактирует с цитоплазмой, начинает фосфорилировать себя, а затем различные рецептор фосфорилирует специальные киназы, которые фосфорилируют другие киназы, а те, в итоге, фосфорилируют фосфопротеинфосфатазу, которая дефосфорилирует гликогенфосфорилазу (ключевой фермент мобилизации гликогена), ингибируя её и сам процесс мобилизации гликогена. Также фосфопротеинфосфатаза дефосфорилирует гликогенсинтазу (ключевой фермент синтеза гликогена), активируя её и сам процесс синтеза гликогена. Помимо этого, одна из киназ от инсулина фосфорилирует дифосфоэстеразу, делая её активной, а она, как мы говорили ранее, ограничивает распространение гормонального сигнала глюкагона и адреналина – антагонизм на лицо. Не забывайте, что аденилатциклазная система работает по каскадному механизму, т.е. с каждым звеном в цепи передачи сигнала сигнал усиливается (1 молекула гормона – 10000 цАМФ – 100000 активных ферментов – 10 млн превращённых субстратов).
Мы уже обсуждали глюкозу как узловой метаболит углеводного обмена, однако глюко-6-фосфат тоже является узловым метаболитом, так
163
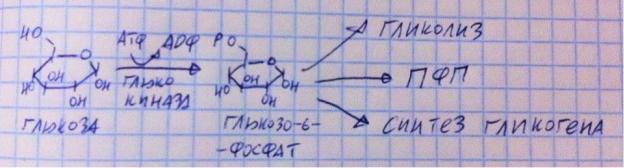
как объединяет два пути катаболизма и один путь анаболизма – гликолиз, ПФП, синтез гликогена. Реакция образования и использование на рисунке.
Теперь давайте обсудим изменения в углеводном обмене при различных состояниях и патологиях.
Голод. Человек долго ничего не ест и не переваривает, значит, из кишечника глюкоза в кровь не поступает, т.е. происходит затяжной постабсорбтивный период, печень активно отдаёт глюкозу посредством мобилизации гликогена, но тот быстро кончается, печень включает глюконеогенез (гидролизуются белки плазмы крови и мышц, чтобы были аминокислоты, которые можно пустить в глюконеогенез, но от аминокислот выходит много аммиака, поэтому будет отрицательный азотистый баланс), которого уже недостаточно для удовлетворения потребности организма в глюкозе - гипогликемия, поэтому дополнительно включается мобилизация ТАГ (распадается на глицерол и жирные кислоты, которые попадают в кровь) из адепоцитов, ткани начинают потреблять не только глюкозу, но и жирные кислоты (в бета-окислении они дают ацетил-КоА, НАДН2, ФАДН2). Однако в печени одновременно протекает глюконеогенез и бета-окисление, бетаокисление образует ацетил-КоА, который должен пойти в ЦТК, но ЦТК несколько заторможен, ибо глюконеогенез подворовывает из него оксалоацетат, поэтому часть ацетил-КоА идёт на синтез кетоновых тел, которые выделяются в кровь и поедаются другими клетками как источник энергии, однако эти кетоновые тела являются кислотами и закисляют кровь, что может привести к ацидозу, плюс избыток этих тел может выходить с мочой. Итак, длительное голодание – это гипогликемия, отрицательный азотистый баланс, повышенное содержание в крови жирных кислот и кетоновых тел, ацидоз, кетонурия.
При гликогенозах печень переполнена гликогеном, а потому синтезировать его ещё уже не может, да и другие процессы в ней из-за этого
с меньшей интенсивностью протекают, поэтому утилизация глюкозы работает малоэффективно, поэтому в абсорбтивный период мы можем наблюдать гипергликемию, так как организм не справляется с поступающей глюкозой. При данном заболевании гликоген не может распасться до глюкозы, а потому в постабсорбтивный период работает глюконеогенез (при
164
1-м типе глюконеогенез бесполезен, так как глюкозо-6-фосфатаза сломана, поэтому печень не отдаёт глюкозу вообще), но его недостаточно, начинается гипогликемия, а дальше всё, как при голодании. В общем гликогенозы – это гипергликемия в абсорбтивный период и быстрое наступление голодания со всеми прилагающимися нарушениями обмена веществ. В плане нарушений агликогеноз идентичен гликогенозам, ибо гликоген не синтезируется в принципе – гипергликемия в абсорбтивный период (не работает один из методов утилизации), а в постабсорбтивный нарушения, как при голодании, только быстрее (гликогена нет – он не может отдавать глюкозу).
А теперь самое серьёзное и актуальное заболевание эндокринологического профиля, характеризующееся нарушением углеводного и липидного обмена – сахарный диабет. Выделяют диабет 1-го и 2-го типа. При диабете 1-го типа поджелудочная железа по тем или иным причинам просто не вырабатывает достаточно инсулина или вообще не вырабатывает его (осложнения при гриппе, вызвавшие разрушение бетаклеток, аутоиммунные заболевания, опухоли и тд). Напомню, что инсулин – единственный гормон, понижающий концентрацию глюкозы в крови, также он активирует гликолиз, ПДК, ЦТК, ПФП, синтез гликогена, синтез жирных кислот и ТАГ, синтез холестерола, активирует ЛП-липазу и ГЛЮТ-4. Чем это чревато? Так как не работают никакие способы утилизации глюкозы, наблюдается высочайшая гипергликемия, глюкозурия, а также истощение запасов ТАГ и гликогена, так как они не синтезируются, зато расходуются (нет инсулина, который бы выключил процессы их распада), поэтому люди теряют массу. Данный вид диабета лечится просто – при приёме пищи человек вводит в кровь необходимое количество инсулина, тогда никаких проблем. При диабете 2-го типа инсулина выделяется достаточно, поджелудочная железа в порядке, а вот инсулиновые рецепторы или механизмы передачи сигнала внутри клеток не работают. Если выше описанная проблема наблюдается в мышечной или жировой ткани, то мы лишаемся очень серьёзных способов утилизации глюкозы, поэтому мы наблюдаем гипергликемию и глюкозурию, но печень работает, поэтому она начинает работать и за себя, и за мышцы, и за жировую ткань, но место для гликогена там ограничено, поэтому большая часть глюкозы уходит в гликолиз, образуется ПВК, тот идёт в ПДК, образуется очень много ацетилКоА, а часть глюкозы идёт в ПФП, образуется НАДФН2. Из НАДФН2 и ацетилаКоА синтезируется холестерол, жирные кислоты, ТАГ. Печень синтезирует много ТАГ, что приводит сначала к набору массы тела, а затем к жировому перерождению печени (подробности см. липидный обмен) с последующим нарушением её функций, а лишний холестерол в организме приведёт к развитию атеросклероза. Но даже после синтеза холестерола и ТАГ в печени может остаться лишний ацетил-КоА, из него будут синтезироваться кетоновые тела, которые приведут к ацидозу и кетонурии. Если же каким-то
165
образом сломаются рецепторы в печени, то характер патологий будет похож на диабет 1-го типа. При диабете 2-го типа нет смысла давать инсулин – нужна диета, исключающая быстрые углеводы и сохраняющая медленные, которые не дают большого подъёма уровня глюкозы в крови (см. начало темы углеводов, а именно их переваривание). При диабете обоих типов наблюдается гипергликемия, которая может приводить к неферментативному гликозилированию белков плазмы крови и стенок сосудов, что приведёт к дисфункции крови и сосудов, что повлечёт ряд патологий, в том числе, атеросклероз. Итак, сахарный диабет 1-го типа грозит гипергликемией, глюкозурией, истащением ТАГ и гликогена, потерей массы тела, болезнями сердечно-сосудистой системы. Сахарный диабет 2-го типа грозит гипергликемией, глюкозурией, ацидозом, кетонурией, набор массы тела, жировое перерождение печени с множеством возможных патологий, вытекающих из нарушения функций печени, болезни сердечно-сосудистой системы. Интересно то, что причиной развития сахарного диабета 2-го типа может являться ожирение, при котором адепоциты переполняются ТАГ, что нарушает свойства их мембраны и приводит к поломке рецепторов, формируется инсулинорезистентность. Для выявления сахарного диабета существует специальная проба «тест на толерантность к глюкозе» ТТГ. Как он проводится? На ужин обследуемый должен съесть 30-50 грамм углеводов, затем ничего не есть до исследования (8-14 часов), затем ему дают выпить в растворённом виде 75 грамм глюкозы. Перед пробой проводится замер уровня глюкозы крови (должна быть норма 3,3-5,5 ммоль/л), затем после приёма глюкозы производятся замеры уровня глюкозы каждый час, но можно и каждые полчаса. В результате, получается гликемическая прямая. На рисунке приведены гликемические прямые в норме у взрослых, детей и при диабете.
166
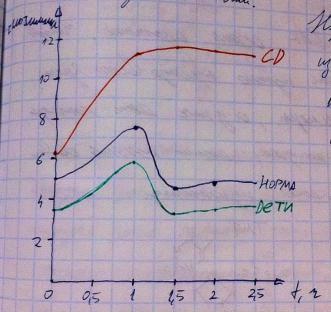
Как видите, вверх отмечена концентрация глюкозы в крови в ммоль/л, вправо – время в часах. В норме прямая стартует из нормы (3,3-5,5 ммоль/л), при диабете уже выше нормы. В норме в первый час наблюдается лёгкая алиментарная гипергликемия на уровне 8 ммоль/л, а при диабете гораздо выше, после первого часа в норме заметно действие инсулина – концентрация резко падает и к полутора часам или хотя бы к двум возвращается в норму, а при диабете мы не видем снижения. График для детей на 1-1,5 ммоль\л по всем точкам ниже нормального взрослого.
Маленькое примечание: при диабете есть постоянная жажда (желание разбавить глюкозу крови водой).
167
Липидный обмен
Липиды – это группа органических веществ, не растворимых в воде – это единственное их общее свойство, они отличаются друг от друга по структуре, поэтому их классификация для изучения темы особенно важна.
Липиды разделяют на простые и сложные. К простым липидам относят холестерол, сфингозин, высшие жирные кислоты. Формулы холестерола и сфингозина запоминать необязательно, однако надо иметь представление об их строении.
Холестерол имеет 4 цикла, одну небольшую цепь – всё углеводородное, также имеет гидроксильную группу, а потому является амфифильным веществом, т.е. он имеет и гидрофобную, и гидрофильную части. Холестерол служит основой для синтеза эфиров холестерола (сложные липиды), но нам он важнее в других планах, а именно, сам по себе холестерол является неотъемлимым компонентом клеточных мембран – он придаёт им жёсткость, также он выделяется в составе кожного сала (из сальных желез), которые подерживают нормальное функционирование волос и кожи, помимо этого, из холестерола синтезируются половые гормоны и кортико-стероиды, а ещё желчные кислоты, необходимые для переваривания жиров и их всасывания в кишечнике, а ещё из холестерола синтезируется витамин D3.
Сфингозин – это спирт с двумя гидроксильными группами, одной аминогруппой, длинным углеводородным хвостом с одной двойной связью, он необходим для построения сложных липидов, а именно, сфинголипидов.
А вот с высшими жирными кислотами мы должны познакомиться поближе. Высшие жирные кислоты имеют в составе молекулы более 12-ти атомов углерода. Они разделяются на насыщенные (не имеют двойных связей, характеризуются более высокой температурой плавления) и ненасыщенные (имеют двойные связи и более низкую температуру плавления). Примеры жирных кислот в нашем организме: насыщенные – пальмитиновая (16 углеродов, 0 пи-связей) и стеариновая (18 углеродов, 0 пи-связей) кислоты; ненасыщенные – пальмитоолеиновая (16 углеродов, 1 пи-связь), олеиновая (18 углеродов, 1 пи-связь), линолевая (18 углеродов, 2 пи-связи), линоленовая (18 углеродов, 3 пи-связи), арахидоновая (20 углеродов, 4 пи-связи) кислоты. Из них синтезируются в нашем организме только пальмитиновая, стеариновая, пальмитоолеиновая и олеиновая кислоты, а все полиненасыщенные (те, что имеют 2 и более пи-связей), а именно, линолевая, линоленовая и арахидоновая кислоты в нашем организме не синтезируются, а получаются лишь с пищей, в основном растительной, и относятся к витамину F. Каково значение
168
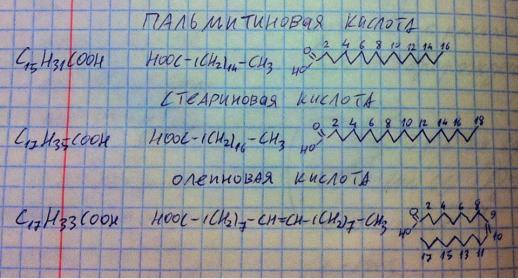
полиненасыщенных жирных кислот? Три основных значения. Во-первых, структурное значение – в составе сложных липидов мембран они придают мембране свойство текучести. Во-вторых, регуляторнзначение – из арахидоновой кислоты синтезируются все эйкозаноиды (это целая группа гормонов). В-третьих, как и все жирные кислоты, полиненасыщенные могут выступать источником энергии в клетке. А вот омего-3 полиненасыщенные жирные кислоты позволяют растворять холестерол и выводить его из организма (профилактика атеросклероза). Это основное по полиненасыщенным жирным кислотам, а к общей теме жирных кислот должен добавить, что я привёл лишь основные жирные кислоты нашего организма, но, помимо них, встречаются жирные кислоты более длинные, с нечётным количеством атомов углерода, с гидроксильными группами – такие необычные жирные кислоты в основном встречаются в головном мозге. На рисунке приведены формулы жирных кислот, которые требуется знать по программе.
Теперь обсудим сложные липиды. Первая группа – эфиры холестерола ЭХС. Образованы холестеролом (он имеет гидроксильную группу, позволяющую образовывать сложноэфирные связи с кислотами) и жирной кислотой, так как гидроксильной группы у холестерола нет, то вся молекула становится гидрофобной, каких-то важных функций ЭХС в организме не выполняют, а лишь являются транспортной формой холестерола.
Вторая группа – производные глицерола, которые можно разделить на глицеролипиды (моноацилглицериды МАГ, диацилглицериды ДАГ, триацилглицериды ТАГ) и глицерофосфолипиды (основные представители:
фосфатидилсерин, фосфатидилэтаноламин, фосфатидилхолин). Глицеролипиды представляют собою сложные эфиры многоатомного спирта глицерола и жирных кислот, причём запомните, что в нашем организме во втором положении всегда стоит ненасыщенная жирная кислота.
169

Глицерофосфолипиды строятся на базе фосфатидной кислоты, которая представляет собою диацилглицеридфосфат, через фосфорную кислоту к фосфатидной кислоте могут присоединяться сложноэфирной связью такие полярные молекулы, как серин, этаноламин и холин (все эти формулы надо знать, если вы в теории знаете, как устроены глицерофосфолипиды, то сможете легко запомнить эти формулы: 2 жирные кислоты + глицерол + ортофосфат + полярная молекула из названия липида). Строение ТАГ и основных глицерофосфолипидов на рисунке.
Теперь перейдём к биологическому значению. Глицеролипиды в нашем организме почти полностью представлены ТАГ, которые также именуются нейтральными жирами (нейтральные, потому что незаряжены, в отличии от тех же самых глицерофосфолипидов), в нашем организме они находятся в форме липидных капель в цитоплазме, в которые они собираются по причине того, что они полностью гидрофобные, по той же причине их не может быть в составе мембран – мембраны только для амфифильных веществ, не допускайте эту ошибку. Первоочередная задача нейтральных жиров – источник энергии (запасной), причём источник этот очень богатый, именно ТАГ почти полностью заполняет адепоциты (в основном ТАГ сосредоточен только в них), а потому вся наша жировая ткань (десятки килограмм) – это склад ТАГ, которого при полном отсутствии поступления пищи чисто теоретически должно хватить на неделю, а то и больше, а чисто практически такое существование влечёт определённые
170
