
bkh_dlya_tebya
.pdf
Катаболизм аминокислот
Теперь перейдём к катаболизму аминокислот и начнём с реакций трансаминирования. Данные реакции предполагают, что у нас реагирует аминокислота и альфа-кетокислота, между собой они меняются аминогруппой и карбонильной группой, в итоге получается новая аминокислота и новая альфа-кетокислота.
Наиболее частыми донорами аминогруппы являются глутаминовая кислота, аспаргиновая кислота и аланин, а наиболее частыми акцепторами – альфа-кетоглутарат, оксалоацетат, пируват (обратите внимание, что приведённые доноры структурно соответствуют акцепторам с одним отличием – у одних аминогруппа, у других кето-группа).
Данные реакции катализируют трансаминазы или аминотрансферазы (оба названия годятся), класс трансфераз, это сложные ферменты, их небелковой частью является пиридоксаль-фосфат ПФ (в основе
81

лежит пиридоксин – витамин B6), данный апоферментный кофактор имеет альдегидную группу, которая непосредственно участвует в реакции. На фото приведена типичная реакция трансаминирования в общем виде с раскрытием участия фермента. Все реакции, которые я привожу на фото, надо знать.
Каково биологическое значение данных реакций? Во-первых, это синтез заменимых аминокислот. Например, вам срочно понадобился аланин, тогда вы пускаете глюкозу в гликолиз, получаете оттуда пируват, который пускаете в трансаминирование и получаете из него аланин. Вовторых, это подготовка аминокислот к дальнейшим превращениям, в том числе катаболическим, т.е. перед тем, как начать разлагать аминокислоту, надо убрать из неё аминогруппу. Например, у аспаргиновой кислоты сначала убирается аминогруппа и получается оксалоацетат, который можно расходовать в ЦТК, в общем трансаминирование (утрата аминогруппы, а точнее её замена на кето-группу) является первым шагом в катаболизме аминокислот. В-третьих, за счёт этих реакций перераспределяется количество аминокислот в крови.
Аминотрансферазы также важны и с диагностической точки зрения, о чём уже не раз упоминалось в предыдущих темах, однако вспомним. В крови присутствует в малых количествах аспартатаминотрансфераза АсАТ, которая характерна для сердечной мышцы, и аланинаминотрансфераза АлАТ, характерная для печени. Они соотносятся в крови АсАТ/АлАТ = 1,33. Если разрушается сердечно-мышечная ткань (инфаркт), то в крови количество и активность АсАТ вырастает и соотношение АсАТ/АлАТ растёт. При разрушении гепатоцитов печени в кровь высвобождается АлАТ, тогда соотношение АсАТ/АлАТ, наоборот, падает.
82

Следующий тип реакций - дезаминирование, т.е. аминокислоты не перебрасывают аминогруппу на кого-то другого – они теряют аминогруппу в форме аммиака. Вообще практически для каждой аминокислоты есть своя оксидаза (окислительное дезаминирование), напомню, что оксидазы переносят электроны с субстрата на молекулу кислорода. Оксидазы отщепляют водород от альфа-аминогруппы и альфа-углерода – образуется двойная связь, водород (протоны + электроны) с помощью ФМН (для L- аминокислот) или ФАД (для D-аминокислот) переносится на молекулу кислорода – образуется токсичная перекись водорода. К тому, во что превратилась аминокислота, присоединяется вода (неферментативно, обратимо), в результате образуется карбонильная группа и аммиак (тоже токсичный).
Однако оксидазы в тканях не очень активны, к тому же иметь по ферменту на каждую аминокислоту очень затратно, да и перекись водорода тоже знаете ли не круто (активная форма кислорода АФК, способна запускать свободно-радикальное окисление, в том числе перикисное окисление липидов ПОЛ, вызывая окислительный стресс, приводящий к большому ряду заболеваний, но вообще АФК должны вырабатываться, но в строго определённом количестве – у них есть свои задачи, об этом подробнее в теме липидного обмена). Поэтому в нашем организме существуют универсальные реакции трансдезаминирования. Суть этих реакций в том, что
с помощью аминотрансфераз любая аминокислота может отдать свою аминогруппу альфа-кетоглутарату, тогда тот превратится в глутаминовую кислоту. Альфа-кетоглутарат – универсальный акцептор аминогрупп. Для глутаминовой кислоты есть уникальный фермент – глутаматдегидрогеназа, которая тоже отщепляет водород от альфа-аминогруппы и альфа-углерода, но делает это с помощью НАД, в отличии от оксидаз, далее неферментативно обратимо присоединяется вода, образуя кето-группу и свободный аммиак. Глутаматдегидрогеназа обладает очень высокой активностью, в отличии от оксидаз аминокислот, плюс она образует НАДН2, который даст 3 АТФ в ЦПЭ, и, в отличии от оксидаз аминокислот, не вырабатывает токсичную перекись водорода. Поэтому трансдезаминирование гораздо выгоднее окислительного дезаминирования и применяется заметно чаще. В связи с тем, что глутаматдегидрогеназа вырабатывает НАДН2 (может использоваться в ЦПЭ и принести 3 АТФ) и альфа-кетоглутарат (может использоваться в ЦТК),
83

она аллостерически регулируется: положительные эффекторы – АДФ и НАД, отрицательные – АТФ и НАДН2 – эта регуляция связана с энергетической функцией этого фермента. Биологическое значение окислительного дезаминирования – подготовка аминокислот к катаболизму, образование аммиака свободного. Биологическое значение трансдезаминирования –
подготовка аминокислот к катаболизму, образование свободного аммиака, энергетическая функция. Если вас спрашивают характеристику ферментов окислительного дезаминирования и трансдезаминирования, то просто назовите класс фермента, его апоферментный кофактор, скажите, что фермент сложный. На фото описаны в общем виде реакции трансдезаминирования.
Следующий тип реакций, относимый к катаболизму предназначен для образования продуктов, которые выполняют не метаболическую, а регуляторную функцию – образование биогенных аминов путём
декарбоксилирования аминокислот. Декарбоксилазы, осуществляющие эти реакции, являются сложными ферментами, апоферментный кофактор – тоже пиридоксаль-фосфат ПФ (на основе пиридоксина – витамин B6), класс – лиазы (отщепляют группировки без применения воды). Разберём несколько примеров образования биогенных аминов и их функции. Примеры трёх превращений приведены на рисунке.
Гистидин, лишаясь карбоксильной группы, становится гистамином, его функции: участвует в развитии воспалительных и аллергических реакция, расширяет сосуды и увеличивает их проницаемость, вызывает удушье, повышая тонус гладко-мышечных клеток бронхов, активирует секрецию желудочного сока.
У глутаминовой кислоты декарбоксила убирает альфа-карбоксильную группу (не перепутайте, ибо есть и вторая карбоксильная группа – её мы не трогаем) и образует гамма-аминомасляную кислоту ГАМК, её функции: тормозной нейромедиатор, улучшает дыхание и кровообращение нервной ткани.
84

Триптофан сначала гидроксилируется (триптофан-4-гидроксилаза является сложным ферментом класса оксидоредуктаз, подкласс монооксигеназы, в качестве кофермента использует тетрагидробиоптерин), после гидроксилирования триптофана по 4-му положению у него с помощью хорошо знакомой нам декарбоксилазы убирается карбоксильная группа и образуется серотонин, его функции: путём повышения тонуса гладкомышечных клеток регулирует температуру тела, АД и дыхание, является антидепрессантом.
Однако все биогенные амины должны иметь ограниченный срок действия, т.е. они должны действовать, пока в этом есть необходимость. Для инактивации биогенных аминов существуют МАО (моноаминоксидаза) и ДАО (диаминоксидаза), которые с помощью ФАД переносят водород с азота
и углерода на молекулу кислорода, превращая его в перекись водорода, затем неферментативно присоединяется вода, отсоединяя аммиак, образуется альдегид, который может окислиться до кислоты. В общем это похоже на окислительное дезаминирование.
85

Хотя помимо дезаминирования как способ инактивации биогенных аминов можно использовать и метилирование.
Фенилаланин
Далее мы разберём метаболизм аминокислот на примере фенилалнина и тирозина. У фенилаланина в нашем организме всего три пути
– используется для синтеза белка, также из него синтезируется тирозин, третий путь минорный, то есть почти не используется – фенилаланин превращается в фенилпируват, потом в фенилуксусную кислоту (эти вещества токсичны для нервной системы, но в норме их выделяется крайне мало). Поэтому для фенилаланина мы должны знать одну реакцию – синтез тирозина. Фермент фенилаланингидроксилаза (сложный, кофактор – железо, кофермент – тетрагидробиоптерин, класс оксидоредуктаз, подкласс монооксигеназ) ставит гидроксильную группу в пара-положение.
Существуют нарушения в обмене фенилаланина. Дело в том, что из трёх приведённых путей использования фенилаланин в основном превращается в тирозин. Тирозин способен полностью катаболизироваться, а фенилаланин – нет. При первичной фенилкетонурии фермент фенилаланингидроксилаза не работает, поэтому фенилаланин не превращается в тирозин, вместо этого его избытки поступают в минорный путь – образуются токсичные фенилпируват и фенилуксусная кислота, которые отравляют ЦНС. Дети с данной болезни сразу после рождения проверяются на фенилкетонурию, ибо без лечения/диеты в течение первых недель жизни будет наблюдаться существенное отставание в умственном развитии. При вторичной фенилкетонурии фермент в порядке, но нарушен обмен необходимого для этой реакции тетрагидробиоптерина, поэтому реакция всё равно не протекает. Какая диета должна соблюдаться? Вопервых, крайне ограниченное потребление фенилаланина (его избытки превращаются в токсичные вещества), во-вторых, в пище должен содержаться тирозин, так как сам организм уже не умеет его синтезировать. Диету стоит соблюдать до конца жизни. Люди с данной болезнью часто
86
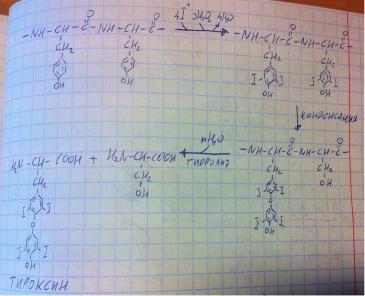
имеют особо светлые кожу и волосы. Болезнь называется фенилкетонурией, потому что фенилпируват (фенил-кетон-кислота) попадает в мочу, в норме этого не происходит – только при болезни.
Тирозин
А вот тирозин используется в нашем организме куда шире. Во-первых, тирозин способен полностью катаболизироваться, в отличии от фенилаланина, во-вторых, он также может использоваться в синтезе белка, в-третьих, из тирозина делаются катехоламины, в-четвёртых, из него делаются тиреоидные гормоны, в-пятых, из него делаются меланины. Разберём всё по очереди.
Поговорим о синтезе тиреоидных гормонов, а именно, тироксина (Т4) и трийодоксина (Т3). В тироцитах щитовидной железы синтезируется белок, в основном состоящий из тирозина (на фото фрагмент цепи этого белка из двух аминокислот), затем происходит реакция замещения – от бензольного кольца уходят протоны, на их место встаёт положительный йод,
а протоны соединяются с перекисью и электронами, превращаясь в воду. Таким образом, тирозин йодируется, на одно кольцо может встать 1-2 атома йода (на картинке по два). Затем происходит конденсация – одно кольцо отрывается, оставляя после себя серин, и налезает на другое кольцо, образуя эфир. Далее этот йодированный белок гидролизуется на серин и Т3 с Т4 (на картинке показано образование Т4, а если объединяются кольца с одним и двумя йодами, то получается Т3). Всё есть на рисунке.
Теперь разберёмся с полным катаболизмом тирозина.
87

Как я упоминал ранее, все аминокислоты первым шагом в катаболизме лишаются аминогруппы, поэтому тирозин вступает в реакцию трансаминирования с альфа-кетоглутаратом (фермент трансаминаза сложный, апоферментный кофактор – пиридоксальфосфат, класс трансфераз), тирозин превращается в пара-гидроксифенилпируват (объясняю название: если присмотритесь, увидите пируват, к нему присоединено бензольное кольцо (фенил), а на том гидроксильная группа в параположении). На него действует диоксигеназа, она убирает карбоксильную группу, а к оставшейся карбонильной группе присоединяет один атом кислорода, создавая новую карбоксильную группу, потом она переносит цепь на одно положение, а в освободившееся положение встраивает второй атом кислорода, образуя гидроксильную группу – 4 манипуляции (сложно, но запомните), продукт реакции – гомогентизиновая кислота. На гомогентизиновую кислоту действует ещё одна диоксигеназа, на рисунке я показал красной чертой, в каком месте фермент делает разрез и присоединяет к каждому углероду по одному атому кислорода – отсюда кетоновая и карбоксильная группы. Образовавшийся продукт – фумарилацетоацетат (если присмотритесь, то увидите в этой молекуле фумарат и два ацетата, впрочем это видно в последующих реакциях). Дальше работает фермент фумарилацетоацетатгидролаза, которая разрывает фумарилацетоацетат на фумарат и ацетоацетат. Фумарат может поступить в
88

ЦТК. Ацетоацетат активируется присоединением КоА с затратой АТФ (бета- оксибутирил-КоА-синтетаза), образовавшееся вещество с помощью фермента тиолазы и КоА разрывается на 2 ацетила-КоА, которые также поступят в ЦТК. В ЦТК образуются связанные протоны (НАДН2) и углекислый газ, протоны и кислород поступают в ЦПЭ, где образуется вода и АТФ. Итак, от тирозина остались только вода и углекислый газ, мы потратили кислород
и получили АТФ – полный катаболизм. Однако 4 из преведённых ферментов могут ломаться – каждому соответствует своя болезнь. Дефект первого фермента – тирозинемия 2-го типа. Дефект второго фермента – тирозинемия новорождённых. Дефект третьего фермента – алкаптонурия (в мочу попадает гомогентизиновая кислота, которая не расщипляется и на свету в моче чернеет). Дефект четвёртого фермента – тирозинемия 1-го типа.
Следующий путь превращения тирозина – синтез катехоламинов. Происходит в нейронах и мозговом веществе надпочечников.
Первым делом тирозин |
гидроксилируется |
с |
помощью |
тирозингидроксилазы (сложный фермент, кофермент – тетрагидробиоптерин, кофактор – железо, класс оксидоредуктаз, подкласс монооксигеназ), получается диоксифенилаланин ДОФА (называйте его именно так, никаких гидрокситирозинов). Затем на ДОФА действует ДОФАдекарбоксилаза (сложный фермент, апоферментный кофактор – пиридоксальфосфат, класс трансфераз), продукт реакции – дофамин (гормон счастья, нейромедиатор). На дофамин действует дофамингидроксилаза (сложный фермент, кофермент – тетрагидробиоптерин, кофактор – железо, класс оксидоредуктаз, подкласс монооксигеназ), продукт реакции – норадреналин (гормон смерти, нейромедиатор). Норадреналин путём метилирования под действием метилтрансферазы превращается в адреналин (гормон «бей или беги»), донором метильной группы является S-
89

аденозинметионин (к сере метионина цепляется аденозин, что позволяет этой аминокислоте легко отдавать метильную группу), который после отдачи превращается в S-аденозингомоцистеин.
И последний путь превращений тирозина – синтез меланинов. Все реакции происходят в меланоцитах кожи и глаз. Как и у катехоламинов, из тирозина получается ДОФА (фермент тирозингидроксилаза-2, её отличие от тирозингидроксилазы-1 в том, что вместо железа используется медь – это два разных фермента, осуществляющих одну реакцию). Из ДОФА образуется дофахром или бензотиазин при участии цистеина. Из дофахрома образуются эумеланины (чёрный-коричневый), а из бензотиазина феомеланины (красный-жёлтый). При дефектах тирозингидроксилазы-2 развивается альбинизм – депегментация глаз и кожи.
Касательно катаболизма аминокислот надо сделать небольшое примечание. Их разделяют на кетогенные, гликогенные и кетогликогенные. При распаде гликогенных аминокислот образуются вещества, из которых возможно синтезировать глюкозу (глюконеогенез – синтез глюкозы из неуглеводных компонентов, в основном за счёт аминокислот). Кетогенные аминокислоты при распаде дают кетоновые тела, которые распадаются на ацетил-КоА, который для синтеза глюкозы не используешь. Кетогликонные аминокислоты дают и то, и другое. Кетогенные: лейцин и лизин. Кетогликогенные: тирозин, фенилаланин, триптофан, изолейцин. Гликогенные: аланин, аспаргин, аспаргиновая кислота, глицин, пролин, серин, цистеин, аргинин, гистидин, валин, метионин, треонин, глутамин, глутаминовая кислота.
Если вы заметили, часто аминокислоты лишаются лишаются аминогруппы в форме аммиака. В нашем организме много первичных источников аммиака: катаболизм аминокислот (в основном от трансдезаминирования), инактивация биогенных аминов, распад азотистых оснований, гниение белков в кишечнике. Вторичный источник – распад
90
