
bkh_dlya_tebya
.pdfглутамина, который предварительно образовался из глутаминовой кислоты и аммиака из первичного источника, поэтому его называют вторичным источником. Однако аммиак крайне токсичен, а потому нуждается в обезвреживании и выведении. В чём его токсичность? Во-первых, аммиак – это слабое основание, если он будет накапливаться в крови, он сдвинет pH в сторону более высоких значений, что приведёт к алкалозу. Чем это грозит? У гемоглобина вырастет сродство кислорода к гемоглобину (ибо его конформация изменится), в результате гемоглобин будет хуже отдавать кислород тканям – наступит гипоксия, которая приведёт к гипоэнергетическому состоянию, к таким состояниям крайне чувствительна ЦНС (характеризуется высоким потреблением энергии, но низкими её запасами, а потому нуждается в постоянном притоке энергии). Во-вторых, существуют три таких важных вещества, как альфа-кетоглутарат, глутаминовая кислота, глутамин – они могут превращаться друг в друга при добавлении или отщеплении аммиака, эти реакции обратимы, но если аммиака в клетке много, то весь альфа-кетоглутарат превращается в глутаминовую кислоту, а та в глутамин. Потеря альфа-кетоглутарата означает торможение ЦТК, потому что он является его промежуточным продуктом – гипоэнергетическое состояние. Потеря глутаминовой кислоты означает, что больше не из чего синтезировать ГАМК, которая является тормозным медиатором, без неё в ЦНС начнётся перевозбуждение и это-то на фоне сильного гипоэнергетического состояния – адская смесь. А большое количество глутамина (а его будет реально много) приводит к отёку мозга, ибо это осмотически активное вещество – оно притягивает воду. В итоге: алкалоз, гипоксия, гипоэнергетическое состояние, перевозбуждение, отёк мозга – соответственно, симптоматика неврологическая, т.е. сильные головные боли, рвота, судороги и т.д. Если аммиак такой токсичный, его надо обезвреживать и выводить из организма, это происходит в печени и почках, но аммиак образуется во всех тканях и если он будет идти по крови в свободной форме, то он станет отравлять организм выше перечисленными способами, поэтому перед отправкой аммиака в печень и почки его нужно временно обезвредить.
Временное обезвреживание аммиака
Существует 5 способов временного обезвреживания аммиака.
1) Первый самый распространённый способ – синтез глутамина из глутаминовой кислоты – реакция требует 1 АТФ. Этим способом пользуются практически все ткани, причём довольно активно.
91
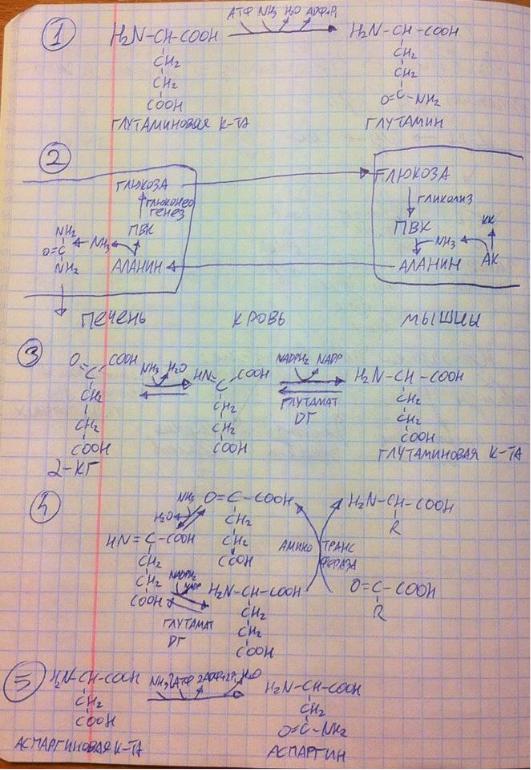
2) Второй способ характерен для скелетных мышц – глюкозоаланиновый цикл. В мышцах глюкоза в процессе гликолиза распадается до пирувата, который принимает аммиак, часто в результате реакций трансаминирования, получается аланин, он попадает в печень, там отдаёт аммиак, который в последствие печень превратит в мочевину и отправит через кровь в почки, и превращается снова в пируват, из которого печень в процессе глюконеогенеза синтезирует глюкозу и через кровь отправляет её в
92
мышцы. Выходит, что, таким образом, печень и аммиак от мышц получает и снабжает их глюкозой – два в одном.
3)Третий способ временного обезвреживания аммиака – синтез глутаминовой кислоты. Эти реакции мы разбирали, но в обратную сторону. К альфа-кетоглутарату неферментативно обратимо присоединяется аммиак, потом глутаматдегидрогеназа присоединит водород с помощью НАДФН2 (а обратная реакция через НАД – почувствуйте разницу), получится глутаминовая кислота.
4)Четвёртый способ – трансреаминирование – это как третий способ, но глутаминовая кислота отдаёт аминогруппу другой альфа-кетокислоте, превращая её в аминокислоту, а сама превращается снова в альфакетоглутарат.
5)И последний, крайне непопулярный из-за высокой энергозатратности, способ – синтез аспаргина из аспаргиновой кислоты – та же история, что и с глутамином, но тратится 2 АТФ.
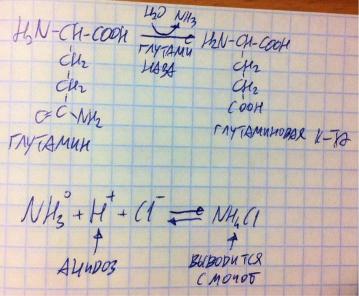
Как я уже сказал, основная транспортная форма аммиака – глутамин, поэтому если кому-то нужен аммиак, то они получают его из глутамина, глутаминаза разрушает его водой на глутаминовую кислоту и аммиак (первая реакция на рисунке). Чаще всего эти ферменты работают в печени и почках, потому что именно они забирают аммиак, чтобы его вывести. Для почек аммиак имеет особое значение. Если у человека ацидоз, то концентрация протонов в крови слишком высока. Что делают почки? Высвобождают аммиак, тот присоединяет к себе протоны, превращаясь в ион аммония, тот соединяется с хлорид-ионом, они образуют соль, которая выводится из организма с мочой – вот так почки с помощью аммиака могут снижать концентрацию протонов, спасая нас от ацидоза.
93
Однако большая часть аммиака поступает в печень, где из него синтезируется мочевина, которая выбрасывается в кровь, попадает в почки, из них в мочу. Синтез мочевины называется орнитиновым циклом, потому что в нём расходуется и восстанавливается (циркулирует) аминокислота орнитин, хотя, если внимательно посмотрите на реакции, заметите, что есть ветка и два цикла, но это тонкости. С чего начинается процесс? В митохондриях аммиак реагирует с углекислым газом под действием фермента карбомаилфосфатсинтетазы, который использует 2 АТФ, одну как источник энергии, вторую как донора фосфата, поэтому на выходе реакции мы имеем 2 АДФ, но один ортофосфат, а продукт реакции – карбомаилфосфат. Далее тот реагирует с орнитином под действием карбомаилфосфаттрансферазы, получается цитрулин, цитрулин выходит из митохондрий в цитоплазму. Там он реагирует с аспаргиновой кислотой под действием аргининосукцинатсинтетазы, которая гидролизует АТФ до АМФ и пирофосфата, чтобы спарить амино- и кето-группу и образовать шифово основание (=N-), продукт реакции – аргининосукцинат (если присмотритесь к формуле, разглядите в ней аргинин и сукцинат, связанные одной связью). Далее действует аргининосукцинатлиаза, которая рвёт ту самую связь, отдавая водород аргинину, в итоге сукцинат остаётся с –CH-CH-, поэтому образуется двойная связь –CH=CH-, поэтому это уже не сукцинат, а фумарат, итак, продукты: аргинин и фумарат. На аргинин действует аргиназа, которая с помощью воды отделяет от орнитина мочевину, продукты – мочевина и орнитин. Мочевина уходит из печени, орнитин возвращается в митохондрию
и замыкает орнитиновый цикл. Но что же с фумаратом из предыдущей реакции? Он уходит в митохондрии, попадает в ЦТК, там фумараза присоединяет к фумарату воду, превращая его в малат, на малат действует малатдегидрогеназа, она образует оксалоацетат и НАДН2, оксалоацетат в трансаминировании превращается в аспаргиновую кислоту, а НАДН2 в ЦПЭ даёт 3 АТФ. То есть аспаргиновая кислота постоянно восстанавливается. Заметьте, что в мочевине один атом азота аммиака, а второй от аспаргиновой кислоты, которая, в свою очередь, получает его от других аминокислот. Также заметьте, что в орнитиновом цикле тратится 3 АТФ, а за счёт фумарата синтезируется 3 АТФ, так что ЦТК помогает восстанавливать аспаргиновую кислоту и энергетически обеспечивает орнитиновый цикл (хотя орнитиновый цикл гидролизует 4 макроэргические связи в 3 АТФ, а ЦТК с ЦПЭ делают 3 макроэргические связи в 3 АТФ). Мочевины образуется и выделяется в норме 15-20 г/сут. У пяти ферментов орнитинового цикла известны энзимопатии. Карбомоилфосфатсинтетаза – гипераммонемия 1,
карбомоилфосфаттрансфераза – гипераммонемия 2, аргининосукцинатсинтетаза – цитрулинэмия, аргининосукцинатлиаза – аргининосукцинатурия, аргиназа – гипераргининэмия. Гипераммонемия – повышенное содержание свободного аммиака в крови, норма – 60
94

мкмоль/л, патогенез этого состояния описывался выше в теме токсичности аммиака.
Отдельно надо сказать о роли глутаминовой кислоты в
аминокислотном обмене. Она реально очень важна. Во-первых, из неё синтезируются белки и глутатион (трипептид, участвующий в транспорте аминокислот, выступающий в роли антиоксиданта, участвующий в конъюгации в печени и не только), во-вторых, из него получается альфакетоглутарат (материал для ЦТК – энергетическая функция, универсальный акцептор аминогрупп, а потому занимает центральное место в обмене аминокислот, ведь благодаря ему проводится трансдезаминирование, с помощью которого почти все аминокислоты теряют аминогруппы), в-третьих, из глутаминовой кислоты получается ГАМК (важный тормозной нейромедиатор), в-четвёртых, из глутаминовой кислоты синтезируется
95
глутамин (самая популярная транспортная форма аммиака – временное его обезвреживание), в-пятых, сама шлутаминовая кислота участвует в трансаминировании.
Креатин
Теперь поговорим об очень важном соединении креатине и его производных. Начнём с синтеза. Первая реакция протекает в почках. От аргинина отрывается амидиновая группа, тот превращается в орнитин, группа переносится на глицин, тот превращается в гуанидиноацетат. Гуанидинацетат отправляется по крови в печень, там он метилируется с помощью метилтрансферазы и S-аденазинметионина, получается креатин, он выходит в кровь и отправляется в скелетные мышцы, сердце и мозг. Там креатинфосфокиназа делает из креатина креатинфосфат с затратой АТФ – получается макроэргическое запасающее вещество, при нехватки АТФ тот же самый фермент мгновенно перенесёт ортофосфат с креатинфосфата на АДФ, превращая её в АТФ – креатинфосфокиназное фосфорилирование (самое быстрое). Такой метод фосфорилирования используется в начале нагрузок, например, вы лежали, вдруг встали и пошли – 20 метров вы пройдёте на креатинфосфате, а дальше включится гликогенолиз. Второй пример: вы проснулись, начали думать о том, проспали вы или нет – в первые 5-10 секунд потратили креатинфосфат, дальше перешли на гликолиз. Дело в том, что мы не может копить АТФ в клетке, ибо он всегда поддерживается на одном уровне и является аллостерическим регулятором, а креатинфосфат – нет, поэтому его удобно запасать. В общем запомните, что креатинфосфат – это энергетический стартёр, присутствует в скелетных мышцах, сердце и мозге. Однако бывает и такое, что креатинфосфат долго не используется и может неферментативно разлагаться на ортофосфат и креатинин, который является конечным продуктом метаболизма и выводится с мочой. Все реакции приведены на рисунке. Немножко клинических аспектов. Креатинин выделяется с мочой в количестве, пропорциональном мышечной массе, поэтому по его содержанию в моче оценивают мускулатуру спортсменов. Помимо этого, по этому веществу в моче оценивают скорость клубочковой фильтрации, почему по нему? Во-первых, он не связывается с другими молекулами, а потому на 100% проходит клубочковую фильтрацию, вовторых, он не реабсорбируется, в-третьих, он не секретируется в каналец дополнительно, т.е. количество креатинина в моче продиктовано только клубочковой фильтрацией, поэтому и характеризует её (таких веществ мало).
А вот креатин в моче не должен оказываться ни в коем случае у взрослых, у детей это норма. Помимо этого, должен сказать, что креатинфосфокиназа КК имеет две субъединицы и, соответственно, три изоформы (тканеспецифичны, т.е. есть только в них, в кровь попадают лишь при разрушении этих тканей), изоформа MM характерна для мышц, её
96

присутствие в крови означает миопатию, изоформа MB характерна для сердца, её появление в крови означает инфаркт миокарда, изоформа BB характерна для головного мозга, её появление в крови означает энцефалопатию с нарушением гемато-энцефалического барьера.
Ещё одна важная с клинической точки зрения тема – остаточный азот крови. В крови есть достаточно много азотсодержащих веществ, в основном это белки, но, если осадить все белки, останутся и другие азотсодержащие вещества, которые диагностически значимы. Именно потому, что они остаются после осаждения белков, их называют остаточным азотом крови. Чем представлены эти вещества? Мочевина (вплоть до 50%), аминокислоты (вплоть до 25%), креатинин, мочевая кислота, креатин, свободный аммиак. Нормальная концентрация остаточного азота крови 14-
28 ммоль/л. При превышении этой нормы мы говорим о гиперазотемией (не путайте с гипераммонемией, ибо при ней повышается концентрация только аммиака, причём существенно, а при гиперазотемии повышаются концентрации многих веществ). Она имеет несколько видов по происхождению: продукционная и ретекционная. Продукционная обусловлена повышенным распадом белков тканей и избыточным поступлением в кровь, т.е. разрушаются ткани, их белки распадаются и попадают в кровь, это бывает при таких заболеваниях, как опухоли, ожоги, обморожения, туберкулёз, цирроз и не только. Ретекционная обусловлена недостаточным выведением азотсодержащих продуктов и разделяется на
97
почечную и внепочечную. Почечная обусловлена неспособностью самих почек выводить азотсодержащие вещества, например, при туберкулёзе почек или пиелонефрите. Внепочечная обусловлена сниженным АД, т.е. почки полностью боеспособны, но из-за низкого АД (движущая сила клубочковой фильтрации) первичной мочи образуется мало, следовательно почки плохо очищают кровь, ибо работают не в полную силу.
Монооксид азота
Отдельный вопрос – монооксид азота. Это регуляторная молекула, а точнее вторичный мессенджер, который мы не обсуждали в теме гормонов – специально оставили это на аминокислотный обмен. Особенность этой молекулы в том, что она малополярна (может проходить сквозь мембраны клеток) и имеет орбиталь с неспаренным электроном (является свободным радикалом, а потому очень быстро реагирует с кислородом, поэтому срок жизни молекулы в организме не превысит 6-ти секунд).
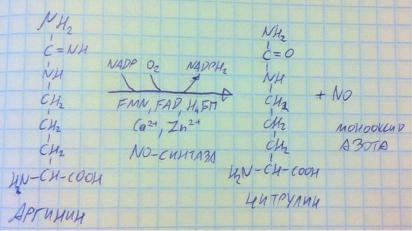
Что сказать о самой реакции. В аргинине рвётся двойная связь и на оба её атома цепляется кислород, водород от азота забирают. Образуется цитрулин и монооксид азота. Фермент, синтезирующий монооксид азота, NO-синтаза является сложным ферментом, его коферменты – НАДФ, Н4БП, его простетические группировки – ФМН, ФАД, его кофакторы – ионы цинка и кальция, класс оксидоредуктаз, подкласс диоксигеназ. Более того, у фермента есть изоформы – конститутивные и индуцибильные. Конститутивные постоянно присутствуют в эндотелии сосудов и нейронах в небольших количествах. Индуцибильные изоформы в макрофагах и нейтрофилах появляются в определённых ситуациях, зато в очень большом количестве – больше, чем в нейронах и эндотелии. Разберёмся, как работает монооксид азота в некоторых видах регуляции. Эндотелиоциты сосудов имеют множество рецепторов (лиганд-зависимые, механо-рецепторы), которые через фосфолипазную систему активируют образования комплекса кальций-кальмодулин, который активирует NO-синтазу, та синтезирует много монооксида азота, тот проникает в гладкомышечные клетки сосудов и
98
активирует в них гуанилатциклазу, которая провоцирует выход кальция из клетки и, следовательно, расслабление и вазоделятацию. Что делают нейроны? Они используют оксид азота как нейромедиатор, который, однако, способен выходить за пределы одного синапса в связи с его химическими свойствами, поэтому его действие немного отличается от простого нейромедиатора. Помимо этого, нейроны при активной работе могут выделять монооксид азота на сосуды, чтобы те расширялись и лучше снабжали активировавшиеся нейроны. Также монооксид азота предотвращает агрегацию тромбоцитов, участвует в апоптозе клетки и, соответственно, выполняет противоопухолевую функцию.
А теперь ряд дополнений к теме аминокислотного обмена.
Во-первых, гниение белков в кишечнике и обезвреживание этих продуктов. Как говорилось ранее, в норме небольшая часть белков и аминокислот попадает в толстый кишечник, где их разлагают бактерии на специфические продукты, некоторые из них довольно специфичные: из лизина получается кадаверин, из орнитина – путривисцин, из тирозина – фенол, из серосодержащих аминокислот – сероводород и не только. Если у вас нарушено переваривание белков и всасывание аминокислот, то их больше поступает в толстый кишечник, следовательно, гниение усиливается.
В любом случае, продукты гниения всасываются кишечником, попадают в кровь, а оттуда по воротной вене в печень (она их обезвреживает прежде, чем они разойдутся по всему организму). В печени есть два этапа: окисление/восстановление/гидролиз ксенобиотика и конъюгация (глюкуроновая, сульфатная, глутатионная, метилирование, ацетилирование). Продукты гниения в основном подвергаются конъюгации с помощью ФАФС (фосфоаденозинфосфосульфат), сульфотрансфераза берёт от него сульфат и перекладывает на продукты гниения белков, тогда те теряют часть токсичности и выводятся из организма. Хотя для аминов чаще применяется метилирование. Также продукты гниения могут конъюгировать с таурином и глицином, иногда продукты гниения требуют окисления (гидроксилирование с помощью цитохрома P450). Подробнее обезвреживание ксенобиотиков рассмотрено в теме биохимия печени.
Во-вторых, вам стоит знать общую схему путей образования и расхода аминокислот. Во многом аминокислоты поступают с пищей и расходуются в катаболизме. Однако все белки в нашем организме постоянно обновляются
– разрушаются и собираются вновь, поэтому белки в динамическом состоянии, им необходимо обновление, потому что со временем они могут повреждаться. Формально у нас нет запаса аминокислот – только небольшое их количество в крови, но если аминокислот не хватает, то мы можем синтезировать новые в печени (ну заменимые) и доставать их из некоторых белков (любые аминокислоты из белков крови и мышц).
99

В-третьих, иногда на семинарах и коллоквиумах спрашивают не только источники образования аммиака в организме, но и соответствующие формулы. Формулы на рисунке.
В-четвёртых, надо поговорить о роли аргинина в аминокислотном обмене. Как и обычные протеиногенные аминокислоты, аргинин используется в синтезе белка, помимо этого, он является промежуточным продуктом орнитинового цикла, донором амидиновой группы в синтезе креатина и позволяет синтезировать монооксид азота.
В-пятых, все трансаминазы обладают относительной специфичностью, ибо имеют минимум 2 субстрата (амино- и кето-кислоты).
В-шестых, роль серосодержащих аминокислот. К этим аминокислотам относится цистеин и метионин. Обе являются неполярными, а потому способствуют образованию гидрофобных связей в белке и формирования гидрофобного ядра белка. А цистеин также способен образовывать дисульфидные сильные ковалентные связи, стабилизирующие третичную и
100
