
bkh_dlya_tebya
.pdfF витамин – полиненасыщенные жирные кислоты, т.е. те, в радикалах которых две и более двойных связей, к ним относятся линолевая, линоленовая и арахидоновая кислоты. Какова их роль? Ну вообще в нашем организме у всех глицеролипидов во втором положении обязательно стоит ненасыщенная жирная кислота, чаще арахидоновая. Эти жирные кислоты придают мембранам клеток текучесть и пластичность. Из арахидоновой кислоты синтезируются гормоны группы эйкозаноидов. Получаем мы их из растительных жиров и рыбьего жира. Норма – 30% от всех жиров пищи, то есть 30 г.
Всё это вам обязательно надо выучить к семинару, но и на следующих темах вы будете очень часто вспоминать витамины, так что проработайте эту тему хорошо.
Существуют витаминоподобные вещества – у них всё, как у витаминов, только с той разницей, что мы можем их метаболизировать, пример такого – карнитин (помогает переносить ацилы (жирные кислоты) из цитоплазмы в митохондрию). Существуют ещё антивитамины, это вещества, полностью или частично инактивирующие витамины. Их разделяют на две группы. Первая группа связывает витамины в неактивные формы и/или мешает их всасыванию в кишечнике и поступлению в организм. Вторая группа представляет собой структурные аналоги витаминов, а потому они занимают их места в ферментах, при это лишая ферменты активности, ибо антивитамины не выполняют функцию витаминов, а лишь заменяют их. Антивитамины применяют как лекарственные препараты, дабы ослабить процессы, за которые отвечают эти витамины, например, можно ограничить пролифферацию в организме, чтобы в нём не могли размножаться бактерии, правда и клетки хозяина не смогут размножаться. Сами витамины тоже используются как лекарственные препараты при гиповитаминозах, инфекциях (поддержание иммунитета), заболеваниях нервной системы (улучшают биоэнергетику в нервной ткани, ускоряют обмен аминокислот, необходимых для синтеза нейромедиаторов), при заболеваниях, вызываемых окислительным стрессом (E, A, C – антиоксиданты), в качестве поддержки при беременности (фолиевая кислота как переносчик метильных групп, необходимых для метиллирования, необходимого для правильного блокирования неактивных участков генома в клетках).
(!) Небольшая дополнительная информация. С вас могут потребовать привести примеры ферментов для конкретных коферментов и витаминов, поэтому вот для вас небольшой списочек примеров. B1 – тиамин – ТДФ тиаминдифосфат – ферменты класса лиаз – пируватдекарбоксилаза. B2 – рибофлавин – ФАД флавинадениндинуклеотид – ферменты класса
31
оксидоредуктаз – подкласс дегидрогеназ – сукцинатдегидрогеназа. B3 – никотинамид – НАД никотинамидадениндинуклеотид – ферменты класса оксидоредуктаз – подкласс дегидрогеназ – изоцитратдегидрогеназа. B5 – патнатеновая кислота – КоА – ферменты класса трансфераз – тиолаза. B6 – пиридоксин – ПФ пиридоксальфосфат – ферменты класса трансфераз – аспартатаминотрансфераза. B9 – фолиевая кислота – тетрагидрофолиевая кислота – ферменты класса трансфераз. B12 – кобаламин – метилкобаламин
– ферменты класса трансфераз.
Кинетика ферментативных реакций
Начинаем большой подраздел – кинетика ферментативных реакций. Если что, кинетика изучает зависимость скорости протекания химической реакции от различных условий.
Теперь разберём собственно эти условия. Первое из них – температура.
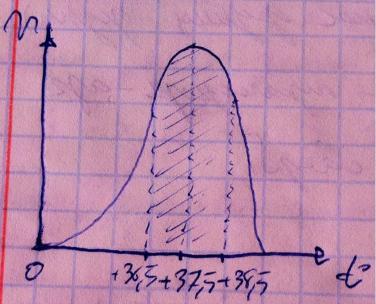
Обратите внимание на обозначения на графике – вверх скорость, вбок температура. Скорость постепенно возрастает вместе с температурой, достигает максимума, затем падает. Почему так? Вспомните тему механизма ферментативного катализа, там мы говорили об энергии активации – количество энергии, которое необходимо сообщить молекулам субстрата, чтобы тот вступил в реакцию, так вот чем выше температура, тем выше изначальная энергия молекул и тем меньше нам придётся добавлять им энергии до способности реагировать, то есть чем горячее молекулы, тем ниже энергия активации и тем выше скорость ферментативных реакций, поэтому на графике с подъёмом температуры мы наблюдаем подъём скорости реакции. Но почему дальше идёт спад? Дело в том, что при
32
высокой температуре ферменты денатурируют, теряют структуру и активность, переставая эффективно катализировать реакцию, скорость падает. Исходя из того, что слишком холодно и слишком жарко – плохо, мы заключаем, что есть термический оптимум, в основном он составляет +37,5 +/- 1 градус Цельсия.
Второй фактор – кислотность среды.
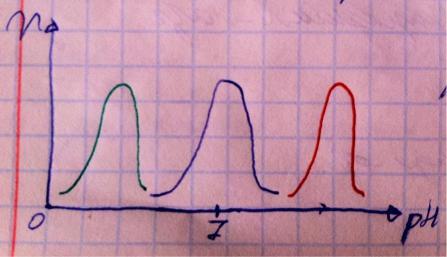
Здесь тоже есть свои оптимумы, на графике я изобразил оптимумы для трёх разных ферментов. Большинство ферментов нашего организма работают в нейтральной среде, т.е. их оптимум pH лежит в пределах от 6 до
8 (синий график), в пример можете привести ферменты гликолиза, например, гексокиназу. Существуют ферменты, работающие в кислой среде, например, пепсин в желудке работает при pH от 1 до 2,5 (зелёный график), но ему так приходится, ибо для переваривание белков просто необходима кислая среда (они денатурируют, полипептидная цепь раскручивается и её пептидные связи становятся доступными для пептидаз). Есть и уникальный фермент – щелочная фосфатаза – работающая в костях при pH между 9 и 10 (красный график). Все три типа ферментов с примерами хорошо запомните. Но почему активность ферментов так сильно зависит от pH? Из темы белков вспомните, что кислотность среды определяет уровень ионизации белков/ферментов, определяя их конформацию, гидратацию, растворимость и, в конечном итоге, активность. У ферментов обычно есть всего одна нативная конформация, если изменить заметно кислотность (в любую сторону), структура нарушается, поэтому оптимумы по кислотности у ферментов узкие.
33
Третий фактор – концентрация фермента.
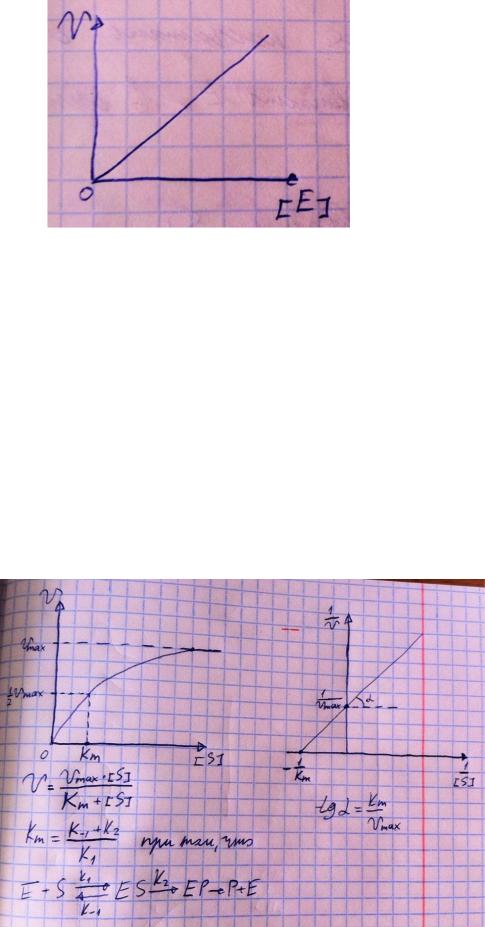
Тут прямая зависимость. Есть у вас 100 молекул субстрата и 10 ферментов, каждый из них превращает 10 молекул в секунду, за сколько справятся? За секунду. А если в 2 раза больше ферментов? За полсекунды, т.е. в 2 раза быстрее – вот она прямая зависимость.
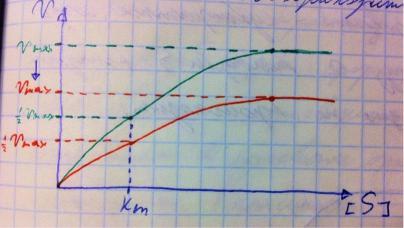
Четвёртый фактор, самый интересный и непростой, это концентрация субстрата. Обратите внимание на график слева, в основном пользоваться вы будите только им. Скорость растёт, но до определённого предела, почему? Все ферменты имеют определённую максимальную скорость. Когда у нас мало субстрата, то у нас не все ферменты заняты, чем больше даём субстрата, тем больше ферментов участвует в реакции, но до того момента, как все ферменты будут заняты, после этого скорость не меняется и на графике мы видим прямую (она не бесконечно прямая – при сверхвысоких концентрациях субстрата происходит субстратное ингибирование, но об этом поговорим позже, рисуем мы просто прямую без падений).
34
Теперь обратите внимание на Km на графике – это константа Михаэлиса, это та концентрация субстрата, при которой реакция достигает половины максимальной скорости. По этой константе судят о степени сродства субстрата ферменту и активности последнего. Оба этих момента сейчас поясню. Посмотрите на формулу, по которой вычисляют константу Михаэлиса. Чем меньше константа, тем выше сродство, к сродству, т.е. объединению, ведёт одна реакция К1, она обратно пропорциональна константе. К антисродству, т.е. разрушению фермент-субстратного комплекса ведут две реакции, они прямопропорциональны константе. Не запутайтесь только. Почему чем ниже константа, тем выше сродство? Что означает низкая константа? Она означает, что для достижения уже половины максимальной скорости ферменту требуется совсем немного субстрата, т.е. фермент очень быстро разгоняется! Поэтому чем ниже константа, тем выше активность, а активность тем выше, чем выше сродство субстрата ферменту, ибо, чтобы реакция произошла, сначала нужно образовать ферментсубстратный комплекс, который образуется тем лучше, чем выше сродство. Надеюсь, так понятно. Тут вам ещё написал формулу для вычисления скоростей реакции по Михаэлису-Ментен, график их же. Что сделали Лайнуивер и Бэрк? Они преобразовали график и предложили своё уравнение. Они взяли тот же график, но скорость и концентрацию субстрата поставили в -1 степень, таким образом, график превратился в прямую, которая пересекает оси абсцисс и ординат, позволяя вычислить по графику точное значение константы Михаэлиса и максимальную скорость. На первом графике мы вычисляем константу Михаэлиса только приблизительно – вот, в чём достоинство более сложного графика.
Теперь поговорим о регуляции активности ферментов. Существует специфическая и неспецифическая регуляция. Неспецифическая регуляция осуществляется факторами, которые действуют абсолютно на все ферменты просто потому, что они ферменты, и мы обсудили эти факторы выше – температура, кислотность, концентрации фермента и субстрата. Специфические методы регуляции предполагают, что регулируются строго определённые ферменты. Говоря о методах специфической регуляции, мы говорим об ингибировании и активации ферментов.
Сначала поговорим об ингибировании. Существует
•конкурентное и неконкурентное ингибирование,
•обратимое и необратимое,
•дополнительно выделяют субстратное.
Конкурентное означает, что молекула-ингибитор является структурным аналогом субстрата, а потому может встраиваться в активный центр фермента, не давая туда встраиваться субстрату, при этом сам ингибитор в
35
продукт превращаться не может, ведь он имеет иное, хоть и похожее на субстрат строение. Поэтому это ингибирование называют конкурентным – и субстрат, и ингибитор стремятся в активный центр. А кто туда чаще попадает?
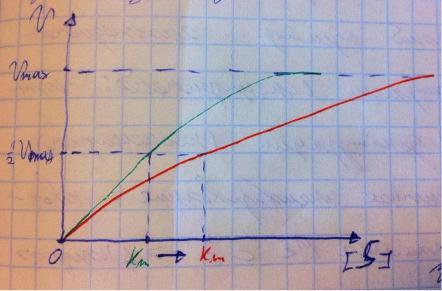
А тот, чья концентрация выше. Если у нас обратимое конкурентное ингибирование, то мы можем снять действие ингибитора, сильно увеличив концентрацию субстрата – он вытеснит ингибитор. Теперь посмотрите на график зависимости скорости реакции от концентрации субстрата. Как я и сказал, мы можем восстановить полностью активность фермента, если увеличим концентрацию субстрата, то есть константа Михаэлиса выросла, а максимальная скорость не изменилась. Максимальная скорость не изменилась, ибо с самим ферментом ничего не произошло – он полностью боеспособен, а вот сродство субстрата ферменту упало, ибо теперь ему мешает ингибитор своей конкуренцией. Так что запомните самое главное для конкурентного обратимого ингибирования: максимальная скорость не меняется, константа Михаэлиса растёт, а сродство субстрата ферменту падает из-за конкуренции ингибитора, действие ингибитора снимается повышением концентрации субстрата. Пример такого ингибирования – сукцинатдегидрогеназа ингибируется оксалацетатом, который имеет ту же длину и те же две карбоксильные группы, что и сукцинат.
Но ещё вам надо знать разницу между конкурентным ингибитором и лжесубстратом. Лжесубстрат тоже является структурным аналогом истинного субстрата и конкурирует с ним, но лжесубстрат вступает в реакцию, только продукт при этом образуется другой. Пример. Существует фермент алкогольдегидрогеназа, которая превращает этиловый спирт в ацетальдегид, но она также может превращать метиловый спирт в формальдегид, который является невероятно токсичным для нашего организма. Лжесубстрат – метиловый спирт, при отравлении им человеку дают огромные дозы
36
этилового спирта, чтобы тот конкурентно вытеснил метиловый спирт и не дал ему превратиться в формальдегид. Знать разницу очень важно.
Теперь поговорим о неконкурентном ингибировании. В этом случае молекула ингибитора связывается с ферментом, но не в активном центре, и изменяет конформацию фермента, снижая его активность. Максимальная скорость снижается, так как конформация фермента изменена – активность упала. Константа Михаэлиса однако остаётся неизменной, потому что никто не мешает субстрату проникать в активный центр. Но в данном случае единственный вариант восстановить активность фермента – убрать ингибитор, субстрат тут никак не поможет, ибо дело в структуре фермента, а не в конкуренции за активный центр. В этом практическая разница между конкурентным и неконкурентным ингибированием – при первом падает константа Михаэлиса, а максимальная скорость остаётся постоянной, а при втором константа остаётся неизменной, а максимальная скорость падает.
Теперь поговорим о разнице между обратимым и необратимым ингибированием. При обратимом ингибировании активность фермента восстанавливается, если убрать ингибитор или, как при конкурентном обратимом, повысить концентрацию субстрата. Обратимое бывает конкурентным и неконкурентным. При необратимом ингибировании после того, как мы уберём ингибитор, активность не восстанавливается, либо убрать ингибитор просто невозможно. Необратимое ингибирование тоже может быть конкурентным и неконкурентным. При конкурентном вещество связывается с активным центром и не уходит оттуда, а при неконкурентном связывается с поверхностью фермента. К необратимому ингибированию способны ионы тяжёлых металлов и некоторые хим вещества, которые связываются с радикалами аминокислот или просто встраиваются, нарушая конформацию фермента, снижая его активность. Существует и пятый, особенный вид ингибирования – субстратное. Это когда субстрата настолько больше, чем фермента, что в активный центр встраивается сразу две молекулы субстрата, но вступить в реакцию они, естественно, не могут, в итоге субстрат сам себе мешает попадать в активный центр. Всё видно на
37
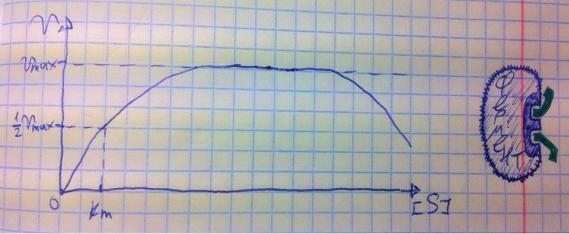
графике: до определённых концентраций скорость остаётся максимальной, но, когда субстрата становится слишком много, скорость падает, на картинке справа показано, как две молекулы субстрата встраиваются в один активный центр.
Ингибиторы (обратимые конкурентные) очень часто используют, как лекарственные препараты, чтобы замедлить патологические процессы в организме. Например, при подагре слишком много пуринов поступает в катаболизм, в результате образуется много мочевой кислоты, та откладывается в форме острых кристаллов в суставах (макрофаги хотят растворить эти кристаллы, натыкаются на них, рвутся, высвобождают все свои ферменты и разрушают всё вокруг, вызывая асептическое воспаление – такие воспалённые суставы называются тофусами, невероятно больно) и камней в почках. Один из ферментов катаболизма называется ксантиноксидазой, который превращает гипоксантин и ксантин в мочевую кислоту, больным дают алопуринол, который встраивается в активный центр этого фермента и не даёт ему синтезировать слишком много мочевой кислоты. Если мочевая кислота образуется в небольших количествах, то она нормально выводится из организма, не превращаясь в камни и кристаллы.
Теперь поговорим об активации ферментов. Существует 4 способа:
•ограниченный протеолиз,
•белок-белковые взаимодействия (ассоциация/диссоциация),
•аллостерическая активация,
•химическая модификация.
Поговорим о каждом отдельно и подробно.
Ограниченный протеолиз. Некоторые ферменты синтезируются с избыточной полипептидной цепью, которая либо прикрывает активный центр фермента, либо не даёт ему окончательно сформироваться. Если эту
38
лишнюю часть пептида откусить, фермент станет активным. Так как гидролизуется всего часть фермента, это называется именно ограниченным или частичным протеолизом. Это, понятно, необратимый способ активации. Этот вид протеолиза обычно осуществляют специальные ферменты протеазы, реже это делает, например, кислота (соляная кислота в желудке активирует пепсин). Обычно такой способ активации делают для секреторных ферментов, которые должны становиться активными в строго определённом месте и времени. В основном это пищеварительные ферменты (проферменты – пепсиноген, химотрипсиноген, трипсиноген, ферменты – пепсин, химотрипсин, трипсин), если они бы синтезировались активными в клетках желёз, то они тут же бы эти клетки и переваривали бы,
а так их в безопасной форме проферментов выводят в просветы органов жкт и там их активируют. Ещё часто активируются частичным протеолизом ферменты из числа факторов свёртывания крови (профермент – протромбин, фермент – тромбин).
Белок-белковые взаимодействия, а именно ассоциация и диссоциация. Существуют ферменты, представленные олигомерами, причём некоторые активны в третичной структуре, а в четвертичной неактивны, а другие, наоборот. Пример. Протеинкиназа-А имеет 2 каталитические и 2 регуляторные субъединицы, соединённые вместе, в такой форме фермент неактивен, но если к регуляторным субъединицам присоединится цАМФ (циклический аденозинмонофосфат), то они изменят конформацию и фермент продиссоциирует, став активным – активация диссоциацией. Есть фермент ацетил-КоА-карбоксилаза, который, будучи тетрамером, неактивен, но если на него подействовать лимонной кислотой, то он полимеризуется до состояния 20-ти субъединиц и становится активным – активация путём ассоциации. Данный способ регуляции является обратимым.
Аллостерическая активация. Здесь я подробно расскажу про алостерические ферменты. Данный способ регуляции является обратимым. Обычно это сложные олигомерные ферменты, их отличительной чертой является наличие регуляторных субъединиц, на которых расположены аллостерические центры, к которым присоединяются эффекторы – молекулы, которые при присоединении к этому центру меняют конформацию всего фермента, увеличивая или уменьшая активность фермента, соответственно, эффекторы бывают положительными и отрицательными. Кооперативные изменения: эффектор присоединяется к аллостерическому центру, меняет конформацию регуляторной субъединицы, она меняет конформацию каталитической субъединицы, меняется конформация активного центра и его способность катализировать реакцию – меняется активность фермента. Какие ферменты обладают аллостерической регуляцией? Не все – только самые важные, то есть если у вас в каком-то
39
процессе цепочка из восьми реакций, плюс эта цепочка разветвляется, то аллостерическими будут первые и последние ферменты, ферменты, стоящие на разветвлении цепочек реакций, и ферменты, катализирующие самые медленные реакции. Кто выступает в роли эффекторов? Обычно это АТФ/АДФ, НАДН2/НАД и конечные продукты цепочек химических реакций. Почему они? Ну у нас реакции в метаболизме реакции разделены на катаболитические, которые обеспечивают нас энергией, и анаболические, которые требуют расхода энергии. Если в клетке много АДФ и НАД, это говорит о том, что энергии в клетке осталось мало, поэтому надо активировать все реакции катаболизма, чтобы получить эту энергию, и надо ингибировать все реакции анаболизма, чтобы не тратить энергию, которой в клетке и так нет. АТФ и НАДН2 свидетельствуют о том, что в клетке полно энергии, поэтому реакции катаболизма можно ингибировать, ибо они пока не нужны, а реакции анаболизма теперь мы можем себе позволить активировать. После прохождения темы биоэнергетики фишка с АТФ/АДФ и НАДН2/НАД станет куда понятнее, но пока постарайтесь запомнить. Почему конечные продукты цепочек реакций являются эффекторами, причём отрицательными (ретроингибирование)? Дело в том, что все молекулы в нашем организме нужны, но только в определённом количестве, т.е. без перебора, поэтому, когда цепочка реакций насинтезирует достаточно много продукта, она должна во время остановиться, среагировав на концентрацию
продукта. Пример фермента, регулируемого алостерически: фосфофруктокиназа активируется АМФ, НАД, ингибируется АТФ и НАДН2, правда это не все эффекторы, есть ещё, но вам пока рано их знать (подробности в теме углеводов), это ключевая реакция гликолиза (катаболизм глюкозы).
Химическая модификация. Химическую модификацию ферментов осуществляют другие ферменты, они могут присоединять метильную, ацетильную, убиквинтильную группу или остаток фосфорной кислоты. Данный способ активации ферментов является обратимым. Самый
популярная из перечисленных разновидностей – фосфорилирование/дефосфорилирование. В чём его особенность? У фермента есть на поверхности радикалы незаряженных полярных аминокислот с гидроксильной группой, к ней присоединяют отрицательно заряженную сильно полярную фосфорную кислоту, ну или отсоединяют, при это очень сильно меняется поверхностный заряд фермента, гидратация, растворимость, конформация и активность. Ферменты, осуществляющие фосфорилирование, называются киназами (протеинкиназами), ферменты, осуществляющие дефосфорилирование, называются фосфотазами
(фосфопротеинфосфатазами). Какие-то ферменты активны в фосфорилированном состоянии, а какие-то в дефосфорилированным – в зависимости от их аминокислотного состава. Пример: гликогенсинтаза
40
