
bkh_dlya_tebya
.pdf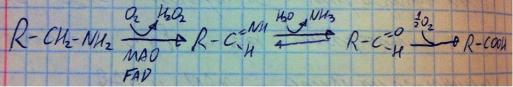
(моноаминоксидаза) и ДАО (диаминоксидаза), деактивирующие биогенные амины. Схема реакций приведена ниже – освежите память.
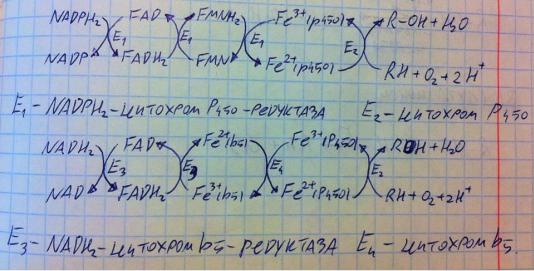
А теперь подробно о микросомальном окислении. Оно функционирует за счёт двух ферментативных систем. Первая – на основе цитохрома P450, а вторая на основе цитохрома b5. Рассмотрим первую систему (схема реакций описана ниже). Фермент NADPH2-цитохром-P450-редуктаза забирает электроны (ну и протоны, но это менее важно) у НАДФН2, переносит на ФАД,
а с того на ФМН, а с ФМН на железо в составе цитохрома P450 (имеет заряд +3, но получает отрицательный электрон, поэтому заряд падает до +2). Что делает цитохром P450? Он является ферментом, который берёт молекулу кислорода, разрывает её на два атома, одному атому он отдаст электроны от НАДФН2, чтобы атом приобрёл заряд -2, присоединил протоны и превратился в воду, а второй атом кислорода просто встроится в молекулу ксенобиотика и образует гидроксильную группу. Вуаля, готово. Как работает система цитохрома b5? NADH2-цитохром-b5-редуктаза забирает электроны у НАДН2, переносит их на ФАД, а с ФАД на сам цитохром, а именно, на железо в его составе. После этого обычно цитохром b5 передаёт электроны нацитохром P450, а тот делает уже известную реакцию, но цитохром b5 тоже может самостоятельно участвовать в окислении, например, при синтезе ненасыщенных жирных кислот (вспоминайте липидный обмен). Однако же в основном непосредтвенное окисление осуществлет цитохром P450. Но ксенобиотиков невероятно много разновидностей. Как с ними справится один цитохром? Ксенобиотиков много разных, но у них есть общие структурные участки, для каждого такого участка есть свой вариант цитохрома P450, т.е. этих цитохромов очень много – ксенобиотикам хватает. Данный цитохром является важнейшим элементом детоксикационной системы, потому что он окисляет большинство ксенобиотиков и позволяет им вступать в конъюгацию за счёт новообразованной гидроксильной группы, так что с ним вы должны быть очень хорошо знакомы.
231
Надо также сказать, что некоторые ксенобиотики активируют синтез цитохрома P450, например, барбитураты, полициклические ароматические углеводороды, спирты, кетоны, некоторые стероиды. А что это значит на практике? Это значит привыкание к препарату (не путать с зависимостью). В чём это выражается? Допустим, пациент начал приём препарата, готорому нужно 3 часа, чтобы начать оказывать терапевтический эффект, а через 8 часов препарат полностью обезвреживается и выводится, в итоге полезный эффект 5 часов. Но спустя какое-то время курса препарата под него начинает вырабатываться много цитохрома P450 и препарат обезвреживается за 3 часа, не успевая оказать терапевтического эффекта, поэтому приходится повышать дозу препарата, чтобы он не так быстро обезвреживался и успевал подействовать, и вот вы всё повышаете и повышаете, а это не очень хорошо, большая нагрузка на печень и, возможно, почки, поэтому если в течение какого-то времени препаратом не удалось вылечить (во время курса дозу приходилось повышать до определённого предела), то препарат заменяют на другой. Но раз уж мы заговорили о фармацевтических препаратах и печени, то каково значение печени в обороте препаратов? Во-первых, печень обезвреживает и выводит многие препараты. Во-вторых, печень может обусловливать привыкание к препаратам. В-третьих, печень может осуществлять биоактивацию препаратов. Это как? Ну некоторые препараты попадают в организм неактивными, печень их модифицирует, превращая их
в активное вещество с терапевтическими свойствами. Например, имипрамин, лишаясь метильной группы, превращается в дезметилимипрамин (антидепрессант), а ипразид (антидепрессант), лишаясь изопропильного участка, превращается в изониазид (противотуберкулёзный препарат). Ну и в-четвёртых, печень может расщеплять некоторые малотоксичные препараты на вещества, которые обладают куда большей токсичностью, чем исходное вещество – это фиаско, конечно, но так бывает. Я говорил об активаторах синтеза цитохрома P450, но есть и ингибиторы,
232

например, фенобарбитал и ионы тяжёлых металлов в высокой концентрации.
Теперь можно поговорить о втором этапе – конъюгации. Для малополярных молекул, которые получили гидроксильную группу после микросомального окисления, предусмотрено присоединение особо полярных молекул для снижения токсичности и увеличения полярности для более эффективного выведения из организма, такими высокополярными молекулами являются глюкуроновая кислота, серная кислота, глютатион, таурин, глицин.
Разберём три частных случая. Первый случай – присоединение глюкуроновой кислоты с помощью УДФ-глюкуроновой кислоты и УДФглюкуронилтрансферазы. Второй случай – присоединение сульфата с помощью фосфо-аденазин-фосфо-сульфата ФАФС и сульфатрансферазы. Третий случай предполагает разрыв молекулы ксенобиотика с помощью глутатиона и его попутное присоединение. Если же ксенобиотик гидрофилен, но токсичен, то мы можем метилировать или ацетилировать его, чтобы снизить токсичность.
И последняя тема для печени, довольно занятная – это токсическое действие алкоголя и обезвреживание этанола в печени.
Сам по себе этанол в определённых концентрациях способен вызывать обратимую денатурацию белка и проникает через мембраны клеток простой диффузией, а такой господин нашему организму не нужен, поэтому организм старается от него избавиться. Обезвреживание происходит в несколько этапов. Сначала спирт превращается в альдегид. Для этого существует специальный фермент алкогольдегидрогеназа, который забирает водороды
с помощью НАД и превращает этанол в ацетальдегид, данный фермент является индуцибильным, т.е. если вы много пьёте, то печень начинает больше вырабатывать этого фермента, хотя у части людей данный фермент в связи с мутацией менее активен, поэтому скорость обезвреживания у них очень низкая, этанол накапливается в организме и быстро вызывает опьянение.
233
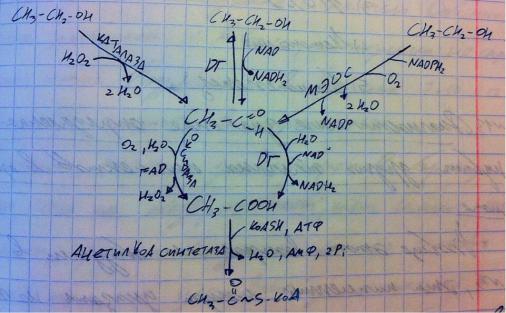
Однако для первого этапа существуют две вспомогательные реакции, настолько важно организму избавиться от этанола! Вторая реакция – каталаза забирает водороды у этанола, превращая его в ацетальдегид, этими водородами она превращает перекись водорода в две воды. Ну и третья реакция осуществляется микросомальной этанол окисляющей системой МЭОС с помощью цитохрома P450, но, если вы вспомните, данный цитохром позволяет только гидроксилировать молекулы, а не отщеплять водород. Тогда как это работает? А всё просто, на самом деле цитохром действительно приделывает гидроксильную группу к этанолу, вот только один атом углерода не способен содержать две гидроксильные группы (одна изначально была, а вторую сделал цитохром), поэтому от него отщепляется вода, а остаётся карбонильная (альдегидная группа). Итак, на первом этапе мы превратили этанол в ацетальдегид, этот этап у людей без соответствующей мутации протекает довольно активно, поэтому если вы пьёте этанол постепенно, то все поступающие порции быстро успеваются обезвредиться. Однако ацетальдегид тоже токсичен, поэтому на втором этапе его превращают в уксусную кислоту двумя способами. Первый вариант: дегидрогеназа отщепляет водород от воды и альдегида с помощью НАД, от воды остаётся гидроксил, который присоединяется к остатку альдегида – образуется вода. Второй способ: оксидаза спаивает воду с молекулой кислорода (ксантиноксидаза тоже этим грешила), получая перекись водорода и атом кислорода, который встраивает в альдегид, превращая его
в кислоту. Второй этап протекает не так быстро, как первый, поэтому если перебарщивать с алкоголем, то ваша печень будет полна альдегидов. Но уксусная кислота тоже не шибко полезна и не шибко нужна, поэтому третьим этапом её превращают в ацетил-КоА с помощью ацетил-КоА-синтетазы с затратой АТФ, причём гидролиз идёт до АМФ, как и для активации всех карбоновых кислот. Ацетил-КоА уже не токсичен. Мы сказали, что сам этанол
234
токсичен, но токсично ли то, что образуется при его обезвреживании? Ну вообще-то да – последствия есть. Во-первых, ацетальдегид, если его много, начинает неферментативно ацетилировать все белки печени, в том числе ферменты, инактивируя их, если что, печень – центральный орган в метаболизме липидов, белков и углеводов, а вы инактивируете её ферменты
– последствия могут быть самыми разнообразными. Причём запомните, что первый этап работает-то быстро, а второй медленно, поэтому если много выпить, то очень быстро образуется много ацетальдегида, а в уксусную кислоту он превратится совсем не быстро, поэтому он будет копиться и отравлять печень, инактивируя её ферменты. То есть если принимать алкоголь в таких небольших количествах, чтобы не накапливался ацетальдегид, то печень будет страдать минимально, вот поэтому у жителей некоторых европейских стран нет поголовных проблем с печенью, хотя они и пьют каждый день, просто пьют всего по два бокала вина. Во-вторых, если вы обратили внимание, в двух реакциях выделяется НАДН2, его излишнее образование приводит к смещению равновесия в некоторых обратимых реакциях, например, большая часть пирувата превращается в лактат, что мешает глюконеогенезу (ему-то пируват для реакций нужен), а ещё диоксиацетонфосфат преимущественно превращается в глицерол-3-фосфат, который необходим для синтеза ТАГ. В-третьих, лишний ацетил-КоА идёт на синтез жирных кислот, в итоге, глицерол-3-фосфат и жирные кислоты дают повышенное образование ТАГ в печени, что может привести к жировому перерождению печени и в дальнейшем к некрозу. Теперь вы знаете, что этанол сначала опьяняет тело (не очень-то полезно), а затем жёстко нарушает работу печени, что отражается потом на всём организме, ведь печень – центральный орган в обмене белков, жиров и углеводов. Так что пейте алкоголь в меру или редко, хотя лучше бы вообще не пить, но раз уж пьёте, то хотя бы принимайте побольше липотропных веществ, чтобы печень вырабатывала больше фосфолипидов, а не ТАГ – предупредите жировое перерождение печени и ряд соответствующих патологий.
Мы закончили раздел печени. Надеюсь, вы осознали, насколько это важный орган, и поняли, что к нему нужно относиться с уважением и необходимо его беречь. Не надо заваливать её алкоголем и таблетками без необходимости – этим вы можете сократить свою предполагаемую продолжительность жизни на десятки лет!
235
Биохимия соединительной ткани
Соединительная ткань имеет множество разновидностей, которые отличаются функциями и составом, однако общим для всех соединительных тканей является то, что межклеточного вещества в них гораздо больше, чем клеток, и функции этих тканей обусловливаются межклеточным веществом. Основная же функция соединительных тканей структурная, т.е. они формируют окружение, базу для других тканей, соединительная ткань объединяет остальные, она также может формировать основу целого органа,
в общем соединительная ткань – это универсальный строительный материал, которого где только нет, а её функции обусловлены межклеточным веществом, поэтому с точкти зрения биохимии нас будет интересовать именно межклеточное вещество. Межклеточное вещесвто можно разделить на основное вещество и волокна. Основное вещество как раз формирует студнеобразную среду для клеток, оно состоит из воды, минералов, гликозамингликанов и протеогликанов. Поговорим подробнее о протеогликанах и гликозамингликанах.
Гликозамингликаны – это линейные (не ветвятся) гетерополисахариды, которые складываются из дисахаридов, состоящих из гексуроновой кислоты
исахарида, имеющего аминогруппы и эфиры разных кислот. Выделяют 6 классов гликозамингликанов ГАГ в связи с осбоенностями строения: гиалуроновые кислоты, хондроитин-4-сульфат, хондроитин-6-сульфат, кератан-сульфат, дерматан-сульфат, гепарин-сульфат. А есть ещё и протеогликаны – это ГАГ + одноцепочечный (мономерный) белок (доля углевода 90-95%, а белка 5-10%). Именно ГАГ и протеогликаны позволяют межклеточному веществу становиться студнеобразным и накапливать воду, они выполняют структурную (основа), фильтрационную (между ними не пролезут слишком большие молекулы или молекулы определённого заряда)
итрофическую (они очень гидроильные, поэтому много воды и по межклеточному веществу хорошо распространяются питательные вещества, которые могут спокойно дойти от сосуда до удалённой клетки) функции. Эти белки и углеводы составляют основу межклеточного вещества. Но, помимо них есть ещё и волокна – коллагеновые и эластиновые -фибрилярные структуры, которые тоже выполняют определённые функции.
Коллагеновые волокна. Они специфичны для соединительной ткани. Почему? Во-первых, коллаген есть только в соединительной ткани, так как он выполняет структурную функцию – это очень прочные на разрыв волокна, они нерастяжимы, во-вторых, у коллагена есть 19 типов, т.е. он специфичен для разных типов соединительной ткани и конкретных органов, поэтому коллаген иногда может быть визитной карточкой, маркером каких-то тканей, органов. Поговорим о структуре. Коллагеновый белок состоит из 3-х
236
альфацепей, скрученных в тройную спираль. В витке альфа-спирали альфацепи не 3,5 аминокислоты, как у обычных белков, а всего 3, это обусловлено особенностями химического состава. В цепях коллагена каждая третья аминокислота – глицин, 25% пролина и 4-гидроксипролина, 11% аланина, присутствует 5-гидроксилизин. Если у обычных белков альфа-спираль формируется водородными связями, то у коллагена спираль формируется изза стерического (пространственного) отталкивания пролинов друг от друга. А вот альфа-цепи образуют тройную спираль (три полипептида, закрученные в альфа-спирали, образуют тройную спираль, закручиваясь друг вокруг друга) за счёт водородных связей друг между другом. Теперь поговорим о синтезе коллагена и сборке коллагеновых фибрилл. Сначала синтезируется полипептидная цепь, к ней тут же подходят пролил-4-гидроксилазы, которые делают гидроксипролин (без него коллаген не коллаген), и лизил-5- гидроксилазы, которые делают гидроксилизин (связывает коллаген в фибриллу ковалентными связями, без него бы фибрилла развалилась), оба фермента используют для реакции косубстрат витамин С (аскорбиновая кислота). Цепи начинают сворачиваться в альфа-спирали, после чего происходит гликозилирование пептидов для большей гидрофильности. Гликозилированные пептиды, свернувшиеся в альфа-спирали, начинают скручиваться в спирали из трёх пептидов, однако пептиды имеют избыточные участки цепей (пептид слишком длинный), это не даёт коллагену полимеризоваться в клетке. Коллаген выходит из клетки, ферменты ограниченным протеолизом убирают избыточные участки цепей, коллаген начинает полимеризоваться, при этом коллагены связываются друг
с другом ковалентными (очень прочными) связями, образованными соединением лизина с гидроксилизином, которое приводит к образованию шифовых оснований. Коллагены накладываются друг на друга со смещением на одну четверть длины. Итак, получается ковалентно сшитая фибрилла из кучи перекрученных жёстко связанных белков – это очень прочная структура, именно она делает соединительную ткань прочной и мало рвущейся. Ниже предлагаю вам схему синтеза и созревания коллагеновых фибрилл.
237

Нужно сказать, что со временем коллаген повреждается, поэтому он периодически требует обновления, кластические клетки соединительной ткани (хондрокласты, остеокласты, фиброкласты) разрушают коллаген гидролитическими ферментами, чтобы потом на их месте бластические клетки могли синтезировать новые целые коллагеновые фибрилы. Примечательно, что при разрушении коллагена часть гидроксипролина катаболизируется, а часть прям так выделяется с мочой, по количеству гидроксипролина в моче можно судить об уровне катаболизма коллагена, изменение которого может свидетельствовать о ряде болезней.
Теперь эластин. Это уникальный белок, в его составе в основном гидрофобные аминокислоты (глицин, валин, аланин, пролин), за счёт чего все они хотят спрятаться от воды, но одновременно они этого сделать не могут – их слишком много, прячутся то одни, то другие, какого-то единственного наиболее выгодного положения нет, поэтому у этого белка нет постоянной вторичной и третичной структуры, у него несколько конформаций, постоянно сменяющих друг друга, за счёт такой подвижности белок обретает уникальное свойство – эластичность. Однако эластин имеет в
238
своём составе много лизина, потому что его радикалы могут объединяться и образовывать ковалентные сшивки, чтобы единичные эластиновые белки объединялись в волокно. Эластиновые волокна придают соединительной ткани эластичность, т.е. она может растягиваться, а потом восстанавливать форму, т.е. она подвижна, а это важно, потому что почти всё в нашем организме постоянно меняет форму под различными физическими воздействиями, поэтому важно, чтобы соединительная ткань была эластична
и позволяла совершать такие движения, ибо как, например, у нас функционировали лёгкие и сердце, да и аорта без эластичности?
Итак, ГАГ и протеогликаны формируют основу соединительной ткани, коллаген даёт ей высокую прочность, а эластин – эластичность.
239
Биохимия мышечной ткани.
Мы будем обсуждать скелетную и сердечную мускулатуру. Эти ткани имеют задачу создать несложный по строению орган – мышцы (совокупность мышечных волокон (волокон, а не клеток, другое название – миосимпласт, так корректнее с точки зрения гистологии, так что у скелетных мышц мышечные волокна, а у сердца кардиомиоциты), имеющих общее направление, обёрнутых в соединительную ткань), которые имеют одну основную задачу – сокращение. Конечно, есть и другие клетки, способные к сокращению и изменению формы, но только мышечная ткань позволяет формировать полноценные сократительные органы. Межклеточного вещества в мышцах мало – в основном клеточный материал. В первую очередь разберём белковый состав ткани, который скажет нам о ней всё, что нужно, а потом немного о метаболизме.
Итак, белки мышечной ткани условно подразделяют на три группы: миофибриллярные, сакроплазматические, стромальные. Внутри мышечных волокон/кардиомиоцитов очень много места занимают особые надмолекулярные структуры – миофибриллы – именно они и позволяют клетке сокращаться, то есть это главные элементы мышечной ткани, они состоят из следующих компонентов: миозин, актин, тропомиозин, тропонин. Саркоплазматические белки – это белки, которые находятся в клетке, помимо миофибриллярных, эти белки поддерживают жизнедеятельность клетки, примеры: ферменты (понятно, они делают всё, на них весь метаболизм, без которого бы ничего не работало), миоглобин (запасает кислород для мышц, которого им вечно не хватает), миоальбумин, кальций связывающий белок, Ca-АТФаза (её значение вы узнаете чуть позже). Стромальные белки находятся вне клетки и выступают мышечным аналогом соединительной ткани, примеры белков: коллаген подобные, эластин подобные белки, гликопротеины и протеогликаны. Но, как я и сказал, основную функцию мышц обеспечивают именно миофибриллярные белки, поэтому их мы должны разобрать подробно.
Миозин состоит из 6-ти протомеров: 2 тяжёлые цепи, 2 шарнирных участка, 2 головки. Актин существует G-форма и F-форма, G-форма представлениа одиночными протомерами, а F-форма – это протомеры, объединённые в двойную спираль. На каждом протомере актина есть два участка связывания с другими актинами, что позволяет им полимеризоваться (нужно для построения фибрилл), но есть и один центр для взаимодействия с миозином.
240
