
bkh_dlya_tebya
.pdf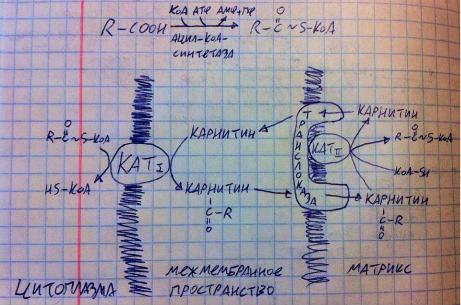
нехватки энергии в клетке – логично включить бета-окисление, чтобы её получить). Карнитин является витаминоподобным веществом. Если планируете худеть, сжигая жиры, то вам поможет карнитин.
Теперь обсудим само бета-окисление. Это спиральный метаболический путь, сами увидите, почему. На ацил-КоА действует ацил- КоА-дегидрогеназа, она забирает водороды у 2-го и 3-го углеродов с помощью ФАД (этот фермент встроен во внутреннюю мембрану митохондрий и с помощью КоQ сообщается с цитохром-редуктазой (3-й комплекс дыхательной цепи), продукт реакции – еноил-КоА. На еноил-КоА действует еноил-КоА-гидратаза, которая присоединяет к двойной связи воду так, чтобы гидроксильная группа образовалась именно на 3-м углероде, он же бета-углерод, отсюда и название «бета-окисление», получается бета- гидроксиацил-КоА, на него действует одноимённая дегидрогеназа с помощью НАД – получается бета-кетоацил-КоА и НАДН2. На бета-кетоацил- КоА действует тиолаза, которая отрывает от молекулы ацетил-КоА, а в место разрыва присоединяет КоА, образуя новый ацил-КоА, но уже короче на 2 углерода, который снова пройдётся по этим реакциям, т.е. цикл реакций повторяется, но вступающий в них ацил-КоА каждый раз другой, ибо становится короче, поэтому метаболический путь не циклический, а спиральный. Эти 4 реакции на самом деле очень логичны. Поясню. У вас есть очень длинный углеводород, вы должны от каждого второго углерода отщипить водород, получив при этом энергию (задача дегидрогеназ), и присоединить кислород (гидратаза в помощь), чтобы получить ацетилы, к которым останется только присоединить КоА с помощью тиолазы, в итоге, мы окисляем длинный углеводородный хвост у кислоты, чтобы порезать её на двухуглеродные компоненты – ацетил-КоА.
191

Поговорим об энергетике. В процессе одного цикла реакций (4 реакции) образуется ФАДН2 (2 АТФ), НАДН2 (3 АТФ) и ацетил-КоА (12 АТФ), т.е. один цикл нам даёт 17 АТФ. Как понять, сколько циклов приходится на одну молекулу кислоты? в каждом цикле отщепляется двухуглеродный фрагмент, поэтому число углеродов кислоты разделить на 2, но ещё надо вычесть 1. Почему? А потому, что в обычном цикле образуется ацил-КоА и ацетил-КоА, ацетил-КоА отправляется в ЦТК, а ацил-КоА отправляется в новый цикл реакций, но, когда в цикл реакций вступит четырёхуглеродный ацил-КоА, он распадётся не на ацетил-КоА и ацил-КоА, а на два ацетил-КоА, а ацетил-КоА в цикл реакций не вступит, поэтому, когда мы считаем циклы, мы вычетаем единицу из частного (nC : 2 – 1). Однако в последнем цикле у нас образуется лишний ацетил-КоА (12 АТФ даёт), поэтому к общей формуле надо добавить 12, а потом вычесть 1 АТФ, так как в своё время на активацию кислоты мы потратили АТФ. Но это ещё не всё, всё, что я описал, справедливо для насыщенных жирных кислот. А что происходит с ненасыщенными? В случае с насыщенными жирными кислотами нам приходилось с помщью ФАД делать двойную связь, а в ненасыщенных жирных кислотах она как бы уже есть, а это значит, что дегидрогеназа пропускает свой ход и ФАДН2 не образуется, т.е. каждая пи-связь в жирной кислоте - это минус 2 АТФ. Но в бета-окислении двойная связь должна быть между 2-м и 3-м углеродами, а в ненасыщенной жирной кислоте она может быть между 3-м и 4-м, тогда приходит еноил-КоА-изомераза и переносит
192

двойную связь в нужное место. Итак, для подсчёта энергетического эффекта полного окисления жирной кислоты необходимо найти число циклов, разделив число углеродов в кислоте на 2 (ибо в бета-окислении мы рубим кислоты на двухуглеродные куски) и вычесть 1 (ибо в последнем цикле не образуется ацил-КоА, который мог бы поступить в положенный ему цикл, вместо этого образуется лишний ацетил-КоА), затем прибавляем 12 (лишний ацетил-КоА в последнем цикле), вычитаем 1 (активация жирной кислоты требует АТФ), затем вычитаем число пи-связей, умноженное на 2 (каждая писвязь – один неиспользованный ФАД – упущенные 2 АТФ). Общая формула и её применение для конкретных случаев на рисунке ниже.
Пару примечаний по бета-окислению жирных кислот. Как я и сказал, ТАГ и, соответственно, жирные кислоты используются как второстепенный источник энергии, а первичный – глюкоза. То есть бета-окисление заметно активируется, когда запасы гликогена истощены, т.е. при продолжительном голоде или продолжительным аэробных физических нагрузках. Почему нагрузки должны быть продолжительными? Гликоген в мышцах заканчивается примерно через 20 минут, только после этого мышцы выкачивают глюкозу из крови, а другим органам, кроме мозга, приходится
193
питаться жирными кислотами – включается бета-оксиление. Почему нагрузки должны быть аэробными, т.е. с хорошим доступом кислорода? Да потому, что в бета-окислении образуются НАДН2 и ФАДН2, энергия от которых может быть получена только в ЦПЭ, а образующийся ацетил-КоА должен поступать
в ЦТК, который тоже не работает без ЦПЭ, а ЦПЭ не работает без кислорода. Таким образом, бета-окисление вообще не работает без кислорода, по этой причине его нет в скелетных мышцах, зато есть в сердечной мышце, ибо, вопервых, она прекрасно снабжена кислородом (каждый кардиомиоцит контактирует с капилляром), во-вторых, полное окисление жирных кислот даёт энергии больше (147 АТФ от стеариновой), чем глюкоза (38 АТФ).
Кетоновые тела
Однако напомню, что происходит в постабсорбтивный период. Сначала все ткани питаются глюкозой от мобилизации гликогена, затем его запасы истощаются, поставлять глюкозу в кровь начинает глюконеогенез в печени, но этого становится мало, поэтому мобилизуется ТАГ – мышцы и мозг потребляют только глюкозу, остальные ткани потребляют немного глюкозы (если мозг и мышцы им оставят), глицерол и жирные кислоты. Но что происходит в печени? В печени одновременно идёт глюконеогенез (только в ней) и бета-окисление, но проблема в том, что глюконеогенез на свои нужды забирает из ЦТК оксалоацетат, поэтому ЦТК частично ингибируется, а тем временем бета-окисление вырабатывает много ацетил-КоА, который должен поступать в ЦТК, но не весь ацетил-КоА успевает попасть в ЦТК, ибо тот ингибирован, тогда печень из лишних ацетил-КоА синтезируют кетоновые тела, которые выбрасывают в кровь, чтобы ими питались другие ткани, мозг
в том числе, ибо в этих тканях нет глюконеогенеза и ЦТК не тормозит – они могут нормально катаболизировать весь ацетил-КоА. Причину, по которой происходит синтез кетоновых тел, надо знать, ещё надо знать, что они синтезируются только в печени по той же причине (только в ней сочетаются глюконеогенез и бета-окисление). Получается, что кетоновые тела – третий источник энергии для тканей, он замещает глюкозу и помогает хоть как-то бороться с гипогликемией (ткани, вместо глюкозы, едят их). Итак, как же синтезируются кетоновые тела? Реакции не очень простые, поэтому я выделил разные молекулы разными цветами, чтобы вы понимали, что куда. Уже знакомая вам тиолаза катализирует обратную реакцию, т.е. отсоединяет один КоА от одного ацетила и присоединяет его к другому ацетилу-КоА – получается ацетоацетил-КоА, на него действует ГМГ-КоА-синтаза, которая берёт новый ацетил-КоА, гидролитически отсоединяет КоА, образует уксусную кислоту, которую присоединяет к синему углероду, а с помощью водорода превращает кетогруппу в гидроксильную – получается 3-гидрокси- 3-метил-глутарил-КоА (ГМГ-КоА), на эту молекулу действует одноимённая лиаза, которая отщепляет зелёный ацетил-КоА, но ему не хватает водорода,
194

поэтому один отщепляется от гидроксильной группы, чтобы та превратилась
в кето-группую, получается ацетоацетат – первый представитель кетоновых тел. Так как бета-окисление снабжает нас не только ацетилом-КоА, но и НАДН2, дегидрогеназа бета-гидроксибутирата с помощью НАДН2 презентует водород ацетоацетату, чтобы тот превратился в бета-гидрокси-бутират (второй представитель кетоновых тел). Однако приведённые кетоновые тела являются кислотами, поэтому большое их количество в крови может привести к ацидозу, но есть необычный механизм защиты. А именно, если образуется слишком много ацетоацетата, он неферментативно декарбоксилируется, превращаясь в ацетон, который является крайне летучим веществом, которое очень хорошо выводится из тела с мочой и через слизистые.
Схема реакций синтеза кетоновых тел приведена ниже.
Как я и сказал, кетоновые тела синтезируются в печени при одновременном протекании глюконеогенеза с бета-окислением жирных кислот при условии истощения запасов гликогена. Когда такое случается? Вопервых, при длительном голоде, во-вторых, при длительных аэробных физических нагрузках, в-третьих, при голоде, являющимся следствием гликогенозов. Но также есть особый случай, когда происходит кетогенез, это сахарный диабет 2-го типа. Что при нём происходит? Жировая ткань и, возможно, мышечная не утилизируют глюкозу, печень уже заполнилась гликогеном – дальше некуда, поэтому всю лишюю глюкозу, в том числе ту,
195

которую должны были утилизировать жировая и мышечная ткань, превращает в жирные кислоты и холестерол, при этом образуя ацетил-КоА как исходное вещество для их синтеза, но ацетил-КоА так много, что часть его просто пускается на синтез кетоновых тел. Итак, в норме в крови и моче кетоновых тел нет, но если вы голодаете серьёзно, занимаетесь продолжительными аэробными нагрузками, у вас гликогеноз или сахарный диабет 2-го типа, то у вас появляются кетоновые тела в крови (кетонемия) и в моче (кетонурия), если их будет много в крови, наступит ацидоз (кетацидоз), так что эти состояния надо контролировать. Это кстати одна из причин серьёзных обострений при диабете – съели много сладкого, спустя какое-то время начался кетогенез, за ним кетацидоз, а это уменьшает сродство гемоглобина к кислороду, мозг испытывает гипоксию, а он этого очень не любит, поэтому с ним начинаются проблемы.
А теперь разберёмся, как именно ткани катаболизируют кетоновые тела на примере бета-гидроксибутиратом (его образуется существенно больше, чем ацетоацетата, а ацетон не катаболизируется).
Бета-гидроксибутират (это же касается ацетоуксусной кислоты, она же АУК или ацетоацетат) является карбоновой кислотой и, как жирные, требует активации. Для этого существует 2 пути. Первый – обмен с сукцинилом-КоА с помощью трансферазы (переход сукцинил-КоА в сукцинат, минуя ЦТК, означает отсутствие синтеза в нём ГТФ). Второй – активация через бета- гидроксиацил-КоА-синтетазу с затратой АТФ. Получили бета-гидроксиацил- КоА, который можно пустить в бета-окисление – сначала на него действует дегидрогеназа – получается НАДН2 и бета-кетоацил-КоА, последний разлагается тиолазой и КоА на два ацетила-КоА. НАДН2 даст 3 АТФ, каждый ацетил-КоА даст по 12 АТФ, но на активацию потрачено 1 АТФ, энергетический эффект с бета-гидроксибутирата 12*2+3-1=26 АТФ. В те же
196

реакции мог бы вступить ацетоацетат, но без образования НАДН2, поэтому его эффект на 3 АТФ меньше, т.е. 23 АТФ. Подводя итоги, чем питаются различные ткани в затянувшийся постабсорбтивный период? Скелетная мускулатура только на глюкозе (гликогенолиз, анаэробный гликолиз), ибо там нет кислорода почти, поэтому жирные кислоты и кетоновые тела мышцы не катаболизируют (нет кислорода – не работает ЦПЭ, а значит, и бетаокисление с ЦТК молчат). Мозг питается глюкозой (в основном ею, причём в большом количестве) и кетоновыми телами (чтобы не съедать слишком много глюкозы, которой и так мало при затянувшемся постабсорбтивном периоде). Все остальные ткани питаются в основном жирными кислотами, глицеролом и кетоновыми телами, могут и глюкозой, но мозг и мышцы съедают почти всю глюкозу.
Ещё один важный вопрос:
Связь углеводного и липидного обменов
Мы уже не раз говорили, что глюкоза в ПФП даёт НАДФН2, а в гликолизе ПВК, который в ПДК даёт ацетил-КоА, из ацетил-КоА и НАДФН2 синтезируются жирные кислоты и холестерол, также из гликолиза получается ДАФ, из которого выходит глицерол-3-фосфат, который, соединяясь с жирными кислотами, даёт ТАГ (но вообще глицерофосфолипиды тоже синтезируются из глюкозы, во всяком случае ДАГ-3-фосфат, из которого дальше лепят глицерофосфолипиды). То есть из углеводов синтезируются липиды, тем самым помогая в поддержании гомеостаза глюкозы, ибо синтез липидов – способ утилизации глюкозы. Плюс ко всему, глицерол, жирные кислоты и кетоновые тела являются альтернативным источником энергии, замена глюкозы. Эти альтернативные источники заменяют многим тканям глюкозу, чтобы те стали меньше её выкачивать из крови, тем самым предотвращая критическую гипогликемию. Вот это три основных пункта связи между липидным и углеводным обменом.
Теперь, познакомившись с липидным, углеводным и белковым обменом, мы можем поговорить о диетах, направленных на похудение, а
197
вегетерианскую диету мы обсуждали в белковом обмене. Какие моменты в составлении диеты нужно учитывать? Во-первых, нельзя ограничивать белки. При нормальном их потреблении они почти не выполняют энергетической функции, зато выполняют множество других. Конечно, заменимые кислоты будут синтезироваться из липидов и углеводов, но незаменимые – нет, поэтому печень начнёт разрушать белки крови и, возможно, мышц, чтобы достать незаменимые аминокислоты, в этом случае наблюдается дисфункция крови и мышц. Во-вторых, углеводы ограничить можно, но делать это стоит в основном за счёт быстрых (именно они дают большой скачок уровня глюкозы и необходимость превращать её в ТАГ/нейтральные жиры, а медленные углеводы поступают постепенно и превращаются в основном только в гликоген). В-третьих, ограничивать жиры можно, но не полностью (без жиров не всасываются жирорастворимые витамины, а это грозит соответствующими авитаминозами, т.е. проблемы со зрением, кожей, остеопороз, проблемы с половой системой, свёртываемостью крови, окислительный стресс с соответствующими заболеваниями. Ограничивать стоит животные жиры. Следуя вышеперечисленным мерам, вы снижаете образование ТАГ, а его потребление оставляете прежним, в итоге, общее количество ТАГ в организме уменьшается. Но это медленно, а как ускорить процесс? Можно повысить сжигание ТАГ (жирных кислот) через активацию бета-окисления, которое активируется при длительном голодании или при продолжительных (более 20-ти минут, чтоб гликоген закончился и активировался расход липидов) аэробных (бета-окислению нужен кислород) нагрузках, а, чтобы бета-окисление работало лучше, принимайте карнитин (витаминоподобное вещество, транспорт жирных кислот в митохондрию). Однако не перебарщивайте со снижением калорий, продолжительными голодом и тренировками, потому что может наступить кетацидоз (выше обсуждалось, почему). К слову о аэробных нагрузках, в спортивных залах часто ограниченный приток воздуха, поэтому нагрузки анаэробные, бетаокисление работает мало, жиры не сжигаются, и вы работаете зря, поэтому самый безотказный вариант – улица. И касательно самих нагрузок. Если ваша цель – сжигание калорий, то вам нет необходимости развивать все мышцы (наращивание мышц приводит к вашему быстрому утомлению и небольшим энергозатратам, т.е. вы почти не худеете) – лучше натренировать ноги и пользоваться только ими (после того, как вы их натренируете, сможете долго пользоваться ими без утомления, сжигая кучу калорий). То есть самый эффективный и доступный вариант – бег на улицы, а зимой можно лыжи. А, составляя диету, позаботьтесь о том, чтобы в вашем меню были сытные и вкусные для вас блюда, чтобы диета не была слишком изнуряющей психологически и вы не сорвались. Это основные пункты, которые стоит соблюдать, чтобы эффективно сбросить массу. Но есть и экзотические предложения. Первое – использование разобщителей тканевого дыхания и
198
окислительного фосфорилирования (см. тему биоэнергетики), которые приведут к тому, что для выполнения обычных повседневных задач ваш организм будет использовать в 2 раза больше энергии, чем раньше. Однако имеются побочные эффекты вроде повышенной температуры, потливости, головных болей, нарушений сна и так далее, но при умеренном употреблении всё не так плохо. Самый мощный представитель – динитрофенол (в аптеке не купишь), с его помощью люди в прямом смысле худели до смерти, но если у вас с психикой всё в порядке, то вы не станете до такого доводить. Второе экзотическое предложение – термогенез. Если человек систематически продолжительно прибывает на холоде (желательно, конечно, не стоять, а быстро передвигаться), его обычная жировая ткань трансформируется в бурую, которая сжигает жиры ради выработки тепла.
Синтез жирных кислот
Настало время обсудить анаболизм различных липидов и, так как триацилгрицериды мы уже давно обсудили, начнём с синтеза жирных кислот. Первым делом для синтеза необходимы основные исходные материалы – НАДФН2 и ацетил-КоА. НАДФН2 образуется за счёт поступления глюкозы в ПФП в цитоплазме, ацетил-КоА образуется разными путями, но для синтеза жирных кислот он образуется в основном за счёт глюкозы, поступившей в гликолез, там она даёт пируват, а пируват в ПДК даёт ацетилКоА, однако последнее происходит в матриксе митохондрий, а жирные кислоты синтезируются в цитоплазме, значит, ацетил-КоА надо перенести из митохондрий в цитоплазму. Это делается двумя путями. Первый – с помощью карнитина, но он крайне малоактивен, а второй – транспорт в форме цитрата, вот он используется как основной. Разберёмся в нём поподробнее. Вот у нас идёт абсорбтивный период, клетки пускают глюкозу
в гликолиз, получается пируват, его пускают в ПДК, получается ацетил-КоА, его пускают в ЦТК. Но вот в этих процессах насинтезировалось много АТФ, который аллостерически тормозит ЦТК, в первую очередь тормозится изоцитратдегидрогеназа. Но гликолиз и ПДК продолжают работать, ибо глюкозы в крови пока ещё много, её надо как-то ещё утилизировать. Так вот ацетил-КоА продолжает реагировать с оксалоацетатом под действием цитратсинтазы – образуется цитрат, на который (ну на его часть) действует аконидаза, превращая его в изоцитрат, на который дальше должна действовать изоцитратдегидрогеназа, но она заингибирована АТФ, поэтому изоцитрат и особенно цитрат скапливаются, цитрата становится так много, что он может выходить из митохондрии в цитоплазму через специальный переносчик, дальше цитратлиаза с затратой АТФ разрывает цитрат на оксалоацетат и уксус, а к уксусу прицепляет КоА, образуя ацетил-КоА. Так ацетил-КоА попадает из митохондрии в цитоплазму.
199

Транспорт регулируется концентрациями продуктов по обе стороны – цитратом и оксалоацетатом. Если в митохондрии много цитрата, то он очень охотно выходит в цитоплазму, где его мало. Если в плазме много оксалоацетата, то цитрат медленно распадается (он сдвигает равновесие реакции), разница по концентрациям цитрата в митохондрии и цитоплазме становится не такой большой и транспорт замедляется.
Что происходит дальше? Для синтеза жирных кислот на самом деле нам нужны ацетил-КоА и малонил-КоА, однако во всех темах мы указывали всего два исходных вещества для синтеза жирных кислот – НАДФН2 и ацетилКоА. Почему так? А потому, что малонил-КоА образуется путём карбоксилирования ацетила-КоА с затратой АТФ ферментом ацетил-КоА- карбоксилаза.
Данная реакция является регуляторной во всём синтезе жирных кислот (и правильно – если нет малонил-КоА, то и не из чего синтезировать жирные кислоты). Первый способ регуляции – химическая модификация – инсулин вызывает дефосфорилирование и активацию данного фермента, а глюкагон вызывает фосфорилирование данного фермента и его ингибирование. Второй способ регуляции – ассоциация/диссоциация – сам фермент является тетрамером (неактивен) либо он содержит 20 субъединиц (активен), цитрат вызывает полимеризацию и активацию этого фермента, а пальмитиновая кислота вызывает деполимерезацию и ингибирование фермента. Плюс помним, что малонил-КоА ингибирует КАТ-1, тормозя бета-окисление жирных кислот.
Ну вот, ацетил-КоА, малонил-КоА и НАДФН2 есть, можем заняться синтезом. Синтез жирных кислот чем-то напоминает их бета-окисление в другую сторону. В бета-окислении от каждого второго углерода у длинного
200
