
bkh_dlya_tebya
.pdf
активна дефосфорилированной, а фосфорилированной она неактивна, а вот гликогенфосфорилаза, наоборот, активна фосфорилированной, а дефосфорилированной неактивна.
На графике показано, как на пару работают киназы и фосфатазы. Обратите внимание, что киназы тратят АТФ, а фосфатазы убирают фосфат в виде простой кислоты. Причём киназа является трансферазой, потому что она не гидролизует АТФ, а переносит фосфат с него на фермент.
Ещё должен сказать, что реакции ферментативные регулируются двумя путями: регуляция активности самих ферментов (это очень быстродейственно) и регуляция количества ферментов путём регуляции их экспрессии (долгосрочная, но сильнодействующая мера).
Пару слов про энзимопатологии.
•Первичные – нарушение структуры фермента вследствие мутации, в результате активность фермента полностью или частично падает.
•Вторичные – сам фермент цел, но его кофермент, например, не синтезируется, поэтому фермент не работает, не катализирует реакцию – нарушает метаболизм, приводит к формированию заболевания.
Ещё раз вспомним, что такое изоферменты. Это ферменты, катализирующие одну и ту же реакцию, но их цепи обладают разными физикохимическими свойствами, чаще всего они являются органоспецифичными, т.е. конкретная изоформа в конкретном органе, если орган разрушается, то фермент выходит в кровь, его активность в ней повышена, что выявляется при ферментативном анализе крови. Итак, немного примеров энзимодиагностики. Фермент лактатдегидрогеназа (ЛДГ) является тетрамером (каждый протомер может иметь 2 варианта, поэтому всего изоформ 5 штук). ЛДГ 1 и 2 характерны для сердца – их появление в крови свидетельствует об инфаркте миокарда, а 4 и 5 изоформы характерны для скелетной мускулатуры, их появление в крови свидетельствует о миопатии. Креатинкиназа – димер, изоформа MM характерна для скелетных мышц, её появление в крови свидетельствует о миопатии, изоформа MB
41
характерна для сердечной мышечной ткани, её появление в крови свидетельствует об инфаркте миокарда, изоформа BB характерна для мозга, её появление в крови свидетельствует об энцефалопатии с нарушением гематоэнцефалического барьера. Для сердца характерен фермент аспартатаминотрансфераза (АсАТ), а для печени аланинаминотрансфераза (АлАТ), но они в норме есть в крови в малом количестве в отношении АсАТ/АлАТ = 1,33, если число растёт, значит инфаркт (АсАТ в крови становится больше из-за разрушения тканей сердца и выхода фермента в кровь), если число уменьшается, значит, патология печени (выходит из печени в кровь АлАТ).
42
Введение в обмен веществ. Биоэнергетика клеток.
Для начала стоит вспомнить о том, что такое метаболизм и насколько он важен. Вообще жизнь организма представляет из себя систему, которая обменивается веществами, энергией и информацией с окружающей средой с целью поддержания своего функционирования и обеспечения роста, развития, размножения. Вот эти обмены – это метаболизм, совокупность всех ферментативных реакций в организме, которые мы делим на катаболические и анаболические. Т.е. метаболизм – основа жизни. Катаболические реакции разрушают сложные вещества и выделяют энергию, которая может расходоваться на разные процессы, в том числе, и на обеспечение анаболизма. Анаболические реакции – синтез собственных сложных веществ из более простых с затратой энергии, полученной в катаболизме. Ну то есть всё взаимосвязано. Хотя ещё иногда выделяют амфиболические реакции, когда мы получаем вещество, которое можно использовать как для анаболизма, так и для катаболизма. В связи с делением на анаболизм и катаболизм реакции ещё делят на эндэргические и экзэргические. Экзэргические соответствуют катаболизму – в них исходные вещества содержат энергии больше, чем продукты, поэтому при протекании эта энергия (разница в энергии) высвобождается и может использоваться. При эндэргических реакциях в анаболизме, наоборот, у продукта энергия выше, чем у исходных веществ, поэтому энергию придётся потратить, чтоб реакция свершилась, чтоб исходному веществу хватило энергии до уровня продукта. Особенность этих реакций в организме, что они могут быть сопряжены с синтезом и распадом макроэргических соединений. Что за макроэргические соединения? Это вещества, в которых есть одна или несколько связей, при гидролизе которых выделяется очень много энергии, такие связи называют макроэргическими и называют их «тильдой», рисуют волнистой линией. Зачем нужны эти вещества? Чаще всего они выступают универсальными посредниками между процессами катаболизма и анаболизма. Ну просто не всегда процессы катаболизма и анаболизма протекают в одно время и в одном месте, поэтому им неудобно связываться напрямую, плюс это сложно сделать чисто биохимически, потому что нужны очень сложные ферменты, поэтому все реакции катаболизма и анаболизма «договорились» между собой и приняли единую валюту – АТФ/АДФ (то есть АТФ, выработанная в одном пути катаболизма, подойдёт для любого пути анаболизма), хотя есть и другие макроэрги с несколько специфическими функциями, но вам главное понять основную идею: происходит в катаболизме экзэргическая реакция, выделется энергия, которая идёт на образование макроэргической связи в макроэрге, потом в анаболизме идёт эндэргическая реакция, которая получает энергию от гидролиза
43
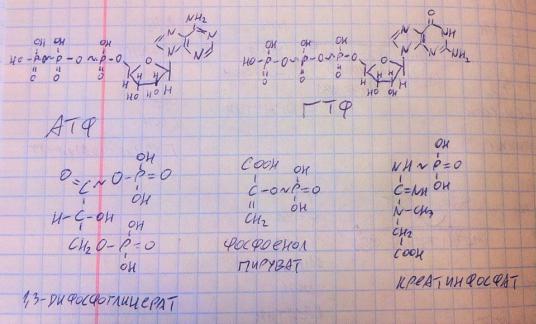
макроэргической связи. Вот вам несколько примеров макоэргических соединений (формулы можете пока не запоминать – хватит и названий):
Общее понятие об энергетическом обмене мы по сути обговорили, но повторим, чтобы закрепить. Организм получает энергию из окружающей среды, скрытую в химических связях различных соединений, разрушая эти связи, организм получает часть этой энергии (другая часть рассеивается в форме тепла) и превращает её в химические связи макроэргов, чтобы те потом отдали энергию на образование связей в веществах, синтезируемых в анаболимзе, и на другие процессы. Короче говоря, получает организм энергию из хим связей питательных веществ, а расходует на образование связей в своих соединениях, транспорт, тепло и тд.
Теперь поговорим о метаболических путях. Чаще всего из субстрата нужный продукт нельзя получить в одну реакцию, поэтому требуются целые цепочки реакций с множеством промежуточных продуктов. Такие цепочки реакций, направленных на получение конечного продукта из субстрата, называют метаболическими путями. По архитектуре эти пути классифицируют на три типа:
•линейные,
•разветвлённые,
•циклические и
•спиральные.
44

С линейными всё просто – субстрат последовательно превращается в продукт. Пример таких путей – синтез или распад гликогена.
Разветвлённый чуть посложнее, из одного субстрата образуется несколько разных продуктов, но они обладают определённым сходством, поэтому первые реакции для них общие, а дальше идут отличия, поэтому у каждого свои реакции превращения. Пример таких путей – синтез нуклеотидов.
Смысл циклического пути ясен из картинки – последний промежуточный продукт, вступая в реакцию с субстратом, образует первый промежуточный продукт, несмотря на то, что цикл замкнут, все атомы поступившего субстрата будут израсходованы, но это вы поймёте только когда разберёте частные случаи. Пример таких путей – цитратный (цикл Кребса или цикл трикарбоновых кислот) и орнитиновый циклы.
Последний, самый интересный тип метаболических путей – спиральный. В случае с циклическим путём в цикл реакций вступает всегда одно и то же вещество, а в спиральном несколько иначе. Там вступает субстрат в цикл реакций, проходит их, в результате образуется продукт и остаток, так вот этот остаток снова проходит цикл этих реакций с образованием продукта и уже более короткого остатка, то есть при спиральном пути циклы реакций повторяются, но вступают в них разные вещества (субстрат и остатки разной длины), поэтому путь и назвали спиральным, потому что каждый цикл похож на предыдущий, но не идентичен, как и витки спирали. Пример – бета-окисление жирных кислот (с помощью цикла реакций от жирной кислоты откусываются двухуглеродные фрагменты ацетил-КоА).
45

Катаболизм
Теперь отдельно поговорим про катаболизм. В него вступают белки, углеводы и липиды. Так как они имеют совершенно разное химическое строение, то пути метаболические катаболизма у них будут различны (для каждой группы хим. веществ отдельная группа ферментов, так как последние специфичны), однако, удобства ради катаболизм белков, углеводов и липидов приводит к образованию общих молекул (ключевых метаболитов), которые уже могут пойти по общему пути катаболизма. Согласитесь, что проще иметь общий конечный путь катаболизма, нежели три отдельных – меньше ферментов, меньше генов, меньше места в клетке используется. Однако сделать весь метаболизм общим не получится, так как исходные вещества (белки, углеводы и липиды) отличаются по своей структуре и требуют индивидуального подхода. Таким образом, мы имеем катаболизм с разделением на специфический (отдельно для белков, липидов и углеводов) и общий. Внимание на схему.
Белки путём протеолиза разрушаются до аминокислот, а те в зависимости от химической природы могут превращаться в пировиноградную кислоту (ПВК, она же пируват) либо сразу в ацетил-КоА, а ПВК превращается в ацетил-КоА. Все олиго- и полисахариды гидролизуются до моносахаридов, которые обычно представлены глюкозой, а другие
46
моносахариды способны превращаться в глюкозу, глюкоза же попадает в гликолиз, где превращается в ПВК (аэробный гликолиз), ПВК в пируватдегидрогеназном комплексе (ПДК) превращается в ацетил-КоА. Нейтральные жиры (это основной источник липидов в пище, представляют собой триацилглицериды ТАГ, состоят из глицерола и трёх жирных кислот) гидролизуются на глицерол (модифицируется, попадает в гликолиз, превращается в ПВК, потом в ацетил-КоА) и жирные кислоты (в бетаокислении разбираются сразу на ацетил-КоА). Ацитал-КоА и ПВК являются ключевыми метаболитами, то есть общими продуктами нескольких метаболических путей (видно на схеме), что позволяет через эти метаболиты разным обменам поддерживать друг друга (например, при голоде мы можем катаболизировать белки до ПВК, а из ПВК в глюконеогенезе наделать глюкозы, чтоб организм не голодал). Пути от белков, жиров и углеводов до ключевых метаболитов называют специфическими путями катаболизма (типа для каждого свой), а вот уже превращения ключевых метаболитов – общий конечный путь катаболизма, в него входят пируватдегидрогеназный комплекс и цикл Кребса, но дополнительно мы разбираем цепь переноса электронов, так как это почти везде, ну кроме скелетной мускулатуры, основной источник АТФ, а смысл катаболизма – наделать АТФ, так что ЦПЭ (цепь переноса электронов) мы тоже должны хорошо разобрать в этой теме.
Итак, первый этап общего конечного пути катаболизма –
превращение пирувата в ацетил-КоА (окислительное декарбоксилирование, ибо уходит углекислый газ и образуется НАДН2 оксидоредуктазами), его осуществляет пируватдегидрогеназный комплекс (ПДК). Это сложные и немного необычные в плане написания реакции, но постарайтесь их запомнить. На рисунке сверху я привёл общую упрощённую реакцию – её вы должны прекрасно знать, ибо она вам пригодится много раз, а ниже я расписал реакции подробно. Первый фермент называется пируватдекарбоксилаза, с помощью ТДФ (тиаминдифосфат – на основе тиамина, т.е. витамина B1) он вырывает углекислый газ из карбоксильной группы пирувата, а ацетильный остаток и водород от бывшей карбоксильной группы присоединяет к себе. Далее этот фермент встречается с дигридролипоилтрансацетилазой, которая имеет витаминоподобное вещество – липоевую кислоту, у которой есть дисульфидная связь. Что делают два эти фермента? Первый фермент отдаёт ацетильный остаток и водород, которые взял в своё время, а второй фермент принимает их на липоевую кислоту, но как? Рвётся дисульфидная связь в этой кислоте, образуется две свободные связи – к одной цепляется водород, а к другой ацетильный остаток. Затем та же самая дигидролипоилтрансацетилаза встречается с КоА (это кофермент на основе пантатеновой кислоты, т.е. витамина B5), который имеет сульфгидрильную группу, далее происходит обмен – КоА отдаёт водород ферменту, а фермент КоА отдаёт ацетильный
47

остаток, таким образом, получаем заветный ацетил-КоА и фермент с ДИГИДРОлипоевой кислотой (теперь мы называем её так, потому что она имеет на серах два лишних водорода), но чтобы фермент мог снова вступать
в реакции, дигидролипоевую кислоту надо превратить в липоевую, поэтому приходит третий фермент – дигидролипоилдегидрогеназа, который с помощью ФАД (флавинаденингдинуклеотид – простетическая группировка на основе рибофлавина, т.е. витамина B2) забирает водород у сер и те могут снова образовать дисульфидную связь. Однако третий фермент (дигидролиполилдегидрогеназа) должен куда-то отдать водород, чтобы снова поучаствовать в реакции, но ФАД/ФАДН2 – это простетическая группировка, т.е. из фермента она не вылазит (не диссоциирует), поэтому фермент берёт кофермент НАД (никотинамидадениндинуклеотид – кофермент на основе никотинамида, т.е. витамина B3) и переносит водород на него, так как тот свободно перемещается по всей клетке и может ассоциировать и диссоциировать с другими ферментами.
Вот в такой подробности с вас спросят эти реакции на семинаре, коллоквиуме и экзамене, а для вас лично на протяжение всей биохимии и некоторых других предметов будет достаточно помнить общую формулу.
(!) Прошу обратить особое внимание на то, что в ПДК (пируватдегидрогеназный комплекс – запоминайте все аббревиатуры) используется много витаминов и одно витаминоподобное вещество: B1, B2, B3, B5 и липоевая кислота. Данный комплекс имеет свою регуляцию активности (регуляцию в биохимии очень важно знать – её всегда спрашивают, да и это в принципе очень полезно знать медикам). Основным
48
объектом регуляции в комплексе обычно выступает пируватдекарбоксилаза. Во-первых, ПДК имеет две специальные субъединицы, одна из которых обладает киназной активностью, а вторая фосфатазной, т.е. комплекс сам себя регулирует путём химической модификации при получении соответствующих сигналов из вне (гормональных обычно), во-вторых, инсулин активирует работу ПДК, как и ионы кальция, в-третьих, есть аллостерическая регуляция, подробнее о последней. Положительными эффекторами являются АДФ, НАД и ПВК, отрицательными – АТФ, НАДН2, ацетил-КоА. ПДК осуществляет реакции катаболизма, т.е. снабжает клетку энергией, а АДФ и НАДН2 говорят о нехватке энергии в клетке, поэтому они активируют ПДК, т.е. положительные эффекторы. АТФ и НАДН2, напротив, говорят о том, что энергии клетке хватает, поэтому они угнетают ПДК. Для справки скажу, что в клетке всегда есть и АТФ, и АДФ, и НАДН2, и НАД, поэтому ферменты регулируются отношением этих веществ между собой, т.е. АТФ/АДФ и НАДН2/НАД. ПВК – исходное вещество, субстрат, если его стало слишком много, значит, он нуждается в утилизации, которой занимается ПДК, поэтому мы активируем ПДК. Ацетил-КоА служит отрицательным эффектором, типа если у нас хватает ацетил-КоА, то зачем нам получать его ещё. Вот это три столпа регуляции ПДК, однако есть ещё два условия, которые мы регуляцией не назовём, но работа ПДК от них сильно зависит – это парциальное давление кислорода и витамины. Дело в том, что в ПДК НАД превращается в НАДН2, но если бы дело шло только так, то НАД просто бы закончился и ПДК перестал бы работать. Но есть ЦПЭ (цепь переноса электронов), которая НАДН2 превращает в НАД, однако она не работает без кислорода (объясню, когда ниже дойдём до этой темы), т.е. нет кислорода – не работает ЦПЭ – НАДН2 не превращается в НАД – ПДК не на чём работать. А зависимость от витаминов – ну многие ферменты зависят от витаминов, но ПДК зависит сразу от четырёх витаминов и одного витаминоподобного вещества, поэтому ПДК очень требователен к витаминам. Ну и каково же значение ПДК? Во-первых, это один из основных источников ключевого метаболита ацетила-КоА, который используется и в катаболизме, и в анаболизме, во-вторых, он выполняет энергетическую функцию, ибо образует НАДН2, из которого потом в ЦПЭ можно получить до 3 АТФ.
49

Цикл Кребса
Теперь перейдём к циклу Кребса (цитратный цикл, цикл трикарбоновых кислот), его основным и единственным субстратом является ацетил-КоА. Реакции представлены на рисунке.
Давайте подробно о них поговорим. Но прежде скажу: учить все формулы, ферменты и реакции очень сложно, вместо этого стоит запомнить логику превращений веществ и, отталкиваясь от структуры веществ и реакций, самим выводить название веществ и ферментов. Биохимия – предмет на понимание. Теперь вернёмся к реакциям. Первую реакцию катализирует цитратсинтаза, почему её так называют? Она создаёт лимонную кислоту (цитрат), поэтому синтаза, но не тратит для этого АТФ, поэтому не синтетаза. То есть это фермент класса трансфераз, что он делает? Он берёт ацетил-КоА, разрушает его водой, высвобождая КоА, а остаток присоединяет к оксалоацетату (щавелевоуксусная кислота). По сути ацетилКоА после реакции с водой превращается в уксусную кислоту, которая берёт со своего конца водород и разрывает одну из двойных связей кислорода в оксалоацетате, чтобы кетоновая группа превратилась в спиртовую, а уксусная кислота смогла присоединиться к оксалоацетату и образовать цитрат. Вы всё это не должны объяснять – я говорю вам это, чтобы вы как-то воображали
50
