
bkh_dlya_tebya
.pdf
Тропомиозин состоит из двух альфа-цепей (димер, олигомерный белок), тропомиозин полимеризуется в двойную спираль. Обратите внимание: у актина полимеризуются протомеры, а у тропомиозина – димеры. Тропомиозин следует за актином и прикрывает его центры связывания с миозином – блокирует.
Тропонин имеет 3 субъединицы (TnT, TnA, TnI), тропонин контролирует положение тропомиозина относительно актина, чуть подробнее о работе этого белка поговорим ниже в теме механизма мышечного сокращения.
Механизм сокращения. Сначала я вам даю рисунок кусочка мышечного волокна, обсудим морфологию, потом перейдём к механизму.
241
Вы видите цитоплазматическую мембрану, она формирует глубокие впячивания, именуемые Т-системами. Мембрана снаружи в покое имеет положительный снаряд, а внутри, соответственно, отрицательный. Но к мышечному волокну подходит аксон нейрона, образует синапс, в нём возникает потенциал действия, который распространяется вдоль мембраны,
а потенциал действия – это быстрое колебание мембранного потенциала покоя с изменением знака заряда мембраны в ответ на действие возбудителя. Т.е. по мере распространения ПД мембрана меняет заряд – это показано на рисунке. Вблизи Т-систем есть пузырь с кальцием – саркоплазматический ретикулум СПР – он накапливает кальций, у него есть RYR-рецепторы, которые фиксируют ПД на мембране Т-систем и открывают каналы для кальция – кальций выходит из СПР в саркоплазму по градиенту (разница концентраций чуть ли не в тысячу раз). В СПР имеется Ca-АТФаза, которая осуществляет первично активный транспорт кальция из саркоплазмы в СПР против градиента концентраций. Есть Z-линии, это спец белки, они крепятся к цитоплазматической мембране, чтобы клетка была прикреплена к миофибриллам и повторяла движения за ними, на эти белки нанизан актин. Есть ещё М-линии, на них закреплён миозин. Миозин и актин расположены друг между другом, чтобы была возможность скользить друг относительно друга, обеспечивая сокращение миофибриллы и всего мышечного волокна/кардиомиоцита. Миозин соединён с Z-линиями сердином и титном для фиксации. Вот это всё, что есть на картинке, теперь перейдём к механизму.
Инициатором мышечного сокращения всегда является потенциал действия на цитоплазматической мембране, который возникает либо от нейрона в синапсе, либо от проводящей системы сердца (особая тема). Потенциал действия распространяется по Т-системам, его регистрирует RYRрецептор, расположенный на СПР, он открывает канал для кальция, тот резво выходит в саркоплазму (ну типа цитоплазма), попутно с этим в клетке активируется аденилатциклазная система, поэтому появляется цАМФ. Что происходит в миофибрилле? Вспоминаем, что у тропонина есть три протомера. Сначала TnI связывается с цАМФ, конформация тропонина меняется, TnC после этого может связаться с кальцием, что он и делает – конформация тропонина меняется ещё больше, это позволяет TnT подействовать на тропомиозин таким образом, чтобы тот сполз по актину в специальный желобок и открыл центры актина, предназначенные для связи
с миозином. Мы создали условия для сокращения. Само сокращение на рисунке ниже.
242
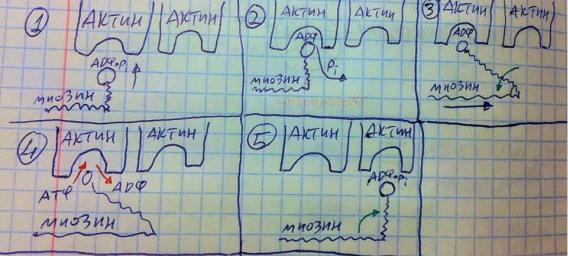
На головке миозина находится полугидролизованная АТФ, если центр актина открыт, а он открыт, головка миозина самопроизвольно к нему присоединяется – образуется актин-миозиновый мостик, АТФ гидролизуется, выделяется энергия, которая расходуется на изменение конформации шарнирного участка так, что угол между шарнирным участком и тяжёлой цепью уменьшается с 90 до 45, такое движение подтягивает миозин относительно актина. Чтобы мостик разрушился, на место АДФ должен встать АТФ, тогда мостик разрушается, миозин восстанавливает конформацию, угол восстанавливается, миозин сам остаётся на месте, а его головка оказывается напротив нового актина, цикл повторяется – так миозин движется относительно актина, так происходит сокращение. Как происходит расслабление? Во-первых, потенциал действия прекращается, значит, и поступление кальция с выработкой цАМФ прекращается. Фосфодиэстераза разрушает цАМФ, а Са-АТФаза возвращает кальций в СПР, в итоге, цАМФ и кальций уходят из саркоплазмы, тропонин перестаёт с ними связываться, восстанавливает свою конформацию, возвращая тропомиозин на его место, чтобы тот закрыл центры актина, а если центры актина закрыты, то он не может образовывать актин-миозиновые мостики – сокращение невозможно. Обратите внимание, что и сокращение (движение актина и миозина друг относительно друга), и расслабление (разрушение актин-миозинового мостика, работа фосфодиэстеразы и Са-АТФазы) требуют АТФ. Вот это всё о механизме сокращения с биохимической точки зрения.
Теперь поговрим о ещё одном важном вопросе – энергетическое обеспечение. Существует 4 вида синтеза АТФ: окислительное фосфорилирование, субстратное фосфорилирование, креатинфосфокиназное фосфорилирование, аденилаткиназное фосфорилирование. Сначала рассмотрим скелетную мускулатуру. Там преобладает субстратное фосфорилирование (две реакции в гликогенолизе и гликолизе), а вот окислительного фосфорилирования почти нет, потому что для этого нужна ЦПЭ, которой требуется куча кислорода, а мышцы недополучают кислород, в
243
мышцах анаэробные условия, поэтому и АТФ там получают соответствующими спосабами. Но есть ещё два способа синтеза АТФ. Вопервых, креатинфосфокиназное фосфорилирование, это как бы стартёр, т.е. если мышца долго прибывает в покое, а потом резко начинает работу, то ей срочно надо много АТФ, гликолизу и гликогенолизу потребуется время, чтобы запуститься и набрать обороты, т.е. они реагируют не мгновенно, а вот креатинфосфокиназное фосфорилирование включается мгновенно и работает, пока его не сменит субстратное фосфорилирование. Если вы лежите, но потом резко встанете и пойдёте, то первые 20 метров вы пройдёте на креатинфосфате (креатинфосфокиназное фосфорилирование), потом 20 минут будите идти на гликогене (гликогенолиз, субстратное фосфорилирование), дальше на глюкозе (анаэробный гликолиз, субстратное фосфорилирование). А вот, когда источники энергии иссякают, но работа продолжается, то из безысходности мышцы прибегают к аденилаткиназному фосфорилированию: АДФ + АДФ = АТФ + АМФ. Т.е. стартуют мышцы на креатинфосфокиназном фосфорилировании, работают большую часть времени на субстратном фосфорилировании, а при истощении источников энергии переходят на аденилаткиназное фосфорилирование. Что касается сердца, его кровоснабжение просто потрясает – каждый кардиомиоцит контактирует с капилляром, поэтому кислорода им хватает, поэтому сердце 24/7 на окислительном фосфорилировании, которое является самым продуктивным кстати, хотя остальные методы сердцу тоже доступны, но они незначительны.
Мы говорили о скелетной и сердечной мускулатуре, сказав всё о скелетной мускулатуре, но про сердце можно добавить. Поговорим об отличительных особенностях кардиомиоцитов. Во-первых, метаболизм в сердце иной, нежели в мышцах. В мышцах мало кислорода, обмен анаэробный, они работают на гликогенолизе и анаэробном гликолизе, материал, соответственно, гликоген и глюкоза, субстратное фосфорилирование. А вот в сердце отличное кровоснабжение, кислорода хватает, обмен аэробный, в качестве топлива используются в основном жирные кислоты – бета-окисление – окислительное фосфорилирование значительно преобладает. Во-вторых, небольшие отличия в химическом составе – гликогена меньше, чем в мышцах, а вот креатинфосфата больше, АТФ по количеству меньше, но вот скорость их оборота гораздо выше. В- третьих, у сердца есть идентификационные ферменты, т.е. они есть только в сердце (ну некоторые есть не только в сердце, но их точно нет в мышцах),
примеры: аспартатаминотрансфераза, креатинфосфокиназа MB, лактатдегидрогеназа-1,2, тропонин-Т (не фермент, но белок). Появление этих ферментов в крови свидетельствует о разрушении кардиомиоцитов, в результате которого белки и смогли оказаться в крови – обычно это признак инфаркта миокарда.
244
Биохимия крови
Кровь – это особенная ткань, она объединяет весь организм, являясь его главной внутренней средой, она выполняет ряд крайне важных функций, нарушение её функций приводит к большому разнообразию заболеваний, но, что самое главное для вас как для будущих врачей, подавляющее большинство патологических процессов в нашем организме так или иначе отражается на составе крови, поэтому анализ крови – неотъемлимая часть диагностики всех заболеваний, поэтому с кровью все вы должны быть хорошо знакомы. Однако в этой теме будет больше вещей на запоминание, а не понимание, но то, что на понимание, постараюсь объяснить.
Начнём с функций крови. Во-первых, интегративная функция. Почти все ткани кровоснабжаются, а это значит, что из любой одной точки организма можно попасть в любую другую точку организма по крови. Во-вторых, транспортная функция. Она вытекает из первой функции, по крови к тканям и от тканей транспортируются газы, к тканям транспортируются питательные вещества, от тканей транспортируются конечные продукты метаболизма. Т.е.
у транспортной функции три вида – газы, питательные вещества, продукты выделения – их надо помнить. Хотя могут переноситься и связываться и другие вещества, например, железо. В-третьих, регуляторная функция крови. Кровь разносит по организму гормоны, без неё бы гормоны не встречались бы с тканями-мишенями. Но ещё кровь участвует в терморегуляции, пример: вам жарко, внутри горячо, кровь горяча, сосуды кожи расширяются, чтобы кровь попала в кожу поближе к внешней среде, отдала тепло, охладилась и вернулась холодненькой к органам, понизив их температуру до нормальной. Заметьте, регуляторная функция в обоих проявлениях по сути основана на интегративной функции крови. В-четвёртых, кровь выполняет защитную функцию. Все иммунные клетки и антитела приходят из крови, а иммунитет защищает организм от чужеродного (вирусы, бактерии и тд) и собственного изменённого (опухолевые клетки, иммунные клетки, атакующие своих) генетического материала. Плюс в крови есть система гемостаза, предотвращающая кровепотерю, а ещё есть фибринолитическая и антикоагулянтная (противосвёртывающая) системы крови в противовес гемостазу, чтобы тот не происходил там, где не надо – предотвращает нарушение кровообращения в сосудах. Помимо этого, кровь защищает нас от сильных колебаний кислотности среды.
Пару слов о химическом составе крови. Если говорить о крови в целом без разделения на плазму и форменные элементы, то 75-80% приходится на воду, 20-25% - плотный остаток, который представлен белками и небелковыми молекулами (минеральные вещества, глюкоза 3,3-5,5 ммоль/л
245

и остаточный азот 14-28 ммоль/л, т.е. мочевина, креатиновый пул, мочевая кислота, аммиак, аминокислоты и тд).
Отдельное внимание заслуживают буферные системы крови, которые не позволяют сильно колебаться pH крови. Как работают буферные системы? Кто меняет pH? Это делают протоны или гидроксид-ионы, а буферные вещества связывают эти ионы, уменьшая концентрацию свободных этих ионов, восстанавливая pH, т.е. вот попали в кровь протоны, начали снижать pH, пришли буферные молекулы, связали протоны, концентрация свободных протонов в крови упала – pH нормализовался. В дальнейшем протоны будут переданы в выделительную систему и покинут организм. Вот так работают буферные системы. Есть 4 основных буферных системы крови: гемоглобиновая, белковая, карбонатная и фосфатная. У белков есть и аминогруппы, и карбоксильные группы, поэтому они справляются и с протонами, и с гидроксид-ионами, хотя гемоглобин себя ведёт немного иначе, потому что у него задействованы кислород и углекислый газ – он ведь транспортник. Кстати гемоглобиновая буферная система самая мощная, потому что гемоглобина в крови нереально много. Минеральные (в нашем случае карбонатная и фосфатная) обычно основаны на паре двух солей, либо соли и основания, либо соли и кислоты, при этом основание или кислота, на которых основана система, должны быть слабыми (должны знать из общей химии, но если не запомните, то не страшно). Показываю наглядно работу буферных систем на рисунке ниже. Нормальный pH крови 7,35-7,40.
Теперь поговорим о такой довольно важной вещи, как белки крови. Каково их значение? Ну вообще они обусловливают большинство функций
246
крови. Например, транспортная функция – газы переносит гемоглобин, особенно кислород, а некоторые питательные вещества не могут сами ходить по крови, например, жирные кислоты – они переносятся альбуминами. Некоторые биологически активные вещества в связи со своей гидрофобностью также требуют транспорта в крови с помощью белков. А гемостаз основан на факторах свёртывания крови, почти все они белки, а гуморальный иммунитет – это антитела, т.е. белки. Выходит, что белки обусловливают большинство функций крови, таково их физиологическое значение. Белков довольно много, их надо классифицировать, их решили классифицировать по подвижности в электрофорезе, выделили 3 группы: альбуминовые белки, глобулины и фибриноген. Немного поговорим о представителях и функциях – прям зубрёжный минимум, который мало вам пригодится, но это точно спросят.
Альбуминовые белки разделяют на преальбумины и альбумины. Преальбумины связывают и транспортируют тироксин и ретинол (витамин А). глобулины же вообще переносят почти все гидрофобные молекулы (у него много специальных кластеров для таких дел).
Глобулины разделены на альфа, бета и гамма. Среди альфа есть альфа- 1-группа и альфа-2-группа. Кто есть среди альфа-1-группы? Альфа-1-глобулин является иммуномодулятором. Антитрипсин ингибирует протеазы крови. Альфа-1-фетопротеин переносит жирные кислоты от матери к плоду через плаценту. Кто есть среди альфа-2-группы? Церрулоплазмин связывает и транспортирует медь. Гаптоглобин связывает гемоглобин и не даёт ему выйти с мочой. Альфа-2-макроглобулин ингибирует протеазы крови. Кто есть среди бета-глобулинов? Трансферрин связывает и транспортирует железо. Гемопексин связывает и уничтожает гем. С-реактивный белок выступает иммуномодулятором и является медиатором воспаления. А гаммаглобулины - это антитела, их функции и разновидности вы узнаете на кафедре микробиологии.
С фибриногеном должно быть всё понятно – это первый плазматический фактор свёртываемости крови, из него образуется фибрин, который полимеризуется и позволяет формировать липкую сеть для кровяного сгустка, который призван запечатать дыры в сосудах и предотвратить кровепотерю.
А вообще это лишь частные примеры, белков и их функций гораздо больше, это вам надо просто для примера.
Теперь чуть подробнее поговорим о дыхательной функции крови (разновидность транспортной функции). Все ткани потребляют кислород и выделяют углекислый газ, как конечный продукт катаболизма, поэтому оборот этих газов в организме довольно высокий, а потому им нужна
247
мощная транспортная система. Кислород переносится кровью в свободном и связанном виде. В свободном это растворённый (такого немного), в связанном это связанный гемоглобин (такого очень много), гемоглобин помогает крови вметить очень много кислорода. Углекислый газ тоже переносится в свободном и связанном виде. В свободном это просто в растворе – углекислый газ очень хорошо растворяется в воде, чего не скажешь о кислороде (поэтому ему и нужен гемоглобин), а в связанном виде это угольная кислота, гидрокарбонаты и в связи с гемоглобином.
Атеперь перейдём к главной теме раздела – гемоглобину. Гемоглобин
–основной белок эритроцитов. Почему? Гемоглобин составляет 90% от всех белков эритроцитов! Основная функция эритроцитов – перенос газов, в особенности кислорода (а вообще эритроциты переносят кислород, углекислый газ, протоны, за счёт гемоглобина выполняют буферную функцию, могут переносить ряд питательных веществ, участвуют в формировании кровяных сгустков при гемостазе), а перенос кислорода в основном лежит на гемоглобине, поэтому-то это главный белок там. Какова структура гемоглобина? Это сложный (небелковая часть – гем) олигомерный (тетромер) белок. В каждом протомере есть кластер из гидрофобных аминокислот, туда вставляется гем, но ещё есть два гистидина, один присоединяется к железу, второй стоит около него. Когда кислород приходит в гемоглобин, он соединяется с железом и гистидином (вторым), при этом железо отодвигается немного, а к нему прикреплён гистидин первый, гистидин двигается, а вместе с ним вся цепь – конформация белка меняется, сродство к кислороду повышается. Т.е. вот этот гистидин позволяет белку менять конформацию при присоединении кислорода, без этого невозможен и эффект кооперации, кстати так как белок олигомерный, то у него есть кооперация. Напоминаю, кооперация – способность субъединиц увеличивать сродство к лиганду при присоединении к другим субъединицам лиганда, т.е. чем больше кислорода гемоглобин присоединит, тем легче ему присоединить новые молекулы кислорода. Каждая молекула гемоглобина присоединяет 4 молекулы кислорода. Т.е. по строению запомните: сложный олигомерный белок, есть гем, есть особый гистидин, есть кооперация.
Теперь разберёмся, как синтезируется гем (синтез гема)? Как синтезируется гемоглобин понятно – так же, как и все белки, а вот сам гем – надо знать реакции и этапы. Первая реакция, она же ключевая, происходит в митохондриях, реагирует сукцинил-КоА и глицин, фермент аминолевуливонатсинтаза откусывает КоА от сукцинила-КоА – остаётся сукцинил, а от глицина откусывает карбоксильную группу – остаётся метиламин, метиламин и сукцинат соединяются – образуется 5- аминолевулиновая кислота. Эта кислота выходит из митохондрии в цитопазму, там встречается с одноимённой дегидратазой, фермент берёт
248
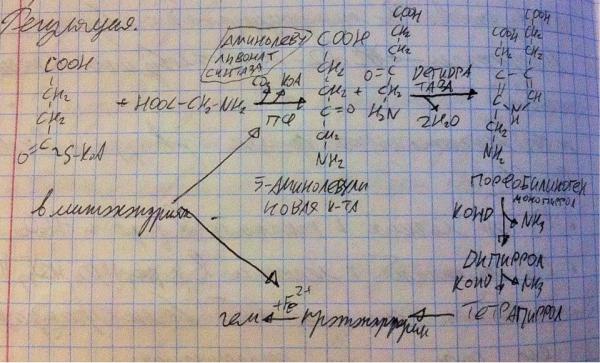
две молекулы кислоты и отщепляет от них две воды, соединяя две кислоты в порфобилиноген-монопиррол. Дальше происходят неферментативные реакции – конденсация – у двух порфобилиногенов-монопирролов отщепляется аминогруппа, они объединяются в порфобилиноген-дипиррол. Потом два порфобилиногена-дипиррола также конденсируются в порфобилиноген-тетрапиррол, тот потом превращается в протопорферин. Протопорферин возвращается в митохондрию, где получает железо и становится гемом. Железо для гема приносит ферритин (белок такой). Как регулируется синтез гема? Через количество и активность аминолевуливонатсинтазы. Гем аллостерически ингибирует этот фермент (ретроингибирование) и уменьшает его количество, подавляя экспрессию его гена. А вот железо в большой концентрации активирует экспрессию гена ключевого фермента, увеличивая его количество, а низкие концентрации приводят к обратному эффекту.
Продолжая тему гемоглобина, скажем о его функциях: транспорт кислорода, углекислого газа, протонов, буферная функция, формообразующая (если не верите, то вспомните, что при серповидноклеточной анемии мутирует гемоглобин, а форма меняется у эритроцита).
Но всё-таки самая важная функция гемоглобина – перенос кислорода, об этом и поговорим. Существует 4 фактора, влияющие на сродство гемоглобина к кислороду: порциальное давление/напряжение кислорода, pH, концентрация ДФГ (2,3-дифосфоглицерол), температура. Разберём каждый по очереди.
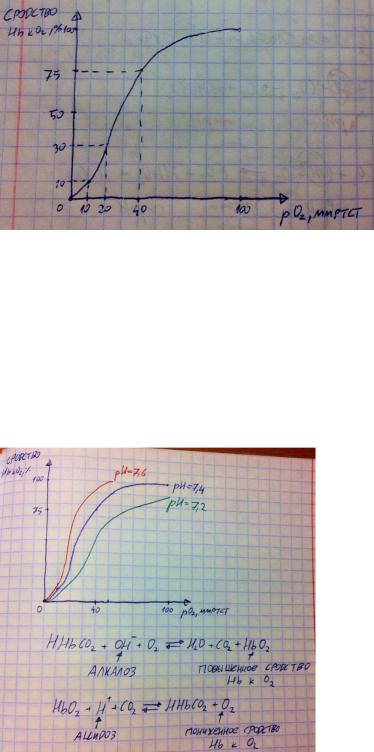
Зависимость сродства гемоглобина к кислороду от порциального давления/напряжения кислорода.
Вверх по графику я отметил уровень сродства в процентах, а вбок – порциальное давление/напряжение кислорода. График S-образный в связи с тем, что гемоглобину характерна кооперация – чем больше кислорода, тем значительно больше сродство до определённого момента. Это сделано непросто так – есть такой промежуток порциального давления (10-40 мм рт ст ст), при котором сродство очень резко меняется, это нужно, чтобы гемоглобин в лёгких полностью забирал кислород, а в тканях полностью его отдавал и никаких «отдал часть» - только полностью.
Зависимость сродства гемоглобина к кислороду от pH.
Повышение pH (алколоз) приводит к повышению сродства гемоглобина к кислороду, поэтому гемоглобин в тканях не отдаёт весь кислород – гипоксия и гипоэнергетическое состояние. Понижение pH (ацидоз) приводит к понижению сродства гемоглобина к кислороду, поэтому кислород как бы может недоходить до тканей – гипоксия и гипоэнергетическое состояние. Но почему так происходит? Напоминаю, что самой мощной буферной системой, но, в отличии от обычных белков, гемоглобин при этом использует газы. На рисунке выше я показал уравнения
