
bkh_dlya_tebya
.pdfреакции, легче запоминали. Если сложно запомнить формулу лимонной кислоты, то запомните так: три уксуса с гидроксильной группой у второго. Далее второй фермент (аконидаза) превращает цитрат (лимонную кислоту) в изоцитрат, т.е. переносит гидроксильную группу с одного места на другое – в будущем пригодится для последующих реакций. Фермент назвали так странно в честь образующегося в реакции промежуточного вещества (тут я его не рисовал, ибо это ни к чему). Затем на изоцитрат действует изоцитратдегидрогеназа (для удобства слово дегидрогеназа сокращают ДГ), этот фермент забирает два водорода от атома с гидроксильной группой, превращая её тем самым в карбонильную (кетоновую), делает он это с помощью кофермента НАД (не забывайте, что в его основе витамин B3), однако дополнительно этот фермент осуществляет декарбоксилирование (убирает среднюю группу) с помощью ТДФ (в его основе витамин B1), в итоге, получается молекула, именуемая альфа-кетоглутаратом (её так назвали, потому что это как глутаминовая кислота, но в альфа-положении вместо аминогруппы стоит кето-группа). На альфа-кетоглутарат действует альфакетоглутаратдегидрогеназа, она также с помощью ТДФ отщепляет углекислый газ, а с помощью НАД она отщепляет водород от бывшей карбоксильной группы и от сульфгидрильной группы КоА, в итоге, оставшиеся КоА и сукцинильный остаток соединяются в сукцинил-КоА. Далее следует необычная реакция, катализируемая сукцинилтиокиназой. Фермент осуществляет две реакции: сначала он гидролизует макроэргическую связь в сукцинил-КоА, из неё выделяется энергия и на основе этой энергии фермент образует макроэргическую связь в молекуле ГТФ, синтезируя её из ГДФ и фосфора неорганического (ортофосфорная кислота). В итоге, образуется макроэрг ГТФ и сукцинат. Данная реакция называется реакцией субстратного фосфорилирования, т.е. реакцией синтеза нуклеозидтрифосфата из нуклеозиддифосфата и фосфора неорганического с затратой энергии связей субстрата химической реакции (определение надо знать). Далее на сукцинат действует сукцинатдегидрогеназа, которая уже с помощью ФАД (простетическая группировка, в основе которой лежит витамин B2) отщепляет два водорода, образуя фумарат. На фумарат действует фермент фумараза, который, вопреки названию, не является гидролазой, он присоединяет к двойной связи воду, образуя гидроксильную группу, и получается малат. На малат действует малатдегидрогеназа, которая с помощью НАД отщепляет водород от углерода и кислорода, образуя из гидроксильной группы карбонильную. И дальше цикл замыкается. Маленький лайфхак: в будущем вы встретите много дегидрогеназ, как запомнить, кто использует НАД, а кто ФАД? Если водороды отщепляют от углерода и кислорода (гидроксильную группу превращают в карбонильную), то это с помощью НАД. Если водороды отщепляются от –CH2-CH2-, то это с помощью ФАД. И ещё маленькое, но очень важное уточнение: весь ПДК
51
находится в матриксе митохондрий, все ферменты ЦТК (цикл Кребса) находятся там же, кроме сукцинатдегидрогеназы – она находится в составе внутренней мембраны митохондрий (полуинтегральный белок).
Теперь поговорим о регуляции ЦТК. Существует три регуляторных фермента в этом цикле – цитратсинтаза, изоцитратдегидрогеназа, альфакетоглутаратдегидрогеназа, среди них самый главный, ключевой,
катализирующий самую медленную реакцию – изоцитратдегидрогеназа. Для всех трёх характерна аллостерическая регуляция: АДФ и НАД являются положительными эффекторами, как и положено для реакций катаболизма, а АТФ и НАДН2 – отрицательные эффекторы. Но, помимо этого, для всех трёх отрицательным эффектором является сукцинил-КоА – это просто запомните. Цитратсинтаза активируется субстратом (оксалоацетат), ингибируется продуктом (цитрат) – смысл регуляции субстратом и продуктом мы обсуждали на теме аллостерики. Теперь поговорим о неаллостерической регуляции. Изоцитратдегидрогеназа и альфа-кетоглутаратдегидрогеназа активируются инсулином и ионами кальция. Плюс есть фермент сукцинатдегидрогеназа – он может подвергаться конкурентному обратимому ингибированию структурными аналогами сукцината – оксалоацетатом и малатом. Ну и надо сказать, что, как и ПДК, ЦТК также зависим от витаминов и кислорода. Описывая ферменты ЦТК выше я говорил
о том, что им необходимы витамины B1, B2, B3. А, касательно кислорода, в ЦТК ФАД превращается в ФАДН2, а НАД в НАДН2, а обратно их превращать может только ЦПЭ, которая не работает без кислорода, в общем та же история, что и с ПДК.
Получается, что регуляция ПДК и ЦТК довольно обширная, но если както сократить и подытожить (оставить то, что вы обязаны запомнить навсегда), то получается следующее: ПДК регулируется через пируватдекарбоксилазу, ЦТК через цитратсинтазу, изоцитратдегидрогеназу,
альфа-кетоглутаратдегидрогеназу; алостерически положительные эффекторы АДФ и НАД, отрицательные – АТФ и НАДН2; гормональный активатор – инсулин; есть зависимость от кислорода и витаминов группы B. Роль витаминов – создание апоферментных кофакторов.
Как не странно, хоть мы и разбираем цикл Кребса в теме катаболизма, но он имеет и энергетическую, и пластическую функции. Разберём сначала энергетическую. Во-первых, там синтезируется ГТФ – макроэрг, равный по смыслу АТФ, во-вторых, там за один цикл образуется 1 ФАДН2 (один такой в ЦПЭ даст до 2 АТФ) и 3 НАДН2 (один такой в ЦПЭ даст до 3 АТФ). Таким образом, за 1 цикл Кребса мы получим: ГТФ (1 АТФ) + ФАДН2 (2 АТФ) + 3 НАДН2 (9 АТФ) = 12 АТФ. Пластическая функция. Дело в том, что промежуточные продукты из ЦТК можно использовать для синтеза
52
некоторых веществ, например, из альфа-кетоглутарата можно получить глутаминовую кислоту, из оксалоацетата – аспаргиновую кислоту и глюкозу.
Теперь предлагаю поговорить об гипоксических и гипоэнергетических состояниях. Большая часть энергии в клетках вырабатывается в общем пути катаболизма в митохондриях в ПДК, ЦТК, ЦПЭ. Энергия оттуда расходуется на все процессы жизнедеятельности, если три этих системы по каким-то причинам не работают в нормальном режиме, то клетки недополучают энергию и не могут полноценно функционировать, в связи с чем ткани и органы перестают работать нормально, что приводит к различным серьёзным заболеваниям. Эти состояния называются гипоэнергетическими, они опасны для организма. Наиболее чувствительным органом к гипоэнергитическим состояниям является головной мозг, так как он потребляет больше всех энергии, при этом не имеет нормальных её запасов, поэтому он нуждается в постоянном и существенном притоке энергии. Как я
и сказал, причинами гипоэнергетических состояний является нарушение функционирования ПДК, ЦТК, ЦПЭ, чем оно может быть обусловлено? Нехваткой витаминов группы B, необходимых в роли апоферментных кофакторов, нехваткой кислорода, т.е. гипоксией (без кислорода не работает ЦПЭ, а значит, и ПДК с ЦТК), энзимопатиями, действием ядов-ингибиторов и разобщителей тканевого дыхания и окислительного фосфорилирования (обсудим позже), недостатком инсулина при сахарном диабете первого типа (инсулин активирует ПДК и ЦТК) и не только. Одной из основных причин гипоэнергетических состояний является гипоксия, т.е. нехватка кислорода, которая может быть обусловлена патологиями дыхательной, сердечнососудистой систем и крови. А, как я и сказал, без кислорода не работает ЦПЭ, а без неё не работает и ПДК с ЦТК, то есть весь общий метаболизм стоит и энергия не вырабатывается.
В тему ЦТК и гипоэнергетических состояний должен добавить пару слов об аноплератических реакциях. Что это и зачем? Бывает такое, что промежуточные продукты ЦТК расходуются в иных процессах, при этом из-за отсутствующих звеньев ЦТК не может быстро работать и справляться со всем поступающим ацетилом-КоА, в итоге, ЦТК не вырабатывает энергию – гипоэнергетическое состояние. Вот чтобы такого не было, существуют специальные реакции, которые восстанавливают некоторые промежуточные продукты ЦТК, чтобы тот смог снова работать в полную силу – аноплератические реакции. Вот примеры нескольких таких.
53
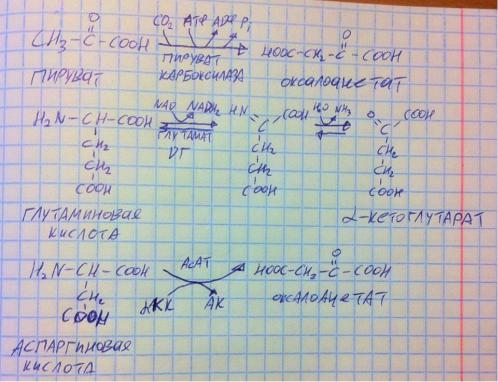
Обычно нужнее всего в ЦТК восполнить недостаток оксалоацетата, самый популярный способ – первая реакция – карбоксилирование пирувата (с затратой АТФ). Т.е. допустим, у вас перерабатывается глюкоза, в гликолизе она превращается в ПВК, ПВК в ПДК превращается в ацетил-КоА, а тот должен бы поступить в ЦТК, но там не хватает оксалоацетата, поэтому мы лишь половину ПВК превращаем в ацетил-КоА, а другую половину – в оксалоацетат. Ну это как пример. Помимо этого, оксалоацетат мы можем получать из аспаргиновой кислоты путём трансаминирования (фермент аспартатаминотрансфераза АсАТ), фермент берёт альфа-кетокислоту, её кето-группу и аминогруппу аспартата меняет местами – кето-кислота превращается в аминокислоту, а аспартат в кетокислоту оксалоацетат). Ну ещё один промежуточный продукт ЦТК – альфа-кетоглутарат – мы можем получить из глутаминовой кислоты путём прямого дезаминирования (реакция вторая). И этого хватит, эти реакции важно знать.
Цепь переноса электронов
Теперь нужно поговорить о самой сложной теме данного раздела – цепь переноса электронов (ЦПЭ). Данная система локализована во внутренней мембране митохондрий, именно там вырабатывается большая часть АТФ в клетках (исключение – скелетная мускулатура), по сути это главная энергетическая система, на неё опирается весь метаболизм клетки. Какие два основных процесса протекают в ЦПЭ? Тканевое дыхание и окислительное фосфорилирование. Тканевое дыхание, оно же
54
биологическое окисление, предполагает последовательность окислительновосстановительных реакций, в результате которых органические молекулы доноры передают электроны (через посредников) на конечный акцептор – кислород (этим в ЦПЭ занимаются 1-4-е комплексы). Окислительное фосфорилирование – образование АТФ из АДФ и фосфора неорганического (ортофосфорной кислоты) с использованием энергии, высвободившейся в результате окислительно-восстановительных реакций (тех, что в тканевом дыхании были), этот процесс осуществляет пятый комплекс ЦПЭ. Оба этих процесса станут вам понятнее после подробного изучения ЦПЭ.
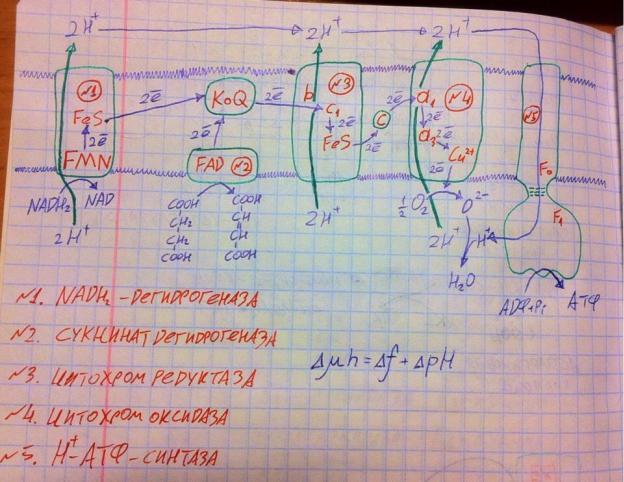
Двумя синими линиями изображена внутренняя мембрана митохондрий, ниже неё матрикс, выше межмембранное пространство. Разберём каждый комплекс поочерёдно. Первый комплекс – НАДН2дегидрогеназа. Данный комплекс представлен белком из множества субъединиц с разными лигандами, данный комплекс представляет собою интегральный белок, то есть он прошивает мембрану насквозь и это важно. Этот комплекс переносит электроны и протоны с НАДН2 на ФМН, тот лишается протонов, а электроны отдаёт на серожелезные белки (FeS), а те, в свою очередь передадут электроны на КоQ, который несёт электроны на третий комплекс. За счёт переходов электронов между разными лигандами высвободилась энергия (об этом подробнее расскажу ниже), которая
55
позволила транспортировать два протона из матрикса митохондрий в межмембранное пространство. То есть по этому комплексу вы просто должны запомнить путь электронов, то, что комплекс интегральный, сложный и переносит два протона в межмембранное пространство. Второй комплекс – сукцинатдегидрогеназа, да, этот комплекс относится и к ЦТК, и к ЦПЭ, он кстати тоже сложный, но полуинтегральный, поэтому он не занимается транспортом протонов в межмембранное пространство, он забирает водород от сукцината на ФАД, затем протоны выбрасывает в матрикс, а электроны отдаёт КоQ. КоQ не является каким-то комплексом – это просто кофермент, который свободно ходит внутри мембраны, перенося электроны от 1-го и 2-го комплекса к 3-му. Третий комплекс называется цитохромредуктазой, он тоже сложный, интегральный, переносит протоны в межмембранное пространство за счёт энергии, высвобождаемой от переходов электронов. Имеются цитохромы (гем-содержащие белки) b и c1,
а также серожелезные (уже немного другие) белки электроны от КоQ на цитохром c1, от него на серожелезные белки, от них на свободный цитохром c, который ходит внутри мембраны между 3-м и 4-м комплексами. Примечательность данного цитохрома в том, что он состоит из 100 аминокислот и не является видоспецифичным, т.е. у нас и лягушек, например, он одинаковый. Четвёртый комплекс – цитохромоксидаза (оксидаза, потому что переносит электроны на кислород), тоже интегральный, тоже переносит протоны в межмембранное пространство. Электроны от цитохрома с идут на цитохром а1, с него на а3, с того на медь, а с меди на молекулярный кислород, который превращается в оксид, который, соединяясь с протонами, превращается в воду. Ну по сути так работают 1-4-е комплексы – переносят электроны с НАДН2 и сукцината на кислород, попутно закачивая протоны в межмембранное пространство. Но почему электроны идут именно по такому пути и почему они выделяют энергию? Дело в том, что электрон с его молекулой-носителем образуют систему, которая характеризуется определённым потенциалом. У НАДН2 он составляет -0,32 В, а у воды +0,82 В (разница в 1,14 В). Электроны стремятся из более отрицательных систем перейти в более положительные. Если электрон находится в отрицательной системе, ему нужно обладать большой энергией, чтобы удерживаться в этой системе, ибо минус от минуса отталкивается, но, когда электрон переходит в менее отрицательную систему, ему уже нужно меньше энергии, чтобы там держаться, ибо отталкивание слабее, поэтому лишнюю энергию электрон отдаёт, она рассеивается в форме тепла, но её часть уходит на перемещение протонов в межмембранное пространство против электро-химического градиента, ну а оставшаяся часть энергии расходуется на транспорт через мембрану других веществ. То есть электроны стремятся из отрицательных систем в положительные – разница редокс-потенциалов является движущей силой
56
электронов, а потеря электронами свободной энергии в процессе переходов используется для транспорта протонов. Ну собственно, так и работает тканевое дыхание. Причём заметьте, что НАДН2 даст нам 6 протонов в межмембранное пространство, ибо его электроны проходят через 1-й, 3-й и 4-й комплексы (интегральные), а сукцинат даст 4 протона, так как у него электроны идут по 2-му (неинтегральный), 3-му и 4-му (интегральные) комплексам. Почему во втором комплексе не происходит переноса протонов? Дело в том, что электроны от сукцината изначально имели не такой большой редокс-потенциал, как электроны от НАДН2, то есть в 1-м, 3-м
и 4-м комплексах перепад потенциала при переходах электрона настолько большой, что его энергии хватит, чтобы перенести протоны в межмембранное пространство, а во 2-м комплексе перепад небольшой и энергии мало. Работа тканевого дыхания приводит к тому, что в межмембранном пространстве накапливается очень много протонов, их концентрация там гораздо выше, чем в матриксе – это формирует электрохимический градиент. Химический градиент заключается в том, что есть большая разница в концентрациях протонов между межмембранным пространством и матриксом, а электрический градиент состоит в том, что в межмембранном пространстве гораздо больше положительно заряженных ионов – разница зарядов. Формула электрохимического градиента приведена на рисунке выше. За счёт электрохимического градиента протоны с дикой силой пытаются проникнуть в матрикс, но мембрана для них непроницаема. И тут мы подходим к 5-му комплексу – Н-АТФ-синтаза, она состоит из двух частей: Fo (это не ноль, а «о» в честь олигомицина, который способен ингибировать её) и F1 (3 альфа-субъединицы, 3 бета-субъединицы, гамма-, дельта- и эпсилонт-субъединицы). Что делает этот комплекс? Он имеет канал, через который протоны попадают из межмембранного пространства в матрикс, однако протонам в этом канале приходится взаимодействовать с кучей аминокислот, отдавая им по пути часть своей энергии, энергии электрохимического градиента, эта энергия расходуется на изменение конформации всего комплекса, в нижней части комплекса встраиваются АДФ и фосфор неорганический, но, когда комплекс под энергией движущихся протонов, меняет конформацию, он силой соединяет АДФ и фосфор неорганический в АТФ, закладывая туда часть энергии электрохимического градиента через изменения конформации. Причём 2 протона позволяют сделать одну АТФ, поэтому с НАДН2 мы можем получить до 3 АТФ (максимум), а с сукцината до 2 АТФ(максимум), показатель того, сколько АТФ можно снять с одной молекулы субстрата, который я только что привёл для двух субстратов, обозначается как P/O, он может снижаться при разобщении тканевого дыхания и окислительного фосфорилирования. Итак, суть работы всей ЦПЭ мы разобрали, но теперь нужно пояснить пару дополнительных моментов, связанных с этой темой. Мы часто говорим о
57
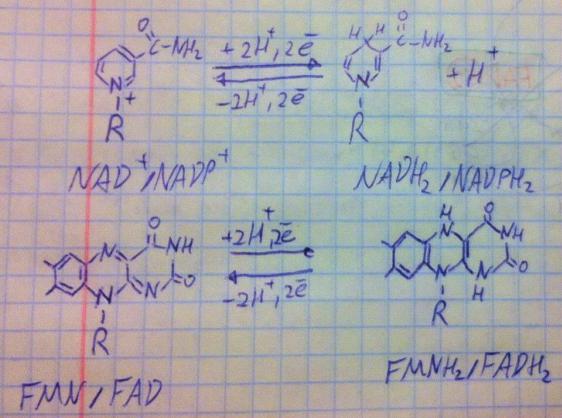
НАДН2/НАД, ФМНН2/ФМН, ФАДН2/ФАД, поэтому должны немножко представлять, как они работают, в НАД рабочая часть – никотинамид (на рисунке восстановленная и окисленная формы), у ФАД и ФМН рабочая часть
– флавин.
На фото наглядно показано, как изменяется рабочая часть при присоединении водорода. Это не самая полезная информация – спросят её с вас, скорее всего, всего лишь раз на семинаре. Пару слов надо сказать о втором комплексе ЦПЭ, он является страховкой на случай отключения первого комплекса. Ещё один момент – условия для синтеза АТФ путём окислительного фосфорилирования: функциональная целостность ЦПЭ, непроницаемость мембраны для протонов, наличие кислорода, АДФ, ортофосфата и электрохимического градиента.
Теперь поговорим о регуляции ЦПЭ. Во-первых, это дыхательный контроль, т.е. алостерически отношением АТФ/АДФ, во-вторых, прямая зависимость от поступления кислорода и витаминов группы B, в-третьих, действие ингибиторов комплексов ЦПЭ. Первый комплекс ингибируется барбитуратами, ротеноном (яд водоросли), прогестероном, второй – оксалоацетатом и малатом (обратимое конкурентное ингибирование), третий – антимицин А, четвёртый – цианид, азид, угарный газ, сероводород, пятый – олигомицин. Причём если заингибировать 1-й или 2-й, это не страшно, ибо они страхуют друг друга, а вот если оба или 3-4-5-е, то беда, но вообще самыми опасными считаются ингибиторы 4-го комплекса.
58
О макроэргических соединениях и энд- и экзэргических реакциях уже говорилось выше, но здесь мы немного подробнее поговорим об АТФ. Для начала как он синтезируется? Есть аж 4 способа.
•Окислительное фосфорилирование – синтез нуклеозидтрифосфата из нуклеозиддифосфата и ортофосфата за счёт энергии окислительно-восстановительных реакций.
•Субстратное фосфорилирование – синтез нуклеозидтрифосфата из нуклеозиддифосфата и ортофосфата за счёт энергии химических связей субстрата.
•Креатинфосфатное фосфорилирование – перенос фосфата с креатинфосфата на АДФ с образованием АТФ, под действием креатинфосфокиназы. Аденилаткиназное фосфорилирование, с помощью аденилаткиназы АДФ + АДФ = АТФ + АМФ.
Основным в большинстве клеток является окислительное, для скелетной мускулатуры – субстратное, а самое быстродейственное – креатинфосфокиназное, ну а аденилаткиназное используют мышцы от безысходности. АТФ расходуется по поддержку всех анаболических реакций, фосфорилирование ферментов и не только, движение, транспорт молекул и не только.
В чём связь ЦТК и ЦПЭ? Во-первых, они имеют общее звено – сукцинатдегидрогеназу, во-вторых ЦТК превращает НАД в НАДН2, а ЦПЭ обратно, т.е. взаимоснабжают друг друга. В чём сопряжение тканевого дыхания и окислительного фосфорилирования? Тканевое дыхание за счёт энергии своих окислительно-восстановительных реакций нагнетает протоны
в межмембранное пространство, создавая электрохимический потенциал, который, в свою очередь, способствует работе Н-АТФ-синтазы, т.е. один процесс обеспечивает другой. Как я и говорил ранее, показателем полноценности сопряжения является P/O. P/O(НАДН2) максимум 3 АТФ, PO(сукцинат) максимум 2 АТФ, если происходит рассогласование двух этих процессов, то электрохимический градиент падает, АТФ синтезируется меньше, значения P/Oстановятся меньше.
Поговорим о разобщителях тканевого дыхания и окислительного фосфорилирования.
Первый тип разобщителей – протонофоры, они переносят протоны из межмембранного пространства в матрикс, минуя 5-й комплекс, т.е. снижают электрохимический градиент (ибо снижают разницу концентраций протонов
и зарядов), уменьшая синтез АТФ, ведь этот потенциал – движущая сила синтеза АТФ в данном случае, примеры таких веществ – жирные кислоты, динитрофенол, бикуманол, термогенин (специальный белок бурой жировой ткани), билирубины, катехоламины и тиреоидные гормоны в сверх высоких
59
концентрациях (связывают протон, проходят через мембрану в матрикс, оставляют его там).
Вторая группа – ионофоры, они уменьшают количество катионов в межмембранном пространстве, уменьшая электрический градиент, примеры
– валиномицин, границидин.
Третья группа – детергенты, эти вещества нарушают непроницаемость мембраны, серьёзно уменьшая электрохимический потенциал, примеры – желчные кислоты, тритон Х-100. Но разобщители это не всегда плохо, у нас они работают в норме. Зачем? Это необходимо для выработки тепла. Если вспомните, я говорил, что свободная энергия электронов расходуется на транспорт протонов, некоторых веществ, но также рассеивается в виде тепла, т.е. тканевое дыхание вырабатывает тепло. Допустим, вы идёте пешком по улице летом, у вас полное сопряжение – тканевое дыхание и окислительное фосфорилирование работают одинаково. Но представьте, что вы идёте в том же месте с той же физической нагрузкой, но зимой. Включаются разобщители, допустим на 50%, тогда, окислительное фосфорилирование работает, как и летом (ведь нагрузка та же – АТФ столько же), но тканевое дыхание, чтобы обеспечить необходимый электрохимический потенциал в условиях разобщения, должно работать в 2 раза активнее, а значит, и тепла вырабатывать в 2 раза больше, чтобы вы не замёрзли. Вот так это работает. Это одна из основ термогенеза, особенно под этого специализирована бурая жировая ткань, которая имеет большое число митохондрий и белокразобщитель термогенин, т.е. конкретно её митохондрии АТФ вырабатывают по минимуму, а тепло по максимуму. Бурая жировая ткань есть в основном у младенцев, но если взрослый человек часто прибывает на холоде, то часть его обычной жировой ткани трансформируется в бурую.
Ещё одним важным вопросом являются митохондриальные болезни.
В митохондриях есть свой генетический материал, который особенно часто повреждается, т.к. в митохондриях особенно активно вырабатываются активные формы кислорода (повреждающие факторы), а репаративных систем нет. Наследуются эти болезни от матери, т.к. сперматозоид митохондрии яйцеклетке не передаёт. Тяжесть болезни определяется тем, какая часть митохондрий яйцеклетки оказалась больной. Такие болезни опасны гипоэнергетическими состояниями, к которым особенно чувствительна ЦНС, о чём говорилось ранее.
60
