
bkh_dlya_tebya
.pdfКак можно оценить уровень перекисного окисления в организме? Много есть способов, назову наиболее очевидные и близкие к теме. Вопервых, этот самый малоновый альдегид (OHC-CH2-CHO), который образуется из распадающихся перекислей жирных кислот. Во-вторых, шифовы основания (липофусцин – клеточный пигмент, состоящий из этих оснований), о которых говорилось выше. В-третьих, в реакциях обрыва цепи
я привёл пример одной реакции, в которой выделяется квант света, это свечение можно оценить через световой микроскоп.
Итак, что мы теперь можем сказать о ПОЛ? Прооксиданты образуют АФК, АФК запускают ПОЛ (цепной неферментативный процесс свободно радикального окисления ненасыщенных жирных кислот), ПОЛ влечёт за собой разрушение липидного компонента мембраны и повреждение белкового. По сути ПОЛ – серьёзный разрушительный процесс. Это патология или от него есть польза? Конечно, есть. Во-первых, ПОЛ позволяет обновлять мембраны, выступая в роли основного пути катаболизма мембран. Вовторых, ПОЛ необходим для синтеза эйкозаноидов (окисляет арахидоновую кислоту). В-третьих, ПОЛ необходим для синтеза половых гормонов. В- четвёртых, ПОЛ целенаправленно усиливается при апоптозе (мембрана клетки становится очень проницаемой, её заполняют ионы, особенно осмотически активные, клетка не может работать, она разрушается. В-пятых, иммунные клетки, когда устраивают разборки с туберкулёзом, которого ничто не берёт, собираются вместе и устраивают кислородный взрыв – продуцируют огромное количество АФК, а у туберкулёза клеточная стенка сплошь липидная – ПОЛ его похоронет. В-шестых, ПОЛ вызывает апоптоз опухолевых клеток, которые больше других не любят кислород. Все 6 значений хорошо запомните.
Откуда берутся свободные радикалы и в частности АФК в нашем организме? Их появление провоцируют прооксиданты. Прооксиданты бывают физическими, химическими и биологическими. Физические – ультрафиолетовое, рентгеновское и гамма излучения, или ионизирующие излучения, они могут приводить к формированию свободных радикалов, так как сообщают молекулам очень большое количество энергии. Химические – оксиды азота, металлы переходной валентности (помогают перекиси водорода превращаться в гидроксильный радикал, примеры – железо и медь), витамин С в очень высоких концентрациях. Биологические – ЦПЭ и ферменты класса оксидоредуктаз. Что касается биологических, в нашем организме есть реакции, в которых на молекулу кислорода поочерёдно переносятся электроны, чтобы потом кислород приобрёл степень окисления -2 и превратился в воду, вот только промежуточные продукты этих реакций (АФК) могут ускользать из реакций, и запускать свободнорадикальное окисление с теми молекулами, с которыми столкнётся, особенно с липидами
221

и ДНК. Некоторые ферменты (оксидазы) образуют АФК даже не как промежуточный продукт, а как конечный, например, перекись водорода от оксидаз. А в ЦПЭ есть цитохром C и КоQ, которые переносят электроны, но могут столкнуться с кислородом и отдать электроны ему. Мы сказали, что ПОЛ приносит много пользы, но только в определённых пределах, если переборщить, то свободнорадикальное окисление и ПОЛ в частности разнесут всю клетку. Чтобы такого не происходило, были созданы антиоксидантные системы. Антиоксидантные системы подразделяют на ферментативные и неферментативные. Сначала о ферментативных.
Супероксиддисмутаза берёт два супероксиданиона отрывает от каждого кислороды с электронами, соединяются вместе, получают по протону – получается перекись, а два кислорода с орбиталями с неспаренными электронами соединились в молекулу кислорода – на рисунке всё видно. Но перекись водорода – тоже АФК, на то есть каталаза, она берёт две перекиси, выдирает из каждой по атому кислорода, получается две воды, а из выдранных атомов кислорода делает молекулу кислорода. Особая роль у глутатионпероксидазы, потому что этот фермент может работать как с пероксидом ворода, так и с липидными перекисями в мембране, чтобы не только предотвращать ПОЛ, но и исправлять его последствия. Этот фермент рвёт связь между двумя кислородами и вставляет туда по водороду от глутитионов, которые при этом сшиваются дисульфидной связью, но глутатионредуктаза разрывает эту связь и восстанавливает глутатионы с помощью НАДФН2. Это три основные ферментативные антиоксидантные системы, количество ферментов может регулироваться.
К неферментативным антиоксидантам относятся витамины А, С, Е. Е отдаёт свободным радикалам протоны и электроны, а сам становится просто
222

окисленным, но цепь окисления прерывается, так как в результате реакций не образуются свободные радикалы. Витамин С делает то же самое, но ещё он способен восстанавливать витамин Е. но витамин С является антиоксидантом только в небольших концентрациях. Преимущество витамина Е заключается в том, что он жирорастворимый и может работать прямо внутри мембраны.
Но есть и ещё один тип неферментативных антиоксидантов – вещества, понижающие концентрацию металлов с переходной валентностью (они являются прооксидантами).
Свободно радикальное окисление и ПОЛ имеют свою пользу, но в избытке крайне опасны, поэтому нуждаются в регуляции, а регулируются они посредством взаимодействия прооксидантных и антиоксидантных систем – между ними должен быть баланс, отклонение от него в любую сторону приводит к патологии, так что не верьте чудодейственности препаратов на основе антиоксидантов – они вам не нужны, если ваши про- и антиоксидантные системы сбалансированы.
223
Биохимия печени
Печень – это полифункциональный орган, она является центральным органом в метаболизме белков, углеводов и липидов, она участвует в пищеварении, выделяя желч, помогающую переваривать и всасывать липиды, а также активирующую перистальтику, печень обезвреживает все ксенобиотики в нашем организме (антитоксическая функция), печень обеспечивает кровь почти всеми белками, участвует в гемолизе и термогенезе. Но сегодня нас с точки зрения биохимии будет интересовать метаболическая и антитоксическая функции печени. Начнём с метаболической.
Белковый обмен. Метаболизм включает в себя анаболизм и катаболизм. Печень катаболизирует белки крови, гидролизует. Она это может делать по нескольким причинам. Во-первых, если белок токсичен (яд от укуса змеи, например), то если его гидролизовать, он потеряет токсичность. Во-вторых, при сильном голодании печень гидролизует белки крови, чтобы достать аминокислоты и пустить их в глюконеогенез, дабы обеспечить организм глюкозой (гликоген давно кончился). В-третьих, если мы не голодаем, но не получаем незаменимые аминокислоты, печень гидролизует белки крови, чтобы из них достать эти аминокислоты и обеспечить ими организм. Печень катаболизирует не только белки, но и аминокислоты лишние, иногда она это делает, чтобы избавиться от излишка, иногда, чтобы получить энергию, иногда для глюконеогенеза. Плюс катаболизм всех аминокислот сопровождается выделением аммиака, печень его превращает в мочевину и выводит. Что касается анаболизма, печень синтезирует все заменимые аминокислоты и большую часть белков крови. Плюс ко всему, печень поддерживает постоянный уровень и соотношение аминокислот в крови, обеспечивая их гомеостаз. Исходя из всего сказанного, вполне понятно, почему печень занимает центральную роль в метаболизме белков и аминокислот.
Углеводный обмен. Печень синтезирует и разлагает гликоген, пускает глюкозу в гликолиз и ПФП (катаболизм), а также на долю печени приходится пояти весь глюконеогенез. Излишки глюкозы она превращает в ТАГ и холестерол. То есть в печени происходят все основные виды катаболизма и анаболизма углеводов. Помимо этого, печень является активным утилизатором глюкозы и единственным органом, способным отдавать глюкозу в кровь в постабсорбтивный период, т.е. печень отвечает за гомеостаз глюкозы. раз печень участвует во всех видах метаболизма углеводов и обеспечивает гомеостаз глюкозы, то она однозначно является центральным органом в метаболизме углеводов.
224
Липидный обмен. Печень синтезирует немалую долю ТАГ и фосфолипидов в организме. Печень синтезирует большую часть холестерола
и только она способна выводить его из организма в виде желчных кислот. Печень синтезирует ЛПОНП и ЛПВП, обеспечивая транспорт и распределение липидов в организме. Печень синтезирует желчные кислоты, необходимые для переваривания и всасывания липидов пищи (а вместе с ними всасываются и жирорастворимые витамины). В печени активно протекает бета-окисление и только в ней возможен синтез кетоновых тел. Выходит, что печень в липидном обмене делает вообще всё, поэтому печень – центральный орган в метаболизме липидов.
Теперь плавно начнём переходить к антитоксической функции печени. Есть вещества, которые образуются в нашем организме непостоянно и не в больших количествах, я про те, что требуют обезвреживания, таких ну очень много – для них есть разные системы обезвреживания, но есть естественные постоянные метаболические пути, требующие участия печени, так как образуются токсины. Вот один из таких путей – катаболизм гемоглобина, он стоит особняком, поэтому и разберём мы его отдельно.
Гемоглобин у нас весь в эритроцитах, и занимает он в них очень много места, т.е. этого белка в организме довольно много. Эритроциты в связи с тем, что не имеют ядра, живут недолго (ну 120 дней это не очень-то и долго по сравнению с нейронами или клетками иммунной памяти, которые могут жить десятки лет) – быстро повреждаются, причём идентификатором повреждения эритроцитов служат сиаловые кислоты на их поверхности, которые тоже повреждаются. Процесс разрушения эритроцитов называется гемолизом, гемолитические органы замечают старые эритроциты по их повреждённым сиаловым кислотам, отлавливают их и разрушают. В каких органах в основном происходит гемолиз? Это селезёнка (!), лимфатические узлы, красный костный мозг, печень. В клетках этих органов разрушаются эритроциты и выделяют большое количество гемоглобина. Что с ним происходит? Сначала он распадается на гем и белок-глобин, глобин гидролизуется до аминокислот, а вот на гем действует гемоксигеназа, она берёт молекулу кислорода, разрывает её на два атома, к одному атому присоединяет водород от НАДФН2 – образуется вода, а второй атом кислорода встраивает в гемоглобин (циклическая структура с 4-мя пиррольными кольцами), однако от этого гемоглобин рвётся, превращаясь в биливердин (линейная структура с 4-мя пиррольными кольцами), отрывется молекула угарного газа и, поскольку молекула перестаёт быть цикличной, выходит железо, ибо ему больше не с чем связываться. На биливердин действует биливердинредуктаза с помощью НАДФН2 – получается непрямой билирубин. Биливердин (жёлтый) и непрямой билирубин (красно-жёлтый)
225

являются желчными пигментами (несмотря на название, в желчи они не присутствуют), водонерастворимыми и крайне токсичными.
В чём их токсичность? Из-за своей гидрофобности они способны проникать сквозь мембраны всех клеток, встраиваться в структуру белка и ДНК, существенно нарушая их функцию, при этом отложение данных пигментов в тканях окрашивает их в жёлтый цвет (но, если перед вами представители монголоидной, негроидной или австралоидной расы, на коже вы не увидите изменения, зато у всех рас белая склера глаз и её пожелтение 100% указывает на желтуху – отложение желчных пигментов в тканях). Так, ну вот ткани создали довольно токсичный водонерастворимый непрямой билирубин, а что с ним делать дальше? Его выбрасывают в кровь, там он сразу связывается с альбуминами (транспортные белки крови для гидрофобных молекул), те по крови доносят непрямой билирубин до печени, там его и оставляют, в гепатоцитах есть Z-белок и белок-лигандин, которые позволяют непрямому билирубину очень быстро попасть в гепатоциты. Дальше происходит конъюгация непрямого билирубина, в результате которой он превращается в прямой билирубин. У непрямого билирубина есть карбоксильные группы (2 штуки), к которым последовательно присоединяются глюкуроновые кислоты, которые переносятся на билирубин из УДФ-глюкуроновых кислот с помощью фермента УДФглюкуронилтрансферазы, получается сначала билирубинмоноглюкуронид, затем билирубиндиглюкуронид – прямой билирубин.
226
За счёт того, что в составе прямого билирубина есть очень полярные молекулы глюкуроновой кислоты, он становится хорошо растворимым в воде (его легче вывести из организма), а потому и нетоксичным (такой билирубин уже не сможет залезть в белок или ДНК, да и через клеточную мембрану он сам не проползёт теперь, так как стал гидрофильным). Прямой билирубин выходит из печени активным транспортом и поступает с желчью в кишечник.
Мы разобрали образование билирубина, его печёночное преобразование, а теперь разберём его кишечные превращения с парой бонусов.
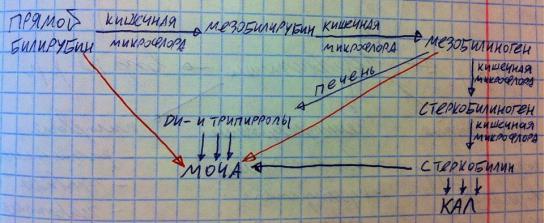
Прямой билирубин в кишечнике под действием бактерий преобразуется в мезобилирубин, а затем в мезобилиноген, затем кишечная микрофлора превращает мезобилиноген в стеркобилиноген, а его в стеркобилин. Стеркобилин окрашивает кал в коричневый цвет. Однако мезобилиноген всасывается кишечником в кровь, после этого он попадает в печень, где разбирается до ди- и трипирролов, которые попадают в кровь, по ней идут в почки, а из почек попадают в мочу. Если у вас очень серьёзное заболевание печени, мезобилиноген не обезвреживается печенью и попадает сразу в мочу. Стеркобилин тоже всасывается в кровь кишечником, попадает в почки и мочу, придавая моче её характерный соломенно-жёлтый цвет. Если у вас в крови очень много прямого билирубина, то он может попадать в мочу, так как он водорастворим (альтернативное выведение). Итак, красными стрелочками я показал, что оказывается в моче при патологии, а синими стрелочками показал то, что в моче в норме присутствует.
Итак, исходя из написанного, в крови в норме содержится непрямой и прямой билирубин (в соотношении 3 : 1 соответственно), концентрация общего билирубина крови колеблится от 1,7 мкмоль/л до 17 мкмоль/л. Заметьте: не милимоль, а микромоль! Помимо этого, в крови в следовых количествах оказывается мезобилиноген и стеркобилин, ибо их всасывает
227
кишечник, а ещё немного ди- и трипирролов, которые идут из печени в почки. В моче в норме оказываются ди- и трипирролы, стеркобилин.
Желтухи
Если в пути катаболизма гемоглобина происходит серьёзное нарушение, начинается отложение желчных пигментов в организме, которое приводит к его отравлению и как характерный признак к пожелтению кожи и склеры глаз. Эти заболевания называют желтухами. Выделяют три типа желтух в связи с уровнем нарушения катаболизма гемоглобина: надпечёночная (гемолитическая), печёночная (паренхиматозная), подпечёночная (механическая). Разберёмся в каждой.
Надпечёночная или гемолитическая. Существует ряд заболеваний, среди которых есть и инфекционные, которые приводят к усилению гемолиза в несколько раз. Гемолитические органы вырабатывают непрямой билирубин, которого становится в несколько раз больше. Печень конъюгирует непрямой билирубин и превращает его в прямой, однако процесс конъюгации может ускориться нау максимум на 25%, а гемолиз на 200%, поэтому получается такая ситуация, что печень не справляется со всем непрямым билирубином, он накапливается в организме. Концентрация непрямого билирубина подскакивает в крови, а прямого остаётся в норме – ключевой признак гемолитической желтухи. Поскольку прямого билирубина стало образовываться на 20% больше, то и в кишечник его поступает больше,
а значит, больше стеркобилина в кале (кал темнеет) и больше ди- и трипирролов, стеркобилина в моче (темнеет моча). Прямой билирубин в крови в норме, поэтому в мочу он не проникает.
Печёночная или паренхиматозная желтуха. Её вызывают различные заболевания самой печени, в результате чего весь метаболизм печени замедляется, поэтому печень, во-первых, не может конъюгировать весь непрямой билирубин (он накапливается, его уровень в крови растёт), вовторых, не весь прямой билирубин гепатоциты способны выводить из организма, поэтому он возвращается в кровь (в крови растёт уровень прямого билирубина). Ключевой признак паренхиматозной желтухи – повышение уровня в крови билирубина обоих типов. Так как меньше билирубина поступает в кишечник, в кале становится меньше стеркобилина – он светлеет. В мочу попадает меньше стеркобилина, ди- и трипирролов, зато
в мочу начинает поступать прямой билирубин (раз с желчью не выводится нормально, то пускай выходит с мочой), поэтому цвет мочи как бы несущественно меняется.
Подпечёночная или механическая желтуха. Она обусловлена закупоркой желчного протока. Т.е. гемолиз и печень в порядке, непрямой билирубин нормально вырабатывается и нормально конъюгируется – его уровень в
228
крови в норме, а вот прямой билирубин чисто физически не может попасть в кишечник (проток забит), поэтому возвращается в кровь, где его концкентрация растёт. Ключевой признак данной желтухи – нормальный уровень в крови непрямого билирубина, но повышенный уровень прямого. В кишечник билирубин вообще не поступает, поэтому стеркобилина нет и кал вообще бесцветный (белый). В мочу не поступает стеркобилин, ди- и трипирролы, зато вдоволь поступает прямой билирубин, поэтому её цвет не сильно меняется.
Параметры |
Надпечёночная |
Печёночная |
Подпечёночная |
|
желтуха |
желтуха |
желтуха |
Причина |
Усиленный |
Поражение |
Закупорка |
|
гемолиз |
гепатоцитов |
желчного |
|
|
|
протока |
Прямой |
Норма |
Повышен |
Повышен |
билирубин крови |
|
|
|
Непрямой |
Повышен |
Повышен |
Норма |
билирубин крови |
|
|
|
Стеркобилин и |
Повышенное |
Пониженное |
Отсутствуют |
другие желчные |
содержание |
содержание |
|
пигменты в |
|
|
|
кишечнике |
|
|
|
Цвет кала |
Темнее |
Светлее |
Бесцветный |
Прямой |
Нет |
Присутствует |
Присутствует |
билирубин мочи |
|
|
|
Стеркобилин, ди- |
Повышенное |
Пониженное |
Отсутствуют |
и трипирролы |
содержание |
содержание |
|
мочи |
|
|
|
Цвет мочи |
Темнее |
Норма |
Норма |
Мы разобрали частный случай антитоксической функции печени, теперь перейдём к общим принципам. Для начала давайте решим, кого вообще обезвреживает печень? Она обезвреживает собственные токсины и ксенобиотики. Что относится к собственным токсинам? Пара примеров: печень обезвреживает аммиак, превращая его в мочевину, печень обезвреживает непрямой билирубин, печень обезвреживает продукты гниения белков, которые всасываются кишечником в кровь. А что касается ксенобиотиков? Их довольно много, печень постоянно их обезвреживает пачками. Ксенобиотики – это чужеродные вещества, не используемые в нашем организме для получения энергии или синтетических процессов. Т.е. ксенобиотики попадают в наш организм извне и не включаются в метаболизм, организму они никак не нужны, часто они бывают токсичными, поэтому наш организм стремится избавиться от них, а при необходимости
229
ещё и обезвредить. Какие бывают ксенобиотики? Классификация даст вам определённое представление о них. Два подхода в классификации: по растворимости и по происхождению. По растворимости можно выделить растворимые в воде и нерастворимые. Растворимые могут легко выводиться почками, а вот нерастворимые задерживаются в крови, оседают в тканях, и если они токсичные, то это очень большая проблема – такие ксенобиотики требуют обезвреживание и выведение с помощью печени. Теперь классификация по происхождению, выделяют три крупных группы: инфекционные, неинфекционные, пищевые. Инфекционные – продукты жизнидеятельности различных чужеродных организмов вроде вирусов, бактерий, грибка, простейших и не только. Неинфекционные подразделяются на косметические, бытовую химию и фармацевтические препараты. А пищевые подразделяются на животные, растительные, грибные (в конце концов наша еда может содержать яды, как вариант).
Так как же печень осуществляет обезвреживание ксенобиотиков? Есть два этапа. Первый этап подразумевает непосредственные манипуляции со структурой молекулы, т.е. её окисление, восстановление или гидролиз (если есть, что гидролизовать), при таких изменениях ксенобиотик чаще всего теряет свою биологическую активность/токсичность. Из перечисленных методов самый популярный – окисление, которое чаще всего подразумевает создание на молекуле гидроксильной группы, что бывает крайне важно для второго этапа. Второй этап – конъюгация – присоединение к ксенобиотику очень полярных молекул (глюкуроновая кислота, серная, глутатион, таурин, глицин) либо метилирование/ацетилирование для некоторых видов ксенобиотиков, которые будучи гидрофильными всё равно остаются токсичными. Полярные молекулы-конъюганты обычно присоединяются через гидроксильную группу, которая образуется в первом этапе. Два этапа обезвреживания приводят к потере токсичности и увеличению гидрофильности, последнее способствует лучшему выведению ксенотиотика из организма.
Теперь подробнее о первом этапе. Как я и сказал, это восстановление, окисление или гидролиз. Меры, изменяющие особенности структуры ксенобиотика с целью изменения его свойств, а именно, уменьшение токсичности. Из трёх методов самым популярным является окисление. Существует микросомальное и немикросомальное окисление. Микросомальное окисление происходит в особых участках ЭПР – микросомах – в которых все ферменты встроены в мембрану, а в самой полости нет ничего, кроме ксенобиотика, это такие маленькие универсальные фабрики по окислению чего угодно. Немикросомальное окисление происходит в цитоплазме и некоторых других органеллах. Известный вам пример немикросомального окисления – это МАО
230
