
- •Часть 1 Волновая оптика
- •1 Волновая теория света
- •1.1 Электромагнитные волны
- •1.2 Операторная запись уравнений Максвелла
- •1.4 Свойства электромагнитных волн
- •1.5 Шкала электромагнитных волн
- •1.6 Фазовая и групповая скорости
- •1.7 Основные фотометрические величины
- •2 Геометрическая оптика
- •2.1 Законы геометрической оптики
- •2.3 Показатель преломления
- •2.4 Принцип Ферма
- •2.5 Преломление света на сферических поверхностях
- •2.6 Фокус сферической поверхности
- •2.7 Центрированные оптические системы. Линзы
- •2.8 Формула тонкой линзы
- •2.9 Построение изображения в тонких линзах
- •2 .10 Плоские зеркала
- •2.11 Сферические зеркала
- •3 Интерференция света
- •3.1 Интерференция волн
- •3.2 Условия возникновения интерференции. Когерентность
- •3.3 Способы получения интерференции
- •3.4 Влияние размеров источника. Пространственная когерентность
- •3.5 Интерференция волн, испускаемых двумя точечными источниками
- •3.6 Классические интерференционные опыты
- •3.7 Интерференция в тонких пленках
- •3.8 Интерференция в тонких пленках переменной толщины
- •Кольца Hьютона являются классическим примером интерференционных полос от пластины переменной толщины. П ример. Кольца Ньютона
- •3.9 Интерферометр Майкельсона
- •3.10 Многолучевая интерференция
- •4 Дифракция света
- •4.1 Принцип Гюйгенса
- •4.2 Принцип Гюйгенса-Френеля
- •4.3 Зоны Френеля
- •4.4 Применение метода зон Френеля
- •4 .5 Дифракция Фраунгофера на щели
- •4.6 Дифракция от двух параллельных щелей
- •4.7 Дифракционная решетка
- •4.8 Оптические характеристики дифракционных решеток
- •4.9 Дифракция рентгеновских лучей
- •5 Поляризация света
- •5.2 Естественный и поляризованный свет
- •5.3 Поляризация при отражении и преломлении на границе раздела двух сред
- •5.4 Оптически одноосные кристаллы
- •5.5 Оптически активные вещества
- •6 Взаимодействие света с веществом
- •6.1 Электронная теория дисперсии света
- •6.2 Нормальная и аномальная дисперсии
- •6.3 Поглощение света
- •6.4 Рассеяние света
- •Часть 2 Квантовая оптика
- •7 Тепловое излучение
- •7.1 Равновесное излучение
- •7.2 Закон Кирхгофа. Абсолютно черное тело
- •7.3 Законы теплового излучения
- •7.4 Формула Планка
- •8 Корпускулярные свойства света
- •8.1 Фотон
- •8.2 Внешний фотоэффект
- •8.3 Уравнения Эйнштейна для внешнего фотоэффекта
- •8.4 Внутренний фотоэффект
- •8 .5 Комптоновское рассеяние
- •8.6 Давление света
- •Часть 3 Основы атомной физики
- •9. Элементы квантовой механики
- •9.1 Гипотеза де Бройля
- •9.2 Соотношение неопределенностей
- •9.3 Уравнение Шредингера
- •9.4 Квантование атомных систем
- •9.5 Спин
- •10 Строение атомов и их оптические свойства
- •10.1 Модели атома Томсона и Резерфорда
- •10.2 Постулаты Бора. Опыт Франка и Герца
- •10.3 Теория водородоподобного атома
- •10.4 Принцип неразличимости тождественных частиц. Принцип Паули
- •10.5 Периодическая система химических элементов
- •Часть 4 Основы физики атомного ядра
- •11 Строение и свойства атомных ядер
- •11.1 Атомное ядро
- •11.2 Энергия связи ядра
- •11.3 Радиоактивность
- •11.4 Закон радиоактивного распада
- •11.5 Ядерные реакции
- •11.6 Термоядерный синтез
- •Содержание
- •Часть 1. Волновая оптика 3
- •1 Волновая теория света 3
- •1.1 Электромагнитные волны 3
- •1.2 Операторная запись уравнений Максвелла 4
- •3.1 Интерференция волн 36
- •Часть 2. Квантовая оптика 99
- •8 Корпускулярные свойства света 108
- •Часть 3. Основы атомной физики 119
- •Часть 4. Основы физики атомного ядра 139
9.5 Спин
Наличие
у атомов магнитных моментов и их
квантование было доказано прямыми
опытами Отто Штерна
(1888-1969) и
Вальтера Герлаха
(1889-1979). Опыты
заключались в следующем. В сосуде с
высоким вакуумом создавался узкий пучок
исследуемых атомов. Пучок проходил
через сильное магнитное поле. Конфигурация
полюсных наконечников магнита такая,
чтобы создать сильное неоднородное
магнитное поле. Если предположить, что
атом обладает магнитным моментом, то в
направлении оси z
пучок должен расщепиться на 2l+1
пучок (это определяется квантовым числом
ml).
Однако, число пучков было не только
нечетным, а напротив, было всегда четным.
В первоначальных опытах использовались
атомы серебра и водорода. Для этих
элементов
![]() ,
но при этом пучок разделялся на два
пучка.
,
но при этом пучок разделялся на два
пучка.
Другие
опыты, которые говорили о недостатках
квантовой теории, состояли в исследовании
спектральных линий щелочных металлов.
Исследования атомов с помощью приборов
высокой точности показали, что каждая
спектральная линия образует дуплетную
структуру, то есть состоит из двух
близких линий. Такие результаты наводили
на мысль о существовании четвертого
квантового числа. Гипотеза состояла в
том, что у электрона имеется не только
момент количества движения, связанный
с движением электрона как целого, но
существует еще собственный механический
момент количества движения. Он был
назван спином.
Его обозначают
![]() .
.
Поначалу предполагалось, что спин связан с вращением электрона вокруг своей оси. Однако, в этом случае отношение проекции магнитного спинового момента на некоторую ось к проекции спина на ту же ось должно было быть в два раза меньше, чем это показывает опыт. Таким образом, спин не имеет классического истолкования. Величина спина электрона определяется по общим законам квантовой механики
![]() ;
;
![]() , (9.5.1)
, (9.5.1)
где
![]() .
.
Наличие собственного момента количества движения было также обнаружено и у других частиц. Для различных частиц квантовое число ms может принимать значения 0, 1/2, 1.
10 Строение атомов и их оптические свойства
10.1 Модели атома Томсона и Резерфорда
Вопрос о строении вещества возник задолго до наших дней. Еще в античные времена было сделано предположение о том, что все вещества состоят из атомов – неделимых частиц. Однако исследования в этом направлении стали возможны только в XVIII веке. Во второй половине XIX века было уже известно, что в состав любого вещества входят электроны. Поэтому возникли предположения, что атом не является неделимой частицей. В 1903 году Джозеф Джон Томсон (1856-1940) предложил модель атома, согласно которой атом представляет собой равномерно заполненный положительным зарядом шар, внутри которого находятся электроны. Суммарный положительный заряд шара равен суммарному заряду электронов. Рассуждения, связанные с излучением атомов, (излучает электрон – гармонический осциллятор) приводили к правильному по порядку величины размеру атомов ~ 10–10 м. Однако экспериментальные исследования Эрнеста Резерфорда (1871-1937) показали несостоятельность этой модели.
Резерфорд проводил опыты по рассеянию -частиц при прохождении через тонкий слой вещества. При этом наблюдалось отклонение небольшого числа частиц на углы, превышающие 90. Однако число таких частиц составляло ничтожную долю от общего числа частиц. Основная же масса рассеивалась на углы порядка 13. В то время было известно, что -частицы имеют положительный, заряд равный 2е, и, что при потере этого заряда они превращаются в атомы гелия. В связи с тем, что масса -частицы в тысячи раз больше массы электрона, представлялось невозможным рассеяние их на электронах. Резерфорд предположил, что атом состоит из положительно заряженного ядра, в котором сосредоточена почти вся масса атома. Вокруг ядра вращаются электроны. Количество рассеянных на большие углы -частиц давало основание предполагать, что размеры ядра малы по сравнению с размерами атома.
П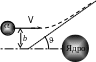 риведем
рассуждения Резерфорда. Так как ядро и
-частицы
имеют одинаковый знак, то при прохождении
последней вблизи ядра возникают силы
кулоновского отталкивания. При этом
-частица
начинает двигаться по параболе. Асимптоты,
проведенные к параболе, дают угол
рассеяния .
Для угла рассеяния Резерфорд получил
формулу
риведем
рассуждения Резерфорда. Так как ядро и
-частицы
имеют одинаковый знак, то при прохождении
последней вблизи ядра возникают силы
кулоновского отталкивания. При этом
-частица
начинает двигаться по параболе. Асимптоты,
проведенные к параболе, дают угол
рассеяния .
Для угла рассеяния Резерфорд получил
формулу
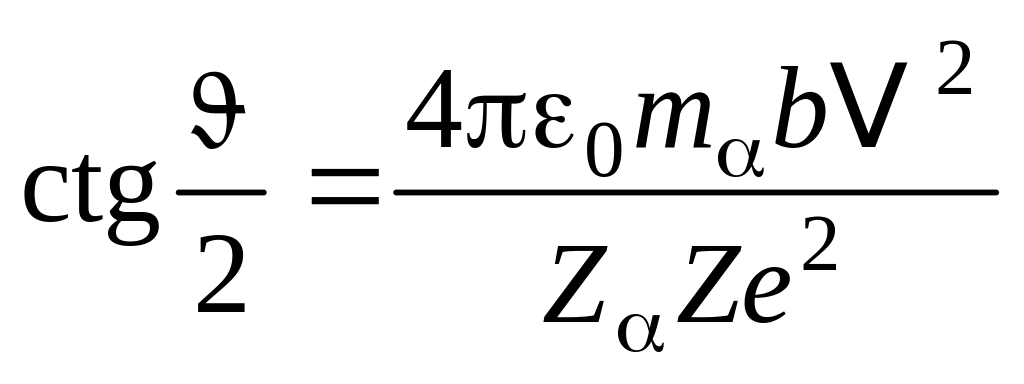 , (10.1.1)
, (10.1.1)
где m – масса -частицы, V – ее скорость вдали от ядра, Ze – заряд ядра, Ze – заряд -частицы, b – прицельный параметр, равный минимальному расстоянию между ядром и первоначальным направлением движения -частиц.
Количество
-частиц
dN,
рассеянных в телесный угол
![]() в направлении угла ,
равно
в направлении угла ,
равно
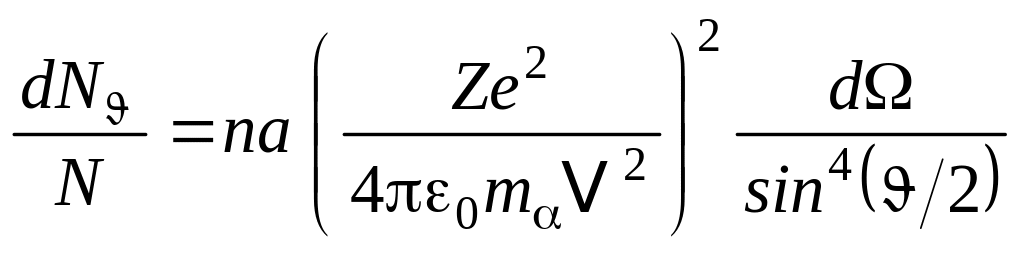 , (10.1.2)
, (10.1.2)
г де
a – толщина
слоя вещества, n – число
атомов вещества в единице объема,
N – общее
число -частиц.
Формула (10.1.2), которая получила название
формулы
Резерфорда,
была использована им для интерпретации
опытов по рассеянию -частиц.
В случае, если прицельный параметр
де
a – толщина
слоя вещества, n – число
атомов вещества в единице объема,
N – общее
число -частиц.
Формула (10.1.2), которая получила название
формулы
Резерфорда,
была использована им для интерпретации
опытов по рассеянию -частиц.
В случае, если прицельный параметр
![]() ,
то угол
,
то угол
![]() .
Приравняв кинетическую энергия -частиц
к потенциальной энергии воздействия
ее с ядром в момент полной остановки
частицы, найдем минимальное расстояние,
на которое может приблизиться -частица
к центру ядра
.
Приравняв кинетическую энергия -частиц
к потенциальной энергии воздействия
ее с ядром в момент полной остановки
частицы, найдем минимальное расстояние,
на которое может приблизиться -частица
к центру ядра
![]() или
или
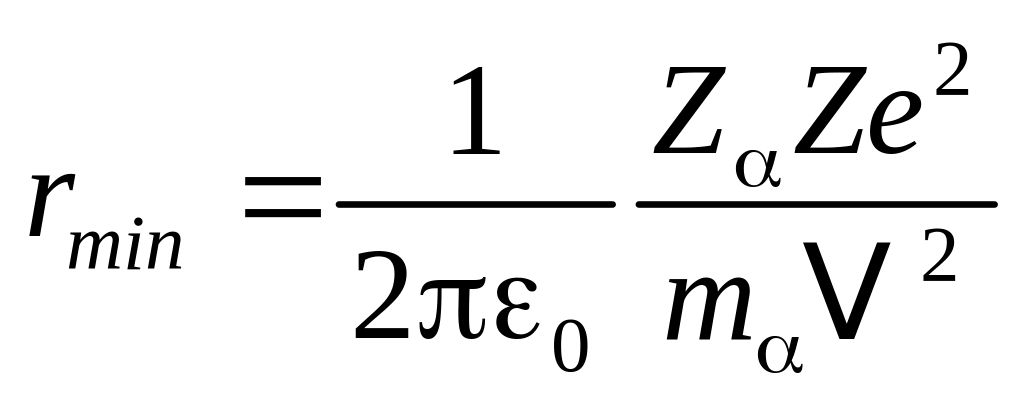 .
.
Учитывая, что скорость -частиц достигает ~ 10 7 м/с, получим, что rmin 10 –14 м. Это на четыре порядка меньше, чем размеры атома.
На основании своих опытов Резерфорд пришел к выводу, что атомы состоят из ядра, малого по сравнению с размерами всего атома, в котором сосредоточена почти вся масса атома. Вокруг ядра движутся электроны, масса которых мала по сравнению с массой ядра. Такая модель атома была названа ядерной моделью.
