
Краткий курс общей физики
..pdfгде i – сумма числа поступательных, вращательных и удвоенного числа колебательных степеней свободы молекулы,
i iпост iвращ 2iколеб. |
(2.22) |
Для молекул с жесткой связью между атомами i совпадает
счислом степеней свободы молекулы.
2.1.4.Закон Максвелла распределения молекул идеального газа по скоростям
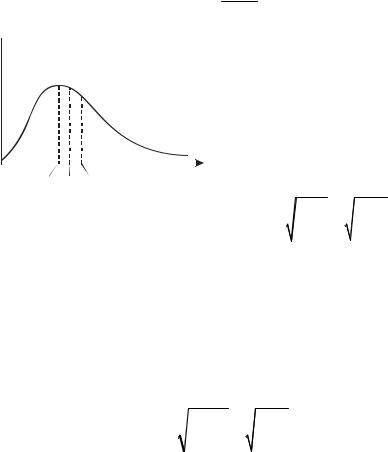
Врезультате многократных соударений скорость каждой молекулы изменяется по модулю и направлению. Однако из-за хаотического движения молекул все направления движения являются равновероятными, т.е. в любом направлении в среднем движется одинаковое количество молекул. Согласно молекулярно-кинетической теории, как бы ни изменялись скорости молекул при столкновениях, средняя квадратичная скорость (2.20) молекул газа массой m в газе, находящемся в состоянии равновесия при T = const, остается постоянной. Это объясняется тем, что в газе, находящемся в состоянии равновесия, устанавливается некоторое стационарное, не меняющееся со временем распределение молекул по скоростям, подчиняющееся вполне определенному закону. Этот закон теоретически выведен Дж. Максвеллом.
Максвелл предполагал, что газ состоит из большого числа N одинаковых молекул (они находятся в состоянии хаотического теплового движения при одинаковой температуре) и что силовые поля на газ не действуют.
Закон Максвелла определяет некоторую функцию f(v), назы-
ваемую функцией распределения молекул по скоростям.
Если разбить диапазон скоростей молекул на малые интервалы, равные dv, то на каждый интервал скорости будет приходиться некоторое число молекул dN(v), имеющих скорость, заключенную в этом интервале. Функция f(v) определяет относительное число молекул dN(v)/N, скорости которых лежат в интервале [v, v + dv] (или вероятность dP того, что скорость молекулы принадлежит данному интервалу):
dP |
dN(v) |
f (v)dv. |
(2.23) |
|
N |
||||
|
|
|
91
Вероятность того, что молекула имеет какую-либо скорость, равна единице:
|
|
f (v)dv 1. |
(2.24) |
0 |
|
Условие (2.24) называют условием нормировки.
Применяя методы теории вероятностей, Максвелл нашел функцию f(v) – закон распределения молекул идеального газа по скоростям (рис. 2.2):
f (v) Av2 |
|
mмолv |
2 |
|
, |
(2.25) |
exp |
|
|
||||
|
|
2kT |
|
|
|
|
где k – коэффициент Больцмана; A – константа, найденная из условия нормировки (2.24), бесконечный верхний предел для скорости в котором оправдан ввиду малости подынтегрального выражения
для больших скоростей,
 f(v)
f(v)
3
A 4 mмол 2 .2 kT
Скорость, при которой функция распределения молекул идеального газа по скоростям максимальна, называется наиболее веро-
ятной скоростью vвер. Значение
|
|
|
|
|
|
наиболее вероятной скорости мож- |
||||
|
|
|
|
|
|
но найти, исследовав на максимум |
||||
0 |
vв |
v |
ср.кв.кв. |
v функцию (2.25): |
|
|
||||
|
|
вер<v> |
|
|
|
|
|
|
|
|
|
|
Рис. 2.2 |
|
vвер |
2kT |
|
2RT . |
(2.26) |
||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
mмол |
|
|
|
Средняя скорость молекулы <v> (средняя арифметическая скорость) и среднее значение квадрата скорости <v2> определяются по формулам из теории вероятностей:
|
1 |
|
|
|
|
|
|
v |
v dN(v) v f (v)dv, v2 v2 f (v)dv. |
|
|||||
N |
|
||||||
|
0 |
0 |
|
|
0 |
|
|
Произведя вычисления, можно получить: |
|
||||||
|
|
v |
8kT |
|
8RT |
, |
(2.27) |
|
|
m |
|
||||
|
|
|
|
|
|
||
|
|
|
мол |
|
|
|
|
92
v2 |
3kT |
|
3RT |
, |
(2.28) |
|
m |
|
|||||
|
|
|
|
|||
|
мол |
|
|
|
|
откуда для средней квадратичной скорости получается соотношение (2.20). Приведенные характерные скорости отличаются друг от друга в следующих пропорциях:
vвер: <v>: vср.кв = 1: 1,13: 1,22.
Зная распределение Максвелла по скоростям (2.25), можно, например, оценить число молекул, скорости которых лежат в произвольном интервале [v1, v2]:
v2 |
|
N N f (v)dv, |
(2.29) |
v1 |
|
где N – общее число молекул.
2.1.5. Барометрическая формула. Распределение Больцмана
При выводе закона Максвелла для распределения молекул идеального газа по скоростям мы предположили, что на молекулы газа внешние силы не действуют. Поэтому можно было считать, что молекулы равномерно распределены по объему сосуда; температура везде одинакова.
На самом деле молекулы газа всегда находятся в поле тяготения Земли. Если бы не было теплового движения, то все молекулы атмосферного воздуха упали бы на Землю, а если бы не было тяготения, то атмосферный воздух рассеялся бы по всей Вселенной. Тяготение и тепловое движение приводят газ в состояние, при котором его концентрация и давление убывают с высотой.
Пусть идеальный газ находится в равновесном состоянии воднородном поле тяготения Земли. Давление газа на высоте h обусловленовесом вышележащихслоев. Обозначим рдавление на высоте h, тогда давление на высоте h + dh равно р+ dp, причем если dh>0, то dp<0, так как вес вышележащих слоев атмосферы, аследовательно, идавлениес высотойубывают. Разностьдавленийриp+dp равна весу газа, заключенного в объеме вертикального цилиндра с площадью основания, равной единице, и высотой dh: p – (p + dp) = g dh, где – плотностьгазана высоте h. Отсюда
dp = – g dh. |
(2.30) |
93
Из уравнения состояния идеального газа (2.13) выразим плотность газа и, подставляя в (2.29), получим приращение давления:
dp |
pg |
dh, интегрируя которое (полагая T = const) по высоте от |
|||||||
|
|||||||||
|
RT |
|
|
|
|
|
|
|
|
|
|
p |
dp |
|
g |
h |
|
|
|
0 до h, получим: |
|
dh, или |
|
||||||
|
|
|
|||||||
|
|
p |
p |
|
RT 0 |
|
|
|
|
0 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
p p e |
|
gh |
(2.31) |
|
|
|
|
|
|
|
RT , |
||
|
|
|
|
|
0 |
|
|
|
|
где р и р0 – давления газа на высотах h и h = 0.
Формула (2.31) называется барометрической. Из нее следует, что давление убывает с высотой по экспоненциальному закону.
Барометрическая формула позволяет определять высоту h с помощью барометра. Специально проградуированный барометр для непосредственного отсчета высоты над уровнем моря называют альтиметром. Его широко применяют в авиации, при восхождении на горы.
Преобразуя в выражении (2.31) показатель степени (поделив на число Авогадро), получаем:
p p e |
mмолgh |
|
||
|
kT |
, |
(2.32) |
|
0 |
|
|
|
|
где mмолg h = п – потенциальная энергия молекулы на высоте h.
При T = const давление p пропорционально концентрации молекул n (см. (2.14)), поэтому можем записать:
n n e |
mмолgh |
n e |
|
п |
|
||
|
kT |
|
kT |
, |
(2.33) |
||
0 |
|
|
0 |
|
|
|
|
где n и n0 – концентрации молекул на высотах h и h = 0.
Больцман показал, что распределение (2.33) справедливо не только в потенциальном поле сил земного тяготения, но и в любом потенциальном поле сил для совокупности любых одинаковых частиц, находящихся в состоянии хаотического теплового движения. Поэтому распределение (2.33) называют законом Больцмана.
2.1.6. Явления переноса в газах
При отсутствии равновесия в газе всегда имеется пространственная неоднородность тех или иных его параметров – плотности,
94

давления, температуры. Если такой газ предоставить самому себе, то хаотическое движение молекул постепенно выравнивает эти неоднородности и газ приходит в состояние термодинамического равновесия.
Явления выравнивания сопровождаются направленным переносом ряда физических величин: массы, импульса, энергии и т.д.
ипоэтому называются явлениями переноса.
Кявлениям переноса относятся диффузия (обусловленная переносом массы), теплопроводность (обусловленная переносом энергии) и внутреннеетрение, иливязкость(обусловленнаяпереносомимпульса).
В основе всех явлений переноса лежит один и тот же механизм: беспорядочность теплового движения молекул газа, непрерывные соударения между ними приводят к постоянному перемешиванию частиц и изменению их скоростей и энергий. Если в газе существует пространственная неоднородность (градиент) плотности, температуры или скорости упорядоченного перемещения отдельных слоев газа, то тепловое движение молекул выравнивает эти неоднородности. Таким образом, явления переноса возникают вследствие наложения хаотического движения молекул окружающей среды на упорядоченное перемещение молекул в отдельных слоях газа.
Диффузия. Диффузия в газе (жидкости) – это процесс перемешивания молекул, сопровождающийся переносом массы из мест
сбольшей концентрацией (плотностью) данных молекул в места
сменьшей концентрацией этих молекул. Таким образом, в процессе диффузии переносится масса, а изменяющейся величиной является
плотность газа .
Явление диффузии для химически однородного газа подчиняется закону Фика:
Jm x D |
d |
, |
(2.34) |
|
dx |
||||
|
|
|
где Jm x – плотность потока массы вдоль оси x – величина, определяемая массой вещества, диффундирующего в единицу времени
через единичную площадку, перпендикулярную оси x, |
J |
m x |
|
m |
; |
|
S t |
||||||
|
|
|
|
D – коэффициент диффузии, [D] = м2/с; ddx градиент плотности,
равный скорости изменения плотности на единицу длины x.
95
Коэффициент диффузии D численно равен плотности потока массы при единичном градиенте плотности.
Теплопроводность. Если в одной области газа (жидкости) средняя кинетическая энергия молекул больше, чем в другой, то с течением времени вследствие постоянных столкновений молекул происходит процесс выравнивания средних кинетических энергий молекул, иными словами выравнивание температур.
Перенос энергии (в форме теплоты) подчиняется закону Фурье:
JE x |
dT |
, |
(2.35) |
|
dx |
||||
|
|
|
где JE x – плотность теплового потока вдоль оси x – величина, оп-
ределяемая энергией, переносимой в единицу времени через еди-
ничную площадку, перпендикулярную оси x, J |
E x |
|
E |
; ко- |
|||||
S t |
|||||||||
|
|
|
|
|
|
|
|||
эффициент теплопроводности, [ ] |
Вт |
; |
dT |
|
градиент темпе- |
||||
м К |
dx |
||||||||
|
|
|
|
|
|
||||
ратуры, равный изменению температуры на единицу длины x. Коэффициент теплопроводности численно равен плотности теплового потока при единичном градиенте температуры.
Внутреннее трение (вязкость). Вязкость жидкости (газа) ха-
рактеризует те силы внутреннего трения, которые имеют место, когда отдельные слои жидкости движутся с разными скоростями. На рис. 2.3 показаны условно выделенные слои, движущиеся со скоростями v1 и v2 v1 dv . Именно между такими слоями и воз-
никают силы трения. Механизм появления этих сил можно представить следующим образом. В результате теплового движения молекулы жидкости переходят из одного слоя в другой, перенося при этом и импульс упорядоченного движения. При этом импульс упорядоченного движения слоя, который движется быстрее, уменьшается, а импульс слоя с меньшей скоростью увеличивается, т.е. слой с большей скоростью тормозится, а слой с меньшей скоростью ускоряется. А это и означает, что между слоями возникают силы внутреннего трения.
96

dx
Fтр |
v1 |
|
v1+dv
Рис. 2.3
Опыт показал, что сила внутреннего трения зависит от площади поверхности слоев S жидкости и от градиента скорости жидкости dv /dx (в направлении, перпендикулярном скорости):
|
dv |
|
|
|
||
F S |
|
|
. |
(2.36) |
||
|
||||||
тр |
|
dx |
|
|
||
|
|
|
|
|||
Коэффициент пропорциональности называется динамической вязкостью (коэффициентом вязкости жидкости); [ ] = Па с. Сле-
довательно, Fтрv . Таким образом, коэффициент вязкости чис-
S x
ленно равен силе внутреннего трения, приходящейся на единицу площади при градиенте скорости, равном единице.
Взаимодействие двух слоев согласно второму закону Ньютона можно рассматривать как процесс, при котором от одного слоя кдругому в единицу времени передается импульс, равный по модулю действующейсиле. Тогдавыражение(2.36) можнопредставитьввиде
J p x |
dv |
, |
(2.37) |
|
dx |
||||
|
|
|
где J p x – плотность потока импульса вдоль оси x – величина, оп-
ределяемая полным импульсом, переносимым в единицу времени вдоль оси x через единичную площадку, перпендикулярную этой
оси, J p x |
(mv) . |
|
S t |
Из сопоставления формул (2.34), (2.35) и (2.37), описывающих явления переноса, следует, что закономерности всех явлений переноса сходны между собой.
97
2.1.7. Реальные газы. Уравнение Ван-дер-Ваальса
При описании свойств газов мы пользовались моделью идеального газа, молекулы которого не взаимодействуют между собой на расстоянии, и их размерами можно пренебречь.
C увеличением давления и понижением температуры поведение реального газа отличается от поведения идеального газа, так как средние расстояния между молекулами уменьшаются и становится существенным взаимодействие молекул друг с другом. Кроме того, суммарный объем самих молекул становится соизмеримым с объемом сосуда, в котором находится газ.
Из большого числа уравнений, предложенных для описания поведения реальных газов, самым простым и вместе с тем дающим достаточно хорошие результаты оказалось уравнение голландского физика Й.Д. Ван-дер-Ваальса (1873).
Ван-дер-Ваальс предложил внести поправки к давлению и объему в уравнение Менделеева – Клапейрона (2.11):
|
|
|
|
|
|
p |
|
a |
V b RT , |
|
(2.38) |
||||||
|
|
|
|
|
|
|
|
V |
2 |
|
м |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
м |
|
|
|
|
|
|
|||
где а и b – постоянные Ван-дер-Ваальса, определяемые для каждо- |
|||||||||||||||||
го конкретного газа опытным путем. |
|
|
|
|
|
||||||||||||
|
Поправка |
|
a |
к давлению, |
обусловленная действием сил при- |
||||||||||||
|
|
V 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
м |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
тяжения между молекулами газа, приводит к появлению дополни- |
|||||||||||||||||
тельного давления |
на газ, называемого внутренним |
давлением, |
|||||||||||||||
а характеризует силы межмолекулярного притяжения. |
|
||||||||||||||||
|
p |
|
|
|
|
|
|
|
|
Поправка b – это поправка на так на- |
|||||||
|
T |
|
|
|
|
|
зываемый недоступный объем, равный |
||||||||||
|
|
|
|
|
|
учетверенному объему всех молекул. |
|||||||||||
|
КK |
|
T р |
|
|
|
|
|
|
Для |
произвольного количества ве- |
||||||
|
|
кр |
T |
|
|
щества с учетом того, что V Vм : |
|||||||||||
p2 |
p |
|
|
T |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
a |
|
|
|
||||
p1 |
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
(2.39) |
||
|
|
|
|
|
|
|
|
|
|
p |
V |
2 |
V b RT, |
||||
|
V1 V2 V3 |
|
V |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
где |
|
a a 2 , |
|
b b |
– постоянные Ван- |
|||||||||
|
Рис. 2.4 |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
дер-Ваальса для молей. |
|
|||||||||||
|
|
|
|
|
|
|
|
||||||||||
|
Исходя из уравнения (2.39) можно построить изотермы. Так |
||||||||||||||||
как |
уравнение |
Ван-дер-Ваальса |
представляет собой |
уравнение |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
98 |
|
|
|
|
|
|

третьей степени относительно объема V, то оно дает одно или три вещественных значения V в зависимости от p и T.
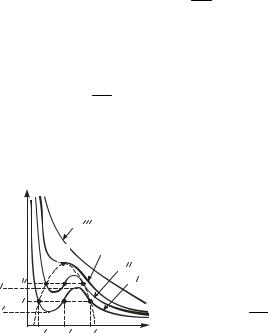
Графически теоретические изотермы Ван-дер-Ваальса представлены на рис. 2.4, где зависимость p от V дана для различных температур.
При температуре T и давлениях в пределах от p1 до p2
уравнение (2.39) имеет три вещественных корня. Различие между тремя вещественными решениями при повышении температуры уменьшается. Начиная с определенной для каждого вещества температуры Tкр при любом давлении вещественным оказывается только одно решение. Температура Tкр называется критической (точка К на рис. 2.4).
При температурах выше критической изотермы имеют форму, близкую к гиперболе рV = const, и описывают газообразное состояние вещества (почти идеальный газ).
При температурах ниже критической изотермы имеют сложную форму имогутзаходить дажевобластьотрицательныхдавлений.
Так ли действительно ведет себя газ? Ответ на этот вопрос дает эксперимент. Для того, чтобы получить изотерму опытным путем, нужно взять вещество в газообразном состоянии и начать медленно сжимать (в сосуде с поршнем), делая одновременно отсчеты давления и объема, а также следя за тем, чтобы температура вещества оставалась постоянной. Результаты подобных опытов при темпера-
туре ниже критической приведены на рис. 2.5. |
|
|
|
|
|||||
Вначале с уменьшением объема дав- |
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
ление газа растет, причем ход изотермы |
|
|
|
|
|
|
|
|
|
достаточно хорошо описывается уравне- |
|
|
|
|
|
|
|
|
|
нием Ван-дер-Ваальса. Однако, начиная |
pн.п. |
|
|
|
|
|
|
|
|
с некоторого объема Vг, эксперименталь- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
ная изотерма перестает следовать урав- |
|
|
|
|
|
|
|
|
|
|
|
Vж |
Vг |
V |
|||||
нению (2.39). Начиная с этого значения |
|
|
|||||||
объема давление в сосуде перестает из- |
|
|
|
|
|
Рис. 2.5 |
|
|
|
меняться, само же вещество при этом перестает быть однородным: часть газа конденсируется в жидкость. Происходит расслоение вещества на две фазы: жидкую и газообразную. По мере дальнейшего уменьшения объема все большая часть вещества переходит в жидкую фазу, причем переход происходит при постоянном давлении, обозначенном на рис. 2.5 pн.п. После того как процесс конденсации
99
вещества в жидкость заканчивается (это происходит при достижении объема Vж), дальнейшее уменьшение объема начинает сопровождаться быстрым ростом давления. При этом ход изотермы снова примерно следует уравнению Ван-дер-Ваальса (2.39). Вещество в состояниях, соответствующих этому участку, снова будет однородным, но представлять собой не газ, а жидкость.
Таким образом, уравнение Ван-дер-Ваальса не только описывает газообразное состояние вещества, но и охватывает также процесс перехода в жидкое состояние и процесс сжатия жидкости.
Сопоставление экспериментальной изотермы с изотермой Ван- дер-Ваальса показывает, что эти изотермы хорошо совпадают на участках, отвечающих однофазным состояниям вещества, но ведут себя различным образом в области расслоения на две фазы. Вместо S-образного завитка на изотерме Ван-дер-Ваальса экспериментальная изотерма имеет в этой области прямолинейный горизонтальный участок, который располагается так, что охватываемые завитком площади одинаковы (см. рис. 2.5).
В состояниях, соответствующих горизонтальному участку изотермы, наблюдается равновесие между жидкой и газообразной фазами вещества. Газ (или пар), находящийся в равновесии со своей жидкостью, называется насыщенным паром. Давление pн.п, при котором может существовать равновесие при данной температуре,
называется давлением (или упругостью) насыщенного пара.
С повышением температуры горизонтальный участок изотермы сокращается, стягиваясь в точку при критической температуре Tкр. Соответственно уменьшается различие в плотностях жидкости и насыщенного пара. При критической температуре это различие полностью исчезает. Одновременно исчезает всякое различие между жидкостью и паром. При температурах выше критической понятие насыщенного пара теряет смысл. При этих температурах ни при каких давлениях сжижать газ нельзя. Отсюда вытекает условие сжижения газов: для превращения газа в жидкость необходимо сжимать газ при температурах ниже критической.
Примеры решения задач
№ 1. Чему равна энергия вращательного движения всех молекул, содержащихся в 10 моль азота, при температуре 10 °С?
Д а н о: ν = 10 моль, Т = 10 °С = 283 К.
100
