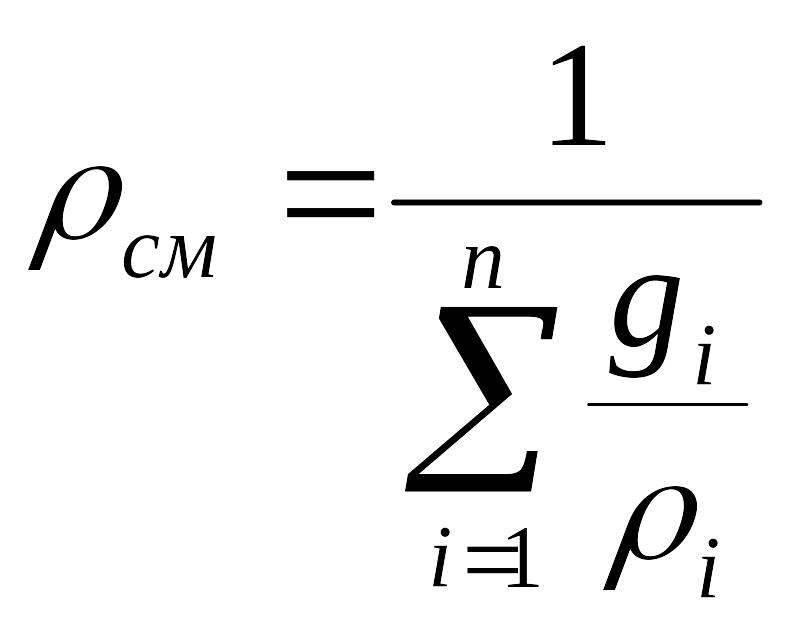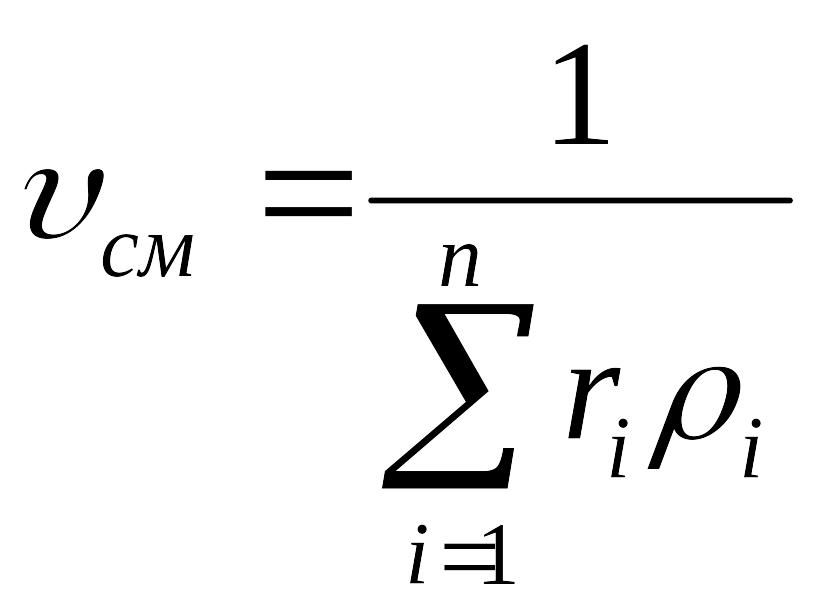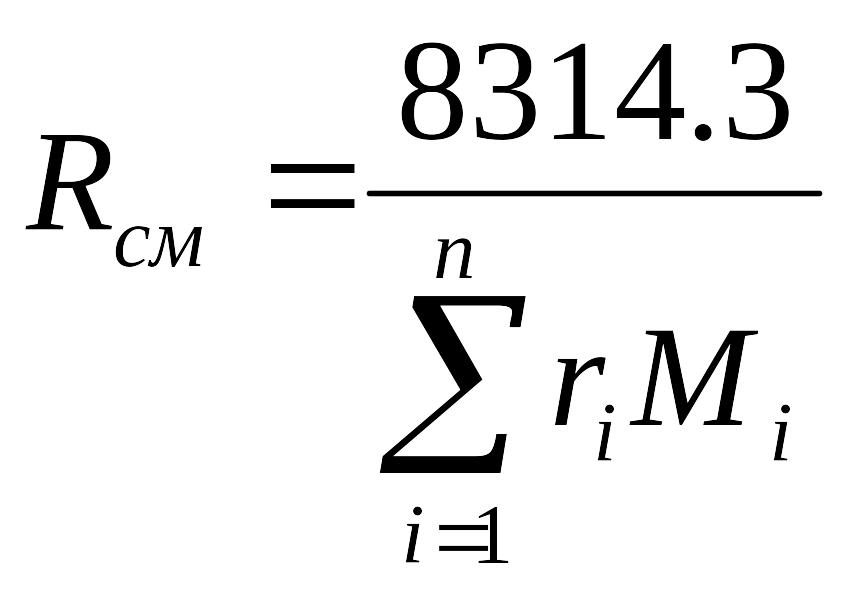- •Введение
- •Термодинамические параметры состояния
- •2. Основные понятия и определения
- •Идеальный газ. Законы идеального газа
- •Закон Бойля – Мариотта
- •Закон Гей – Люссака
- •Закон Шарля
- •3. Уравнение состояния идеального газа
- •Закон Авогадро
- •Молярная масса
- •4. Уравнение менделеева – клапейрона
- •Уравнение состояния реальных газов
- •5. Газовые смеси
- •6. Первое начало термодинамики Теплота и работа
- •Принцип эквивалентности
- •7. Внутренняя энергия
- •Закон сохранения и превращения энергии
- •Формулировки первого начала термодинамики
- •Виды работ
- •Развернутое уравнение первого закона термодинамики и его частные выражения
- •Энтальпия
- •8. Теплоемкость газов
- •9. Анализ термодинамических процессов на основании I начала термодинамики Понятие об энтропии
- •Схемы распределения энергии
- •Изотермический процесс
- •Адиабатный процесс
- •10. Политропные процессы
- •Группы политропных процессов
- •Способы определения n
- •Связь между n и с
- •11. Второе начало термодинамики Односторонность протекания самопроизвольных процессов
- •Формулировки второго начала термодинамики
- •Выражение первого закона термодинамики для циклов
- •Термический коэффициент полезного действия прямого цикла
- •12. Цикл карно
- •Термодинамическая шкала температур
- •Математическое выражение второго закона термодинамики
- •Критика учения о «тепловой смерти вселенной»
- •13. Термодинамика потока газа. Основные понятия и уравнения гидрогазодинамики
- •Уравнение неразрывности
- •Уравнение энергии – уравнение первого закона термодинамики
- •Уравнение состояния идеального газа
- •Уравнение импульса
- •Располагаемая работа газа в потоке
- •Скорость звука и критические параметры
- •14. Скорость и расход газа при течении. Истечение из сужающихся сопел
- •Переход через скорость звука. Сопло Лаваля
- •После подстановки значения скорости потока в последнее уравнение получим .
- •Истечение при наличии трения
- •Дросселирование газа
- •15. Термодинамика химических процессов
- •Термохимические процессы
- •Первый закон термодинамики применительно к химическим процессам
- •Закон Гесса
- •Второй закон термодинамики
- •Тепловой закон Нернста
- •16. Циклы поршневых двигателей внутреннего сгорания
- •Цикл со смешанным подводом тепла
- •Цикл с подводом тепла при постоянном объеме
- •Цикл с подводом тепла при постоянном давлении
- •Сравнение циклов поршневых двс
- •Сравнение по условию .
- •Сравнение по условию
- •17. Циклы компрессоров
- •Многоступенчатые компрессоры
- •Центробежный компрессор
- •Осевой компрессор
- •18. Циклы газотурбинных установок
- •Регенеративные циклы
- •19. Циклы паросиловых установок
- •Цикл Карно для водяного пара
- •Цикл Ренкина
- •Цикл с промежуточным перегревом пара
- •Регенеративный цикл
- •Бинарные циклы
- •Цикл парогазовой установки
- •Теплофикационный цикл
- •20. Циклы холодильных установок
- •Цикл воздушной холодильной машины
- •Цикл парокомпрессорной холодильной машины
- •Цикл теплового насоса
- •Детандеры
- •21. Реактивные двигатели
- •Цикл ПуВрд
- •Цикл трд
- •22. Ракетные двигатели
- •Цикл рдтт
- •Цикл жрд
- •Цикл ярд
- •Заключение
- •Библиографический список
- •Оглавление
- •394026 Воронеж, Московский просп., 14
5. Газовые смеси
Во многих тепловых машинах, турбинах в качестве рабочего тела применяется смесь газов, которых может быть несколько.
Под газовыми смесями понимают механическую смесь нескольких газов, химически между собой не взаимодействующих. Каждый из газов, образующих смесь, ведет себя так, как если бы других газов в смеси не было, т.е. равномерно распространяется по всему объему смеси, оказывает на стенки сосуда свое давление, называемое парциальным и подчиняется своему уравнению состояния. Каждый из компонентов газовой смеси распространен во всем объеме газовой смеси и развивает в ней такое давление, какое он развивал бы, занимая весь объем при температуре смеси.
Если каким-либо способом удалить из
смеси один из компонентов смеси, то
давление смеси при условии неизменности
ее температуры уменьшится на значение
![]() ,
соответствующее той доле ударов о стенки
сосуда, которая приходилась на молекулы
изъятого газа. При удалении второго
газа, входящего в смесь, давление
смеси по той же причине уменьшится на
,
соответствующее той доле ударов о стенки
сосуда, которая приходилась на молекулы
изъятого газа. При удалении второго
газа, входящего в смесь, давление
смеси по той же причине уменьшится на
![]() .
Рассуждая подобным образом, можно
доказать правильность опытного закона
Джона Дальтона (1802 г.)
.
Рассуждая подобным образом, можно
доказать правильность опытного закона
Джона Дальтона (1802 г.)
![]() ,
(5.1)
,
(5.1)
- давление газовой смеси равно сумме парциальных давлений ее компонентов. Это не удивительно, т.к. речь идет об идеальных газах, молекулы которого по определению представляют собой материальные точки, не имеющих объема и не взаимодействующие между собой каким-либо способом, кроме соударений. Чем выше давление смеси, тем большие отклонения от закона Дальтона наблюдаются в поведении газовой смеси.
Если каждый компонент смеси сжать
при постоянной температуре, равной
температуре смеси, до давления смеси
,
получим объем
![]() который называется парциальным или
приведенным объемов данного компонента
смеси. Сумма парциальных объемов,
составляющих смесь, равна объему смеси
который называется парциальным или
приведенным объемов данного компонента
смеси. Сумма парциальных объемов,
составляющих смесь, равна объему смеси
![]() ,
т.е.
,
т.е.
![]() (5.2)
(5.2)
- закон Амага.
Качественно состав газовой смеси может быть оценен различными способами.
Указанием массовых долей компонентов смеси, т.е. значениями величин
![]() ,
в долях единицы (или в процентах)
,
в долях единицы (или в процентах)
![]() . (5.3)
. (5.3)
2. Указанием объемных долей компонентов смеси, т.е. значениями величин
![]() ,
в долях единицы (или в процентах)
,
в долях единицы (или в процентах)
![]() .
(5.4)
.
(5.4)
3. Указанием молярных долей компонентов
смеси
![]() ,
в долях единицы (или в процентах)
,
в долях единицы (или в процентах)
![]() . (5.5)
. (5.5)
Нетрудно доказать, что для идеального
газа
![]() .
Действительно, умножая
.
Действительно, умножая
![]() (количество вещества
(количество вещества
![]() -
го компонента) на молярный объем
-
го компонента) на молярный объем
![]() ,
одинаковый для всех газов, взятых при
одинаковых физических условиях, получим,
что произведение
равно парциальному объему
,
одинаковый для всех газов, взятых при
одинаковых физических условиях, получим,
что произведение
равно парциальному объему
![]() взятого компонента. А
взятого компонента. А
![]()
![]() -
объему смеси, где
-
количество вещества смеси.
-
объему смеси, где
-
количество вещества смеси.
Следовательно
![]() .
(5.6)
.
(5.6)
Таким образом, задание смеси идеальных газов объемными долями компонентов равносильно заданию смеси молярными долями отдельных газов.
Следует помнить, что массовая и молярная
концентрации смеси, представляющие
собой отношение массы и количества
вещества компонента к объему смеси
(соответственно) не являются синонимами
массовой и молярной долей; в единицах
СИ их соответственно выражают в
![]() и
и
![]() .
.
Смесь задана массовыми долями.
Поскольку каждый газ, входящий в смесь, занимает весь объем смеси, то для любого ( -го) компонента смеси справедливо уравнение состояния
![]() ,
(5.7)
,
(5.7)
где
![]() и
и
![]() -
соответственно объем и температура
смеси;
-
соответственно объем и температура
смеси;
![]() -
масса рассматриваемого компонента.
-
масса рассматриваемого компонента.
Таких уравнений можно написать (по числу отдельных газов, входящих в смесь). Суммируя их почленно, получаем
![]() .
(5.8)
.
(5.8)
Далее напишем уравнение состояния для смеси в целом
![]() .
(5.9)
.
(5.9)
Очевидно, что
![]() .
(5.10)
.
(5.10)
Из сравнения формул (5.8) и (5.9) с учетом (5.10) имеем
![]() .
(5.11)
.
(5.11)
Разделив обе части формулы (5.11) на
![]() ,
получим
,
получим
![]() -
газовая постоянная смеси равна сумме
произведений газовых постоянных
отдельных газов на их массовые доли.
-
газовая постоянная смеси равна сумме
произведений газовых постоянных
отдельных газов на их массовые доли.
Разделив почленно уравнение (5.6) на (5.8), найдем выражение для парциального давления:
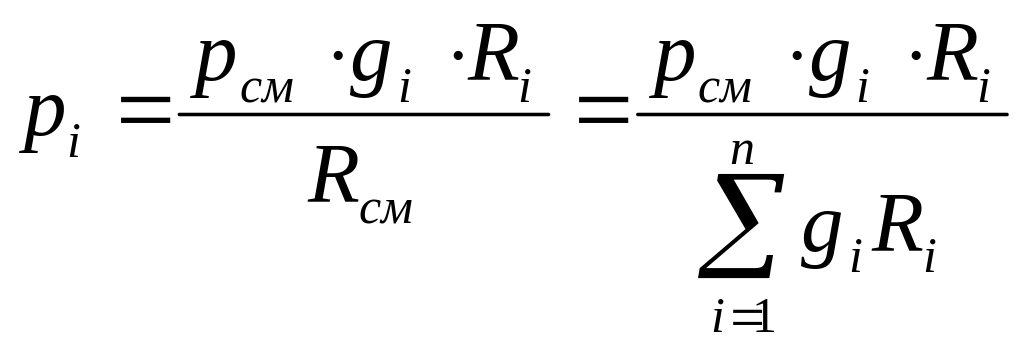 .
(5.12)
.
(5.12)
Между парциальным объемом , входящего в смесь газа, и его массой , существует очевидная зависимость
![]() ,
а поскольку
,
а поскольку
![]() ,
то
,
то
![]() .
.
Такая же зависимость существует между
объемом смеси
и ее массой
![]() :
:
![]() ,
т.к.
,
т.к.
![]() ,
то из этих формул получаем
,
то из этих формул получаем
![]() . Деля
oбe части
этого равенства на
,
и решая относительно
. Деля
oбe части
этого равенства на
,
и решая относительно
![]() ,
получим расчетное выражение для молярной
массы смеси
,
получим расчетное выражение для молярной
массы смеси
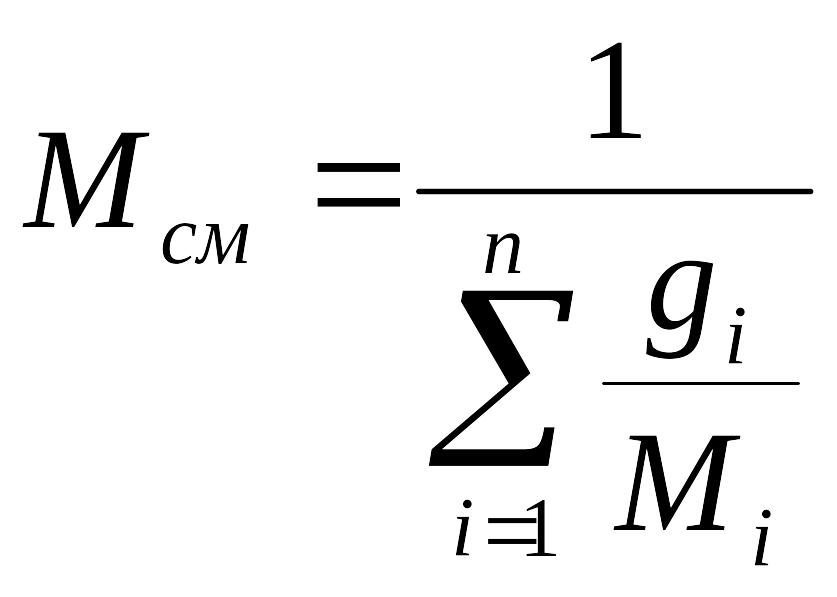 - кажущаяся молекулярная масса смеси.
Названа так, поскольку не существует
однородного химического соединения
с такой молекулярной массой. Аналогично
для плотности смеси
- кажущаяся молекулярная масса смеси.
Названа так, поскольку не существует
однородного химического соединения
с такой молекулярной массой. Аналогично
для плотности смеси
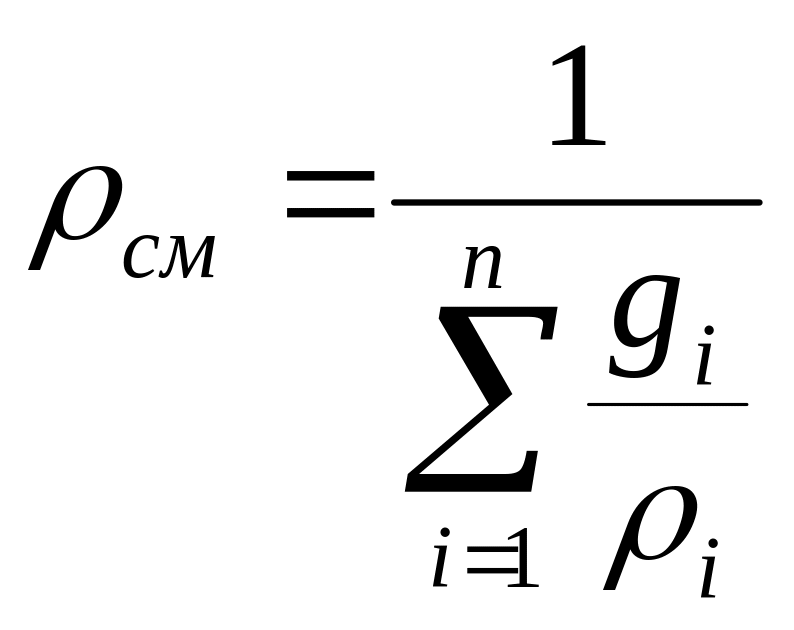 .
.
Очевидно, что кажущаяся
молекулярная масса смеси может быть
определена и как отношение универсальной
газовой постоянной к газовой постоянной
смеси
![]() .
2. Смесь задана объемными долями.
.
2. Смесь задана объемными долями.
Иногда
удобно задавать смесь по объемному
составу. Для каждого газа, входящего в
смесь по закону Бойля-Мариотта можем
записать
![]() ,
откуда
,
откуда
![]() - парциальное давление компонента смеси
равно произведению объемной доли
-
го компонента на давление смеси.
- парциальное давление компонента смеси
равно произведению объемной доли
-
го компонента на давление смеси.
Кажущаяся молекулярная масса смеси
может быть определена следующим образом:
![]() ,
но
,
но
![]() ,
и тогда
,
и тогда ![]() ,
откуда
,
откуда
![]() .
Учитывая, что
.
Учитывая, что
![]() ,
получим
,
получим
![]() - равна сумме произведений молекулярных
масс газов, входящих в смесь, на их
объемные (мольные) доли. Аналогично, для
плотности смеси
- равна сумме произведений молекулярных
масс газов, входящих в смесь, на их
объемные (мольные) доли. Аналогично, для
плотности смеси
![]() .
Газовая постоянная смеси находится по
соотношению
.
Газовая постоянная смеси находится по
соотношению
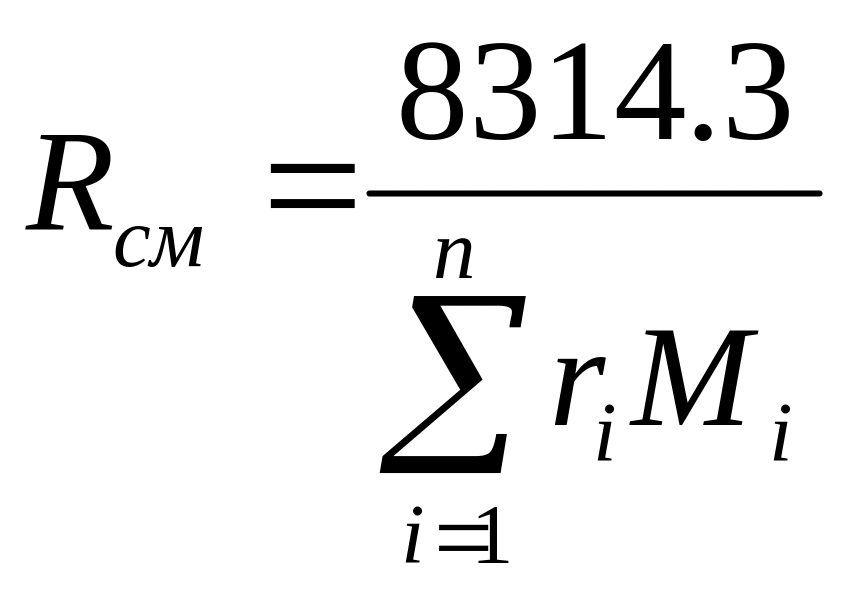 .
.
Связь между массовыми и объемными долями:
Имеет место следующая зависимость:
![]() ,
или
,
или
![]() .
.
2) По закону Авогадро
![]() , или
, или
![]() ,
поэтому
,
поэтому
![]() ,
или
,
или
![]() ,
при этом
,
при этом
![]() ,
или
,
или ![]() ,
,
3) Газовая постоянная смеси может быть
определена по составу смеси и газовым
постоянным отдельных компонентов. Т.к.
![]() ,
то
,
то
![]() и
и
![]() ,
или
,
или
![]() .
Тогда
.
Тогда
![]() , или
, или
![]()
Таблица 5.1
Формулы для расчета газовых смесей
Задание состава смеси |
По массовым долям |
По объемным долям |
Пересчет из одного состава в другой |
|
|
Плотность и удельный объем,
и |
|
|
Кажущаяся молекулярная масса смеси |
|
|
Газовая постоянная смеси, Дж/кгК |
|
|
Парциальное давление, Па |
|
|