
- •Введение
- •Термодинамические параметры состояния
- •2. Основные понятия и определения
- •Идеальный газ. Законы идеального газа
- •Закон Бойля – Мариотта
- •Закон Гей – Люссака
- •Закон Шарля
- •3. Уравнение состояния идеального газа
- •Закон Авогадро
- •Молярная масса
- •4. Уравнение менделеева – клапейрона
- •Уравнение состояния реальных газов
- •5. Газовые смеси
- •6. Первое начало термодинамики Теплота и работа
- •Принцип эквивалентности
- •7. Внутренняя энергия
- •Закон сохранения и превращения энергии
- •Формулировки первого начала термодинамики
- •Виды работ
- •Развернутое уравнение первого закона термодинамики и его частные выражения
- •Энтальпия
- •8. Теплоемкость газов
- •9. Анализ термодинамических процессов на основании I начала термодинамики Понятие об энтропии
- •Схемы распределения энергии
- •Изотермический процесс
- •Адиабатный процесс
- •10. Политропные процессы
- •Группы политропных процессов
- •Способы определения n
- •Связь между n и с
- •11. Второе начало термодинамики Односторонность протекания самопроизвольных процессов
- •Формулировки второго начала термодинамики
- •Выражение первого закона термодинамики для циклов
- •Термический коэффициент полезного действия прямого цикла
- •12. Цикл карно
- •Термодинамическая шкала температур
- •Математическое выражение второго закона термодинамики
- •Критика учения о «тепловой смерти вселенной»
- •13. Термодинамика потока газа. Основные понятия и уравнения гидрогазодинамики
- •Уравнение неразрывности
- •Уравнение энергии – уравнение первого закона термодинамики
- •Уравнение состояния идеального газа
- •Уравнение импульса
- •Располагаемая работа газа в потоке
- •Скорость звука и критические параметры
- •14. Скорость и расход газа при течении. Истечение из сужающихся сопел
- •Переход через скорость звука. Сопло Лаваля
- •После подстановки значения скорости потока в последнее уравнение получим .
- •Истечение при наличии трения
- •Дросселирование газа
- •15. Термодинамика химических процессов
- •Термохимические процессы
- •Первый закон термодинамики применительно к химическим процессам
- •Закон Гесса
- •Второй закон термодинамики
- •Тепловой закон Нернста
- •16. Циклы поршневых двигателей внутреннего сгорания
- •Цикл со смешанным подводом тепла
- •Цикл с подводом тепла при постоянном объеме
- •Цикл с подводом тепла при постоянном давлении
- •Сравнение циклов поршневых двс
- •Сравнение по условию .
- •Сравнение по условию
- •17. Циклы компрессоров
- •Многоступенчатые компрессоры
- •Центробежный компрессор
- •Осевой компрессор
- •18. Циклы газотурбинных установок
- •Регенеративные циклы
- •19. Циклы паросиловых установок
- •Цикл Карно для водяного пара
- •Цикл Ренкина
- •Цикл с промежуточным перегревом пара
- •Регенеративный цикл
- •Бинарные циклы
- •Цикл парогазовой установки
- •Теплофикационный цикл
- •20. Циклы холодильных установок
- •Цикл воздушной холодильной машины
- •Цикл парокомпрессорной холодильной машины
- •Цикл теплового насоса
- •Детандеры
- •21. Реактивные двигатели
- •Цикл ПуВрд
- •Цикл трд
- •22. Ракетные двигатели
- •Цикл рдтт
- •Цикл жрд
- •Цикл ярд
- •Заключение
- •Библиографический список
- •Оглавление
- •394026 Воронеж, Московский просп., 14
9. Анализ термодинамических процессов на основании I начала термодинамики Понятие об энтропии
Существуют такие термодинамические процессы, при которых остается неизменной одна из трех величин, характеризующих состояние ТРТ, или некоторый комплекс величин. Таких процессов всего четыре: изохорный (V = const), изобарный (P = const), изотермический (T = const) и адиабатный (dq = 0). Эти процессы называются основными.
Для того, чтобы провести исследование основных термодинамических процессов, рабочим телом которых является идеальный газ, необходимо предварительно ввести понятие об еще не упоминавшемся до сих пор параметре состояния термодинамической системы – энтропии и об основанной на ней TS- диаграмме. Термин введен в 1865 г. Р. Клаузиусом от греческого - превращение, изменение. Дело в том, что с помощью только p, , T, u, i нельзя графически изображать количество теплоты, участвующее в том или ином процессе, как это делается применительно к работе, изображавшейся в p – координатах. Понятие об энтропии строится на основе следующих соображений.
Рассмотрим
одно из выражений уравнения первого
закона термодинамики
![]() ,
получим
,
получим
![]() ,
а так как из уравнения Клапейрона
,
а так как из уравнения Клапейрона
p
=
RT
следует, что
![]() ,
то подставив в равенство значение
,
то подставив в равенство значение
![]() ,
получим
,
получим
![]() .
.
(Из
математики известно, что всякий двучлен
можно представить в виде полного
дифференциала, если его умножить на так
называемый интегрирующий множитель. У
нас в качестве его
![]() ).
).
Правая
часть нашего уравнения представляет
собой полный дифференциал некоторой
функции переменных Т и
.
Обозначив эту функцию через S,
запишем
![]() (=cp
(=cp![]() .
.
Другими
словами, величина
![]() есть полный дифференциал dS
функции S,
определяемый состоянием газа (температурой
и удельным объемом). Приращение энтропии
в равновесном процессе не зависит от
характера процесса. Таким образом, в
термодинамике обнаруживается еще одна
функция состояния, которая помогла
вскрыть специфичность теплоты при ее
превращениях в работу в тепловом
двигателе. В настоящее время роль и
значение этой математической функции
значительно возросли и с ее помощью
анализируются уже многие процессы,
происходящие в природе, вплоть до анализа
развития звездных миров, развития жизни,
теории информации и др.
есть полный дифференциал dS
функции S,
определяемый состоянием газа (температурой
и удельным объемом). Приращение энтропии
в равновесном процессе не зависит от
характера процесса. Таким образом, в
термодинамике обнаруживается еще одна
функция состояния, которая помогла
вскрыть специфичность теплоты при ее
превращениях в работу в тепловом
двигателе. В настоящее время роль и
значение этой математической функции
значительно возросли и с ее помощью
анализируются уже многие процессы,
происходящие в природе, вплоть до анализа
развития звездных миров, развития жизни,
теории информации и др.
Удельную
энтропию, так же как и удельную внутреннюю
энергию, и другие функции состояния, в
термодинамике определяют лишь с точностью
до постоянной
![]() .
.
Поэтому вычисление удельной энтропии проводят от условно принятого состояния, в котором полагают So =0.
В некоторых случаях полагают, что при ОК So = 0.
Удельная энтропия в СИ выражается в Дж/кгК, энтропия (S=ms – произведение удельной энтропии на массу) – в Дж/К. Их нельзя измерить непосредственно приборами, как, например, давление или температуру. Ее или, вернее, ее изменение можно вычислить, если заданы параметры состояния.
Наше
уравнение дает приращение энтропии при
бесконечно малом изменении состояния
газа. Проинтегрировав это уравнение,
получим изменение энтропии для конечного
изменения состояния 1 кг газа: s2-s1=CV
n![]() .
.
Подробно об энтропии и ее физическом смысле мы поговорим при рассмотрении второго начала термодинамики.
Сейчас нас интересует связь между изменением энтропии и количеством теплоты, которая выглядит следующим образом: dq = Tds – из определения энтропии.
Элементарное количество подведенной (отведенной) удельной теплоты в равновесных процессах равно произведению термодинамической температуры на изменение удельной энтропии.
Полное
количество удельной теплоты q1,2
=
![]() .
.
Выражение для элементарного количества теплоты dq оказывается аналогичным формуле для элементарной работы изменения объема d = pd . Эта аналогия имеет принципиальное значение, – она связана с основным существом энергетического обмена между ТРТ и окружающей средой.
Заметим следующее.
Подобно тому, как разность давлений является побудительной силой для передачи механической энергии в форме работы изменения удельного объема, так и разность температур – причина передачи энергии в форме теплоты. Температура выступает здесь в роли теплового потенциала. Чем больше разность тепловых потенциалов ТРТ и окружающей среды, тем интенсивнее происходит теплообмен.
Подобно тому, как изменение удельного объема является обязательным условием совершения (или затраты) деформационной работы, изменение энтропии является обязательным условием подвода (или отвода) теплоты. И, наоборот, только вследствие подвода (или отвода) теплоты может происходить изменение удельной энтропии в равновесных процессах.
Следовательно, энтропия – физическая величина, изменение которой является признаком обмена энергий в форме теплоты в равновесных процессах.
Произведем замену dq = Tds и получим
Tds = du+pd (9.1)
- основное уравнение I начала термодинамики называется также термодинамическим тождеством (охватывает I и II законы термодинамики).
TS – диаграмма
По степени использования теплоты судят о работе тепловых машин и об их экономичности. Этот вопрос легко разрешается графическим изображением термодинамического процесса в системе координат, где по оси абсцисс откладывают значение энтропии, а по оси ординат – значения температуры. В этом заключается огромное прикладное значение энтропии. Так же, как и на p – диаграмме, состояние ТРТ в каждый момент времени на TS – диаграмме изображается точкой, процесс – линией. TS – диаграмма носит название тепловой (энтропийной) диаграммы (введена Гиббсом в 1873 г.). Теплота процесса q1,2 может быть определена графически площадью под кривой процесса.
Действительно,
элементарная площадка с основанием ds
и высотой T
равна Tds
или равна элементарной теплоте dq.
Вся площадь a12b
определяет теплоту процесса q1,2
=
![]() .
.
Ясно, что q1,2 зависит от вида процесса, т.к. между заданными точками 1 и 2 можно провести самые разнообразные кривые, и теплота для каждого из таких процессов будет иметь иное значение. Достоинство TS – диаграммы состоит в том, что по направлению кривой процесса легко определить знак теплоты.
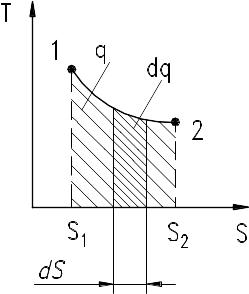
Рис. 9.1. TS – диаграмма
Из dq = Tds видно, что, т.к. T принимает только положительные значения, знаки dq и ds всегда совпадают. И если ds > 0, то теплота к ТРТ подводится (dq > 0). Если же энтропия уменьшается, то теплота отводится независимо от знака изменения температуры.
Следует на это обратить внимание: увеличение или уменьшение температуры в общем случае не позволяет судить о том, подводится или отводится теплота. Признаком подвода теплоты может служить только рост удельной энтропии, а отвода – уменьшение.

Рис. 9.2. TS – диаграмма (№2)
В
процессах подвода (или отвода) теплоты
температура ТРТ в общем случае изменяется,
поэтому удельную теплоту определяют
по формуле Tds
= du
+pd
через интеграл. В анализе идеальных
циклов весьма удобным оказывается
использовать такую среднюю температуру
![]() подвода (отвода) теплоты, которая будучи
умноженной на приращение энтропии в
процессе, позволяет найти удельное
количество теплоты q1,2
=
(s2-s1).
Величина
носит название средней термодинамической
температуры. Она равна отношению удельной
теплоты, сообщаемой ТРТ в процессе, к
приращению его удельной энтропии, т.е.
подвода (отвода) теплоты, которая будучи
умноженной на приращение энтропии в
процессе, позволяет найти удельное
количество теплоты q1,2
=
(s2-s1).
Величина
носит название средней термодинамической
температуры. Она равна отношению удельной
теплоты, сообщаемой ТРТ в процессе, к
приращению его удельной энтропии, т.е.
![]() .
.
Графически она выражается высотой прямоугольника abcd, равновеликого площади a21d.
Заметим, что термодинамические процессы можно изображать и в ps, s и т.д. координатах. Но в p – координатах площади эквивалентны работам, а в TS координатах – теплотам.

Рис. 9.3. TS – диаграмма (№3)
Цикл изображается замкнутой кривой, направленной в случае прямого цикла в сторону движения часовой стрелки, а в случае обратного – против. В прямом цикле площадь AacbB измеряет подведенное на участке abc тепло q1, а площадь AadbB – отведенное на участке bda тепло q2 .
TS – диаграмма удобна тем, что в ней наглядно изображаются и количество тепла, подводимого и отводимого в цикле, и работа, полученная в результате осуществления цикла (или затраченная, если цикл обратный), т.к. Lц=Q1-Q2.
Задача исследования термодинамического процесса состоит:
В нахождении уравнения процесса и изображении его в системе координат p и TS, а также в установлении соотношений между изменяющимися в процессе термическими параметрами;
В установлении характера преобразования энергии, т.е. количественного соотношения между величинами, содержащимися в уравнении первого начала термодинамики, и в получении формул для вычисления изменений удельных внутренней энергии, энтальпии, а также в определении количества сообщенной теплоты и работы процесса.
Следовательно, требуется рассмотрение трех функций состояния, изменение которых ( u, i, s ) не зависит от характера процесса, и двух функций процесса ( q1,2 и 1,2), т.е. величин, значения которых зависят от вида кривой процесса. Поэтому формулы для вычисления q1,2 и 1,2 различны для каждого процесса; что же касается выражений для вычислений изменений u, i и s через параметры состояния начала и конца процесса, то они являются общими для всех процессов.
