
- •Введение
- •Термодинамические параметры состояния
- •2. Основные понятия и определения
- •Идеальный газ. Законы идеального газа
- •Закон Бойля – Мариотта
- •Закон Гей – Люссака
- •Закон Шарля
- •3. Уравнение состояния идеального газа
- •Закон Авогадро
- •Молярная масса
- •4. Уравнение менделеева – клапейрона
- •Уравнение состояния реальных газов
- •5. Газовые смеси
- •6. Первое начало термодинамики Теплота и работа
- •Принцип эквивалентности
- •7. Внутренняя энергия
- •Закон сохранения и превращения энергии
- •Формулировки первого начала термодинамики
- •Виды работ
- •Развернутое уравнение первого закона термодинамики и его частные выражения
- •Энтальпия
- •8. Теплоемкость газов
- •9. Анализ термодинамических процессов на основании I начала термодинамики Понятие об энтропии
- •Схемы распределения энергии
- •Изотермический процесс
- •Адиабатный процесс
- •10. Политропные процессы
- •Группы политропных процессов
- •Способы определения n
- •Связь между n и с
- •11. Второе начало термодинамики Односторонность протекания самопроизвольных процессов
- •Формулировки второго начала термодинамики
- •Выражение первого закона термодинамики для циклов
- •Термический коэффициент полезного действия прямого цикла
- •12. Цикл карно
- •Термодинамическая шкала температур
- •Математическое выражение второго закона термодинамики
- •Критика учения о «тепловой смерти вселенной»
- •13. Термодинамика потока газа. Основные понятия и уравнения гидрогазодинамики
- •Уравнение неразрывности
- •Уравнение энергии – уравнение первого закона термодинамики
- •Уравнение состояния идеального газа
- •Уравнение импульса
- •Располагаемая работа газа в потоке
- •Скорость звука и критические параметры
- •14. Скорость и расход газа при течении. Истечение из сужающихся сопел
- •Переход через скорость звука. Сопло Лаваля
- •После подстановки значения скорости потока в последнее уравнение получим .
- •Истечение при наличии трения
- •Дросселирование газа
- •15. Термодинамика химических процессов
- •Термохимические процессы
- •Первый закон термодинамики применительно к химическим процессам
- •Закон Гесса
- •Второй закон термодинамики
- •Тепловой закон Нернста
- •16. Циклы поршневых двигателей внутреннего сгорания
- •Цикл со смешанным подводом тепла
- •Цикл с подводом тепла при постоянном объеме
- •Цикл с подводом тепла при постоянном давлении
- •Сравнение циклов поршневых двс
- •Сравнение по условию .
- •Сравнение по условию
- •17. Циклы компрессоров
- •Многоступенчатые компрессоры
- •Центробежный компрессор
- •Осевой компрессор
- •18. Циклы газотурбинных установок
- •Регенеративные циклы
- •19. Циклы паросиловых установок
- •Цикл Карно для водяного пара
- •Цикл Ренкина
- •Цикл с промежуточным перегревом пара
- •Регенеративный цикл
- •Бинарные циклы
- •Цикл парогазовой установки
- •Теплофикационный цикл
- •20. Циклы холодильных установок
- •Цикл воздушной холодильной машины
- •Цикл парокомпрессорной холодильной машины
- •Цикл теплового насоса
- •Детандеры
- •21. Реактивные двигатели
- •Цикл ПуВрд
- •Цикл трд
- •22. Ракетные двигатели
- •Цикл рдтт
- •Цикл жрд
- •Цикл ярд
- •Заключение
- •Библиографический список
- •Оглавление
- •394026 Воронеж, Московский просп., 14
8. Теплоемкость газов
Для того чтобы два различных вещества с одинаковой массой нагреть до одинаковых температур, нужно затратить различное количество теплоты. Например, на нагревание воды нужно затратить теплоты приблизительно в 9 раз больше, чем на нагревание до той же температуры такого же количества железа. Характеристикой тепловых свойств вещества является теплоемкость – свойство тел поглощать или отдавать тепло при совершении термодинамических процессов.
Удельной теплоемкостью или сокращенно теплоемкостью называется количество тепла, необходимое для изменения температуры на один градус.
Из этого определения следует, что теплоемкость вещества является экстенсивным свойством тела. В самом деле, величина теплоемкости данного тела тем больше, чем больше вещества содержит это тело: теплоемкость 10 кг воды в 5 раз больше теплоемкости 2 кг воды.
Калория и градус имеют размерность энергии. Отсюда можно прийти к выводу, что теплоемкость – величина безразмерная, т.е. величина, не зависящая от того, какая единица измерения выбрана для энергии: эрг, калория или еще что-нибудь. То, что теплоемкость измеряется в единицах калория/градус или джоуль/градус – дань привычке, не позволяющая нам отказаться от градусов.
Т.к. о количестве вещества судят по его массе, по его объему при нормальных условиях или по количеству киломолей, то в технической термодинамике различают три вида теплоемкостей – массовую, объемную, мольную.
В первом случае речь идет о количестве
тепла, необходимом для повышения
температуры 1 кг газа на 1 градус [
![]() ,
Дж/кг К], во втором – для повышения
температуры кубического метра газа на
один градус [
,
Дж/кг К], во втором – для повышения
температуры кубического метра газа на
один градус [![]() ,Дж/
,Дж/![]() К
] и в третьем случае – для повышения
температуры 1 кмоль газа на 1 градус (
К
] и в третьем случае – для повышения
температуры 1 кмоль газа на 1 градус (![]() ,
Дж/кмоль К ).
,
Дж/кмоль К ).
Между указанными теплоносителями
существуют простые соотношения. Например:
![]() , или
, или
![]() ,
где
,
где
![]() ,
,
![]() и 22,4- соответственно удельный объем,
плотность и объем одного киломоля газа
при нормальных условиях.
и 22,4- соответственно удельный объем,
плотность и объем одного киломоля газа
при нормальных условиях.
Т.к. теплоемкость идеального газа зависит от температуры, а реального – и от давления, то в технической термодинамике различают истинную и среднюю теплоемкости, последнюю обычно применяют в практических расчетах при определении количества теплоты.
Истинной теплоемкостью называется отношение количества тепла dq, сообщенное в процессе 1 кг газа, к бесконечно малому изменению температуры dT:
![]() .
(8.1)
.
(8.1)
Средней теплоемкостью
![]() называется отношение конечного количества
тепла q, подведенного r
газу, к интервалу изменения его температуры
называется отношение конечного количества
тепла q, подведенного r
газу, к интервалу изменения его температуры
![]() :
:
![]() . (8.2)
. (8.2)
Среднее значение теплоемкости в интервале
![]() и
и
![]() -
-
![]() -
тангенс угла наклона секущей, проходящей
через конечные точки рассматриваемого
отрезка процесса.
-
тангенс угла наклона секущей, проходящей
через конечные точки рассматриваемого
отрезка процесса.

Рис. 8.1. Среднее значение теплоемкости
Истинное значение теплоемкости в точке
2
![]() -тангенс угла наклона касательной к
данной точке кривой.
-тангенс угла наклона касательной к
данной точке кривой.
Уравнение
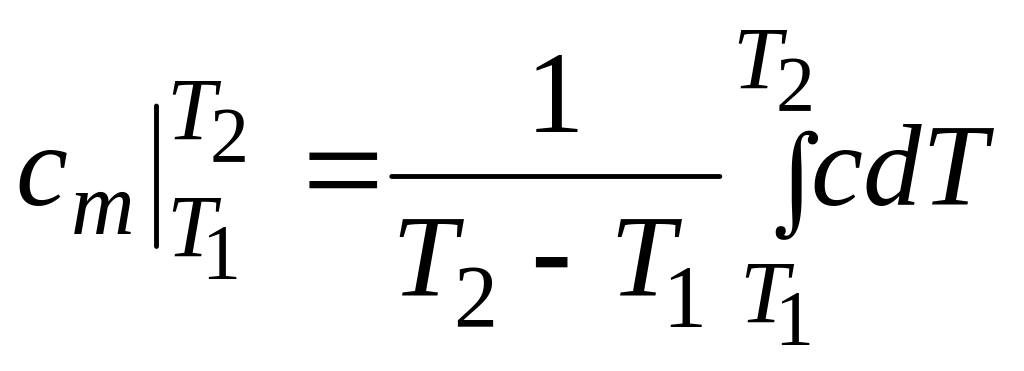 устанавливает
связь между средней и истинной
теплоемкостями тела в данном процессе.
устанавливает
связь между средней и истинной
теплоемкостями тела в данном процессе.
Если в каком-либо процессе идеальный
раз был нагрет от температуры
до
,
то количество теплоты, затраченное на
нагревание, равно
![]() .
.
Для произвольного термодинамического процесса могут быть самые различные зависимости q=f(T), поэтому по существу дела и теплоемкость не может быть какой-то универсальной постоянной характеристикой ТРТ как функция состояния. Теплоемкость есть функция термодинамического процесса. Это термодинамический параметр процесса. Теплоемкость будет зависеть от условий протекания термодинамического процесса.
Теплоемкость газов зависит от рода газов, параметров его состояния р, , Т и характера процесса.
Наиболее ощутима зависимость теплоемкости тела от температуры. Эту зависимость определяют экспериментально и обычно представляют в виде степенного полинома:
![]() ,
(8.3)
,
(8.3)
![]() .
(8.4)
.
(8.4)

Рис. 8.2. Зависимость теплоемкости от температуры
Теплоемкости всех газов, кроме одноатомных, с повышением температуры увеличиваются. В небольшом температурном интервале для двухатомных и, реже, для трехатомных газов, зависимость теплоемкости от температуры принимается линейной, т.е.
с=a+bT, (8.5)
где a – значение теплоемкости при t=![]() С;
b- постоянный коэффициент, характеризующий
скорость возрастания теплоемкости с
повышением температуры.
С;
b- постоянный коэффициент, характеризующий
скорость возрастания теплоемкости с
повышением температуры.
Вследствие того, что теплоемкость зависит от температуры, расход теплоты для одинакового повышения температуры меняется: чем выше начальная температура нагрева, тем больше теплоты надо израсходовать для одинакового повышения температуры.
Задача может быть еще упрощена, если в
качестве средней теплоемкости взять
истинную теплоемкость при среднеарифметической
температуре процесса, т.е. при температуре
![]() .
.
Для реальных газов теплоемкости в зависимости от температуры могут быть найдены в справочниках по таблицам, пользуясь методом интерполирования.
Экспериментально установлено, что величина теплоемкости реальных газов зависит и от давления, влияние которого при высоких температурах, свойственных продуктам сгорания в тепловых двигателях (1000-2000 градусов Цельсия), незначительно.
Истинные теплоемкости реальных газов
можно выразить в виде суммы двух слагаемых
![]() .
.
Первое
слагаемое представляет собой теплоемкость
данного газа в разреженном (идеально
газовом) состоянии (при
![]() или
или
![]() )
и зависит только от температуры.
)
и зависит только от температуры.
Второе слагаемое определяет зависимость теплоемкости от давления или удельного объема и связано с изменением потенциальной составляющей внутренней энергии реального газа.
Во многих случаях корректирующие члены
![]() во внимание не принимаются, теплоемкость
же газов определяют, как
во внимание не принимаются, теплоемкость
же газов определяют, как
![]() и
и
![]() ,
для которых и даются таблицы и уравнения.
,
для которых и даются таблицы и уравнения.
Формулы средних теплоемкостей в таблицах часто даются в двухчленном виде, так как коэффициенты третьих членов имеют незначительную величину.
Поделив почленно равенство
![]() на
на
![]() ,
получим выражение теплоемкости в общем
виде для любого процесса
,
получим выражение теплоемкости в общем
виде для любого процесса
![]() .
.
Если
![]() ,
то
,
то
![]() и, следовательно,
и, следовательно,
![]() ,
тогда
,
тогда ![]() - изохорная теплоемкость.
- изохорная теплоемкость.
Теплоемкость тела при постоянном объеме
![]() равняется частной производной от
внутренней энергии (рассматриваемой
как функция
и Т) по температуре Т при
.
равняется частной производной от
внутренней энергии (рассматриваемой
как функция
и Т) по температуре Т при
.
Откуда следует, что
![]() .
.
Внутренняя энергия идеального газа зависит только от температуры и не зависит от свойств процесса. Поэтому полученное уравнение является единственным для подсчета изменения внутренней энергии, в любом термодинамическом процессе.
Подставив
![]() в
,
получим уравнение первого начала для
любого процесса через теплоемкость
в
,
получим уравнение первого начала для
любого процесса через теплоемкость
![]() .
(8.6)
.
(8.6)
Дифференцируя уравнение состояния
![]() при p=сonst,
получаем:
при p=сonst,
получаем:
![]() .
(8.7)
.
(8.7)
Т.к. p=сonst,
то dp=0 и
![]() ,
тогда
,
тогда
![]() .
(8.8)
.
(8.8)
Но изобарная теплоемкость
![]() ,
откуда
,
откуда
![]() .
(8.9)
.
(8.9)
Теплоемкость при постоянном давлении
![]() равняется частной производной от
энтальпии (рассматриваемой как функция
p или T)
по температуре T при
p=const.
Понятия «теплоемкость при постоянной
температуре» и «адиабатная теплоемкость»
редко применяются, т.к. при Т=const:
равняется частной производной от
энтальпии (рассматриваемой как функция
p или T)
по температуре T при
p=const.
Понятия «теплоемкость при постоянной
температуре» и «адиабатная теплоемкость»
редко применяются, т.к. при Т=const:
![]() ,
а при dq=0
,
а при dq=0
![]() .
.
После подстановки получим:
![]() .
(8.10)
.
(8.10)
Разделив на dT получим
![]() (8.11)
(8.11)
-уравнение Р. Майера (1842 г.).
Это выражение действительно и для средних теплоемкостей. Газовая постоянная R численно равна разности изобарной и изохорной теплоемкостей вещества и имеет размерность теплоемкости [это работа 1 кг газа в изобарном процессе, измеряемая в Дж, при изменении температуры на 1 градус Цельсия].
При нагревании одного и того же газа до одинаковой температуры в одинаковых условиях при изобарном процессе нужно затратить больше тепла, чем при изохорном.
Физический смысл этой зависимости легко
уяснить. Если для нагревания одного
моля (или 1 кг.) газа в цилиндре над поршнем
на 1 градус при постоянном объеме, т.е.
при закрепленном неподвижно поршне,
надо затратить количество теплоты
![]() ,
то при постоянном давлении к этому
количеству теплоты добавится работа
R, которую будет совершать
расширяющийся газ, толкая освобожденный
поршень.
,
то при постоянном давлении к этому
количеству теплоты добавится работа
R, которую будет совершать
расширяющийся газ, толкая освобожденный
поршень.
Следует отметить, что для реальных газов
![]() .
.
Это неравенство объясняется тем, что при расширении реальных газов (при p=const) совершается не только внешняя работа, но и внутренняя, связанная с изменением внутренней потенциальной энергии тела, что и вызывает большой расход теплоты.
Уравнение Майера можно переписать в следующем виде:
![]() ,
(8.12)
,
(8.12)
![]() [Дж/кмольК].
(8.13)
[Дж/кмольК].
(8.13)
В термодинамике часто используется
отношение изобарной теплоемкости к
изохорной
![]() -
показатель адиабаты (коэффициент
Пуассона).
-
показатель адиабаты (коэффициент
Пуассона).
Согласно классической кинетической теории газов, величина определяется числом степеней свободы молекулы i
![]() ;
;
![]() ;
; ![]() .
.
Измерив ,найдем i, по которому можно судить о том, сколько атомов содержит молекула.
Из уравнения Майера вытекает, что
![]() .
.
Здесь переменная величина лишь
![]() ,
которая увеличивается с ростом температуры
и, следовательно, коэффициент
уменьшается, но остается при всех
условиях величиной, большей единицы.
Это свидетельствует о том, что с
увеличением температуры теплоемкость
возрастает более интенсивно, чем
теплоемкость
,
которая увеличивается с ростом температуры
и, следовательно, коэффициент
уменьшается, но остается при всех
условиях величиной, большей единицы.
Это свидетельствует о том, что с
увеличением температуры теплоемкость
возрастает более интенсивно, чем
теплоемкость
![]() .
Обычно зависимость
от температуры выражается эмпирической
формулой вида:
.
Обычно зависимость
от температуры выражается эмпирической
формулой вида:
![]() ,
(8.14)
,
(8.14)
где
![]() -значение
коэффициента
при нуле градусов Цельсия , а
-значение
коэффициента
при нуле градусов Цельсия , а
![]() -некоторый
коэффициент, принимающий для каждого
газа определенное значение. Из этого
уже уравнения получим выражения:
-некоторый
коэффициент, принимающий для каждого
газа определенное значение. Из этого
уже уравнения получим выражения:
![]() ,
(8.15)
,
(8.15)
![]() .
(8.16)
.
(8.16)
Численные значения мольных теплоемкостей
легко запоминаются, если выразить их в
ккал/кмольК. В этом случае,
![]() .
.
Так как для молекулы состоящей из двух
или более атомов, число степеней свободы
составляет![]() ,
где
,
где
![]() -
число степеней свободы вращательного
движения молекул, то
-
число степеней свободы вращательного
движения молекул, то
![]() [ккал/кмольК],
[ккал/кмольК],
![]() [ккал/кмольК],
где для одноатомного газа
[ккал/кмольК],
где для одноатомного газа
![]() ;
для двухатомного
;
для двухатомного
![]() ;
для трех- и многоатомных газов
;
для трех- и многоатомных газов
![]() .
Причем для последних в приближенных
расчетах необходимо хотя бы грубо
учитывать энергию внутримолекулярных
колебаний атомов и принимать тогда
.
Причем для последних в приближенных
расчетах необходимо хотя бы грубо
учитывать энергию внутримолекулярных
колебаний атомов и принимать тогда
![]() .
.
Для того чтобы выразить теплоемкость в единицах системы СИ, полученные значения следует умножить на переводной коэффициент 4,187 кДж/ккал.
При высоких температурах и давлениях:
для одноатомных газов = 1.67 (5/3),
для двухатомных газов =1,40 (7/5),
для углекислого газа =1,29 (9/7),
для сернистого газа = 1,28 (9/7).
Вообще, для трех – и многоатомных газов
![]() 1.3.
1.3.
Казалось бы, проще всего определить
теплоемкость газа, заполнив испытуемым
газом сосуд и погрузив этот сосуд в
калориметр. Однако, мы не учитываем при
таком измерении исключительной малости
теплоемкости газа по сравнению с
теплоемкостью сосуда, из какого бы
твердого материала он ни был сделан.
Поэтому измерения теплоемкости газа
при постоянном объеме не производятся.
Для этой цели через калориметр пропускается
змеевик, в котором под постоянным
давлением движется газ. Измеряется
температура газа при входе в калориметр
и при выходе. Газ, входящий в калориметр
после предварительного нагревания,
передает часть своего тепла воде. Зная
количество газа, протекающего через
сосуд за какое-то определенное время,
и количество тепла, полученное водой
калориметра за тот же самый срок, мы без
труда найдем теплоемкость газа при
постоянном давлении
![]() ,
деля это количество тепла на протекшую
массу газа и на разность температур
газа при входе и выходе. Для определения
,
деля это количество тепла на протекшую
массу газа и на разность температур
газа при входе и выходе. Для определения
![]() пользуются коэффициентом Пуассона и
уравнением Майера.
пользуются коэффициентом Пуассона и
уравнением Майера.
Для определения предлагалось много способов, часть из них основана на измерении объемов и явлений газа в последовательных состояниях при адиабатном процессе.
Теплоемкости различных газов приведены в таблице 8.1.
У газов с понижением температуры теплоемкость падает, т.к. сначала прекращается вращательное движение молекул, затем колебательное, а при дальнейшем понижении температуры прекращается и поступательное движение.
Таблица 8.1
Теплоемкости газов
Газ |
|
|
|
Гелий, He |
12.5 |
20.9 |
1.67 |
Водород, H2 |
20.4 |
28.8 |
1.41 |
Азот, N2 |
20.39 |
28.6 |
1.41 |
Кислород, O2 |
20.9 |
28.9 |
1.40 |
Воздух |
20.8 |
29.1 |
1.40 |
Пары воды,H2O |
27.8 |
36.2 |
1.31 |
Метан, CH4 |
27.3 |
35.6 |
1.30 |
Этиловый спирт, C2H6O |
79.4 |
87.7 |
1.11 |
В 1906 – 1912 г.г. Нернст высказал предположение, что при приближении к абсолютному нулю, газ приобретает свойства, во многом сходные со свойствами твердых тел.

Рис. 8.3. Характер изменения теплоемкости от температуры
Проводя
опыты над рядом твердых тел вблизи
абсолютного нуля Нернст показал, что
теплоемкости твердых тел стремятся к
нулю при
![]() и при температуре Т=0,
теплоемкости
и
и при температуре Т=0,
теплоемкости
и
![]() для всех твердых тел. Иными словами, при
Т=о
частицы вещества- молекулы превращаются
в жесткую систему, лишенную тепловых
движений. Последнее означает
превращение теплоемкости вещества в
нуль. Следовательно, при
теплоемкость газов тоже стремится к
нулю и при Т=0
с=0 . Из этого
следует, что эмпирическая зависимость
с=a+bT
совершенно недействительна в области
низких абсолютных температур. На рисунке
8.3 показан истинный характер изменения
теплоемкости от температуры.
для всех твердых тел. Иными словами, при
Т=о
частицы вещества- молекулы превращаются
в жесткую систему, лишенную тепловых
движений. Последнее означает
превращение теплоемкости вещества в
нуль. Следовательно, при
теплоемкость газов тоже стремится к
нулю и при Т=0
с=0 . Из этого
следует, что эмпирическая зависимость
с=a+bT
совершенно недействительна в области
низких абсолютных температур. На рисунке
8.3 показан истинный характер изменения
теплоемкости от температуры.
Значения теплоемкостей колеблются в довольно широких пределах. Разумеется, теплоемкость воды в калориях на градус по определению равна 1.
Большинство тел имеет теплоемкость меньше, чем у воды. Так у большинства масел, спиртов и других жидкостей близки к 0.5 кал/гК. Кварц, стекло, песок приблизительно 0,2. Железо и медь приблизительно 0,1. Водород 3.4; воздух 0.24 кал/гК.
Теплоемкость меди при Т= 20 К равна всего 0,0035; это в 24 раза меньше, чем при комнатной температуре.
Различие между теплоемкостями воды и почвы является одной из причин, определяющих разницу между морским и континентальным климатом. Обладая примерно в 5 раз большей теплоемкостью, чем почва, вода медленно нагревается и также медленно остывает. Летом вода в приморских районах, нагреваясь медленнее, чем суша, охлаждает воздух, а зимой море постепенно остывает, отдавая тепло воздуху и смягчая мороз. Нетрудно подсчитать, что 1 кубический метр морской воды, охлаждаясь на 1 градус Цельсия, нагреет на 1 градус Цельсия 3000 кубометров воздуха. Поэтому в приморских районах колебания в температуре и разница между температурой зимы и лета менее значительны, чем в континентальных.
В теплотехнических расчетах приходится определять теплоемкость газовой смеси.
Т.к. теплота, затрачиваемая на нагревание 1 кг газовой смеси, расходуется нагревание отдельных компонентов, находящихся в смеси, то теплоемкость смеси равна сумме произведений теплоемкостей компонентов, составляющих смесь, на их массовые или объемные доли.
При задании смеси массовыми долями
массовая теплоемкость смеси определяется
по формуле
![]() ,
Дж/кгК, где
,
Дж/кгК, где
![]() -
произведения массовой доли на массовую
теплоемкость каждого из состава смеси
в данном процессе.
-
произведения массовой доли на массовую
теплоемкость каждого из состава смеси
в данном процессе.
Объемная теплоемкость смеси, заданной
в массовых долях, определяется по
формуле
![]() ,
,
![]() .
.
Если смесь задана в объемных долях, то
ее объемная теплоемкость
![]() ,
,
где
,
,
где
![]() -
произведение объемной доли на объемную
теплоемкость каждого газа из состава
смеси в данном процессе.
-
произведение объемной доли на объемную
теплоемкость каждого газа из состава
смеси в данном процессе.
Массовая теплоемкость смеси, заданной
в объемных долях, определяется выражением
![]() ,
Дж/кгК.
,
Дж/кгК.
Мольная теплоемкость смеси газов равна
произведению объемных долей на мольные
теплоемкости составляющих смесь газов
![]() .
.
