
- •Введение
- •Термодинамические параметры состояния
- •2. Основные понятия и определения
- •Идеальный газ. Законы идеального газа
- •Закон Бойля – Мариотта
- •Закон Гей – Люссака
- •Закон Шарля
- •3. Уравнение состояния идеального газа
- •Закон Авогадро
- •Молярная масса
- •4. Уравнение менделеева – клапейрона
- •Уравнение состояния реальных газов
- •5. Газовые смеси
- •6. Первое начало термодинамики Теплота и работа
- •Принцип эквивалентности
- •7. Внутренняя энергия
- •Закон сохранения и превращения энергии
- •Формулировки первого начала термодинамики
- •Виды работ
- •Развернутое уравнение первого закона термодинамики и его частные выражения
- •Энтальпия
- •8. Теплоемкость газов
- •9. Анализ термодинамических процессов на основании I начала термодинамики Понятие об энтропии
- •Схемы распределения энергии
- •Изотермический процесс
- •Адиабатный процесс
- •10. Политропные процессы
- •Группы политропных процессов
- •Способы определения n
- •Связь между n и с
- •11. Второе начало термодинамики Односторонность протекания самопроизвольных процессов
- •Формулировки второго начала термодинамики
- •Выражение первого закона термодинамики для циклов
- •Термический коэффициент полезного действия прямого цикла
- •12. Цикл карно
- •Термодинамическая шкала температур
- •Математическое выражение второго закона термодинамики
- •Критика учения о «тепловой смерти вселенной»
- •13. Термодинамика потока газа. Основные понятия и уравнения гидрогазодинамики
- •Уравнение неразрывности
- •Уравнение энергии – уравнение первого закона термодинамики
- •Уравнение состояния идеального газа
- •Уравнение импульса
- •Располагаемая работа газа в потоке
- •Скорость звука и критические параметры
- •14. Скорость и расход газа при течении. Истечение из сужающихся сопел
- •Переход через скорость звука. Сопло Лаваля
- •После подстановки значения скорости потока в последнее уравнение получим .
- •Истечение при наличии трения
- •Дросселирование газа
- •15. Термодинамика химических процессов
- •Термохимические процессы
- •Первый закон термодинамики применительно к химическим процессам
- •Закон Гесса
- •Второй закон термодинамики
- •Тепловой закон Нернста
- •16. Циклы поршневых двигателей внутреннего сгорания
- •Цикл со смешанным подводом тепла
- •Цикл с подводом тепла при постоянном объеме
- •Цикл с подводом тепла при постоянном давлении
- •Сравнение циклов поршневых двс
- •Сравнение по условию .
- •Сравнение по условию
- •17. Циклы компрессоров
- •Многоступенчатые компрессоры
- •Центробежный компрессор
- •Осевой компрессор
- •18. Циклы газотурбинных установок
- •Регенеративные циклы
- •19. Циклы паросиловых установок
- •Цикл Карно для водяного пара
- •Цикл Ренкина
- •Цикл с промежуточным перегревом пара
- •Регенеративный цикл
- •Бинарные циклы
- •Цикл парогазовой установки
- •Теплофикационный цикл
- •20. Циклы холодильных установок
- •Цикл воздушной холодильной машины
- •Цикл парокомпрессорной холодильной машины
- •Цикл теплового насоса
- •Детандеры
- •21. Реактивные двигатели
- •Цикл ПуВрд
- •Цикл трд
- •22. Ракетные двигатели
- •Цикл рдтт
- •Цикл жрд
- •Цикл ярд
- •Заключение
- •Библиографический список
- •Оглавление
- •394026 Воронеж, Московский просп., 14
Способы определения n
Сняв индикаторную диаграмму цикла тепловой машины возможно определить показатели политроп отдельных участков двумя способами:
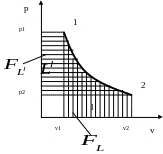
Рис. 10.15. Определение n
1) Аналитически по формуле (из![]() )
)
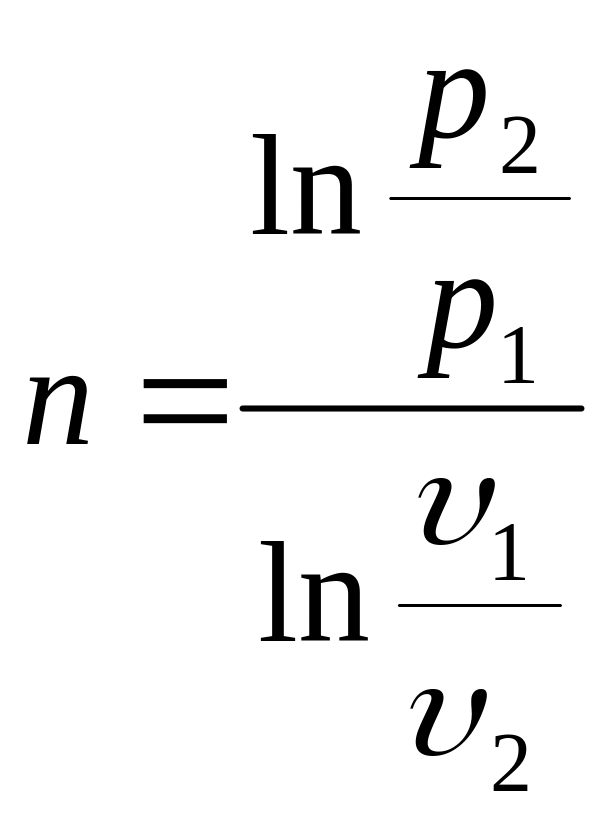 .
.
2) По отношению площадей
![]() и
и
![]() ,
эквивалентных работам
,
эквивалентных работам
![]() и
и
![]() ,
т.к.
,
т.к.
![]() .
.
Предварительно необходимо убедиться,
что рассматриваемый процесс является
политропным, для чего линию процесса
из
координат необходимо перестроить в
систему координат ln
p, ln
(или lg
,
lg
). В этой системе политропа представляется
в виде прямой линии, что следует из
уравнения:
![]() ,
,![]() или a+nb=c,
где a=ln
p, b=ln
,
c=const.
или a+nb=c,
где a=ln
p, b=ln
,
c=const.
Показатель политропы n представляет собой тангенс угла наклона этой линии в логарифмической PV- диаграмме. Если кривая процесса не спрямляется полностью, а имеет некоторую кривизну, то тогда эту линию в диаграмме ln p-ln следует разбить на несколько прямолинейных участков, найти значение n для каждого из этих участков и затем вычислить среднее для всей линии значение n. Определив для данного реального процесса величину n, мы сможем воспользоваться полученными выше уравнениями для расчета работы расширения процесса, теплоты процесса, рассчитать температуру в любой точке процесса и т.д.
Связь между n и с
Политропа
является константой. Теплоемкость
политропного процесса с ,
выраженная через показатель политропы
n имеет вид
![]() .
.
Интересно отметить, что при 1<n<k теплоемкость c отрицательна. В этих процессах при расширении газ производит работу, значительно превышающую то количество тепла, которое подводится к газу в процессе расширения. В этом случае на производство работы, помимо тепла, подведенного к газу, расходуется и некоторое количество его внутренней энергии. Хотя к газу и подводится тепло, но оно целиком превращается в работу, а убыль внутренней энергий газа ведет к снижению его температуры.
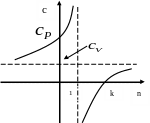
Рис. 10.16. Графическая зависимость c от n
Таким образам, в данном случае, мы имеем дело с весьма своеобразным процессом: тепло к системе подводится, но температура уменьшается. В соответствии с общим определением c=dq/dT мы приходим к выводу, что теплоемкость такого политропного процесса отрицательна.
TS – iS – диаграммы для газов
На практике широко используются масштабные диаграммы TS, на которых заранее нанесены сетки изобар, изохор и изотерм, построенные с учетом зависимости теплоемкости от температуры.

Рис. 10.17. Масштабные диаграммы TS
Применение этой диаграммы значительно облегчает термодинамические расчеты, т.к. позволяет заменить довольно громоздкие вычисления параметров графическими построениями и расчет теплоты в процессах измерением площадей под процессами на диаграммах.
Кроме того, анализ термодинамических процессов и циклов ТS- координатах нагляден, что способствует лучшему пониманию сущности исследуемых процессов и уменьшает вероятность ошибок. Аналогичны TS- диаграммам по структуре энтропийные iS-диаграммы, предложенные Р. Молье, на которых также нанесены сетки изохор, изобар и изотерм.
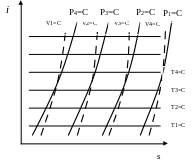
Рис. 10.18. Диаграммы iS
iS – диаграммы удобны для многих расчетов (процессы в турбинах, компрессорах, процессы истечения и др.), где работа и теплота могут бить выражены через изменение энтальпии. Тогда отпадает необходимость измерять площади, а достаточно сделать отсчеты по шкале ординат, где отложены i. Зная параметры состояния газа (жидкости) в точке 1, и хотя бы один параметр в точке 2, (например давление p2), нетрудно найти значение i2, если рассматривается обратимый адиабатный поток, то очевидно, что точки 1 и 2 лежат на изоэнтропе s=const , которая в iS диаграмме изображается вертикальной прямой. Пересечение изоэнтропы с изобарой p2=const дает точку 2. Однако iS диаграммы менее универсальны по сравнению с TS- диаграммами.
