
Ocherki_klinicheskoy_biokhimii
.pdf
41
(источник иллюстрации – Основы биологической химии, Тимин, 2008 г.)
Только в такой форме аминокислоты способны пройти «face – контроль» на входе в рибосомы. Для этого процесса, кстати, нужны ионы магния. Без него машина под названием аминоацил – РНК – синтетаза не работает. Ох чёрт, мы же ещё их не собрали!
Инициация. мРНК, образованная в ядре в процессе транскрипции и процессинга,
наконец то попадает на место сходки. И сразу взаимодействует с меньшей субъединицей рибосомы и с инициаторной активированной аминоацилтРНК.
После присоединения большой субъединицы рибосомы образуется инициаторный комплекс. Важно сказать, что инициаторной кислотой будет являться N-
формилметиониламиноацил – тРНК.
Но и это ещё не всё. Для инициации трансляции нужна энергия в виде ГТФ и присутствие факторов инициации трансляции.
(иллюстрация взята с Википедии, статья «Трансляция(биология)»
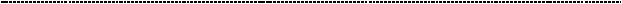
42
Элонгация. Факторы элонгации, коих в клетке достаточно, осуществляют точное присоединение вновь прибывающих аминоацил – тРНК в предыдущей молекуле.
Здесь, кстати, тоже соблюдается принцип комплементарности (complement =
дополнение), между мРНК и тТРНК. Примечательно, что элонгация полипептида – это тот процесс, который требует для осуществления энергии, но источником которой служит не АТФ…а ГТФ. Сложно сказать, с чем связаны данные гастрономические особенности клетки в этом отношении.
Терминация и высвобождение осуществляется тогда, когда тРНК натыкаютсяна стоп – кодон. Врезультате этой встречи, рибосома понимает, что никто не вечен, и
распадаетсянасубъединицы. Адовольныйполипептид проходитследующиекруги капиталистического синтеза и попадает в ЭПР и комплекс Гольджи, где происходит следующее:
2.3.4.Укладка полипептидов. Посттрансляционный процессинг полипептидов
Для того, чтобы стать полноценными, в функциональном отношении, белками,
полипептиды должны принять третичную (нативную) структуру. Этот этап занимает важное место в жизни белка и в целом несёт название фолдинга (от англ.
– folding – укладка). К белкам, помогающим другому белку стать «большим»,
относятся белки – шапероны, или белки теплового шока.
Сворачивание белка проходит через кинетически – предпочтительные стадии,
определяемые особенностями первичной структуры (у разных полипепитдов они разные). Это значит, что процессбудетпротекатьтем быстрее, чем меньше энергии необходимо на его формирование. Линейка из аминокислот не может просто так взять и превратиться в третичную структуру, это требует затраты энергии и определённые пространственные и химические превращения. Белковой молекуле надо помочь, и делают это белки - шапероны.
43
(источник иллюстрации – интернет – портал https://studref.com/609138/matematika_himiya_fizik/folding)
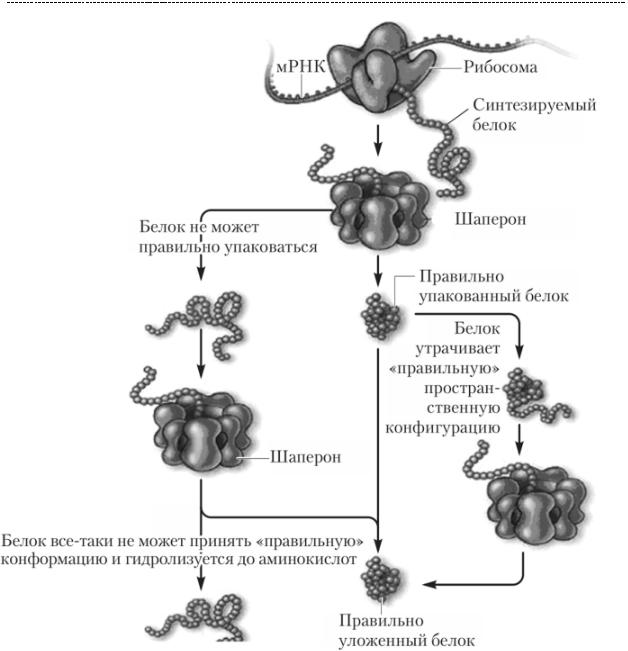
Шапероны предотвращают агрегацию белковых молекул путём защиты от других пептидов и связыванием гидрофобных групп. Используя энергию АТФ, шапероны помогают пептиду преодолеть энергетический барьер на пути к формированию нативной белковой молекулы.
Для тех, у кого не получилось стать нормальным белком, клетка предусмотрела механизм убиквининпротеасомной деградации.
44
(источник иллюстрации: «Регуляция активности протеасом в клетке с помощью специфического выключения гена, кодирующего одну из субъединиц протеасомы метода РНК-интерференции». Монахов М.В, Институт Молекулярной биологии им. В.А. Энгельгардта РАН, 2004 г.)
К «неудачному» в структурно – функциональном отношении пептиду присоединяется убиквин, под действием убиквин – активирующего фермента. С
этогомоментанеудачныйпептидявляетсяпрокажённым,субиквининовойметкой.
Эта метка нужна для протеасом, которые захватывают пептиды и подвергают их гидролизу. Если так не делать, то клетка заполниться хламом в виде неудачно свёрнутого белка (как твоя комната в общаге на второй неделе учёбы), в которой невозможно будет осуществлять нормальную жизнедеятельность (ну тыпонял).
Но бывают и более удачные варианты развития событий. Большая часть белка подвергается другому варианту посттрансляционного процессинга в ЭПР и комплексе Гольджи. Здесь возможны самые разные вариантыхимического извращения, присоединения глюкозы и её производных с образованием гликопротеидов различной природы.
На этих органеллах возможна сборка и липопротеидов, которые будут играть важную роль в обмене липидов (холестерола в частности, см. часть III).
45
2.4.Клинические аспекты биосинтеза макромолекул.
2.4.1Антибактериальные и синтетические противомикробные препараты, угнетающие синтез белка в бактериальных клетках
Биосинтез белка и репликация ДНК, как ты мог догадаться, протекает и в бактериальныхклетках, причём достаточно интенсивно. Отдельные представители размножения со скоростью 3 деления в час, и это нереально быстро. Размножение бактерий сопряжено с развитием повреждений тканей в месте данного безобразия,
что вызывает воспалительную реакцию и становится патологоанатомической основой большинства инфекционных заболеваний бактериальной этиологии.
Данные заболевания требуют назначения антибактериальных препаратов (без вариантов). К счастью, пока ещё существуют и действуют антибактериальные препараты. Большинство из них воздействуют на метаболизм белка или нуклеиновых кислот в бак. клетках.
Ингибиторы топоизомеразы II типа (ДНК – гиразы IV). Роль данных ферментов ты уже знаешь, но я напомню: ДНК – топоизомеразы 2 типа разрывает обе цепи молекулы ДНК и пропускают в образующуюся брешь другой участок молекулы ДНК, что предотвращает такой вариант спирализации (скручивания)
молекулы ДНК. В данном состоянии её невозможно считать, а значит, невозможна репликация и транскрипция (см. предыдущие параграфы). Есть данные, что отсутствие ДНК – гиразы приводит к пространственному разобщению цепей ДНК в ходе их спирализации. Как уже было сказано, ДНК – гираза играет важную роль при репликации ДНК, стабилизируя цепи ДНК при их разъединении.
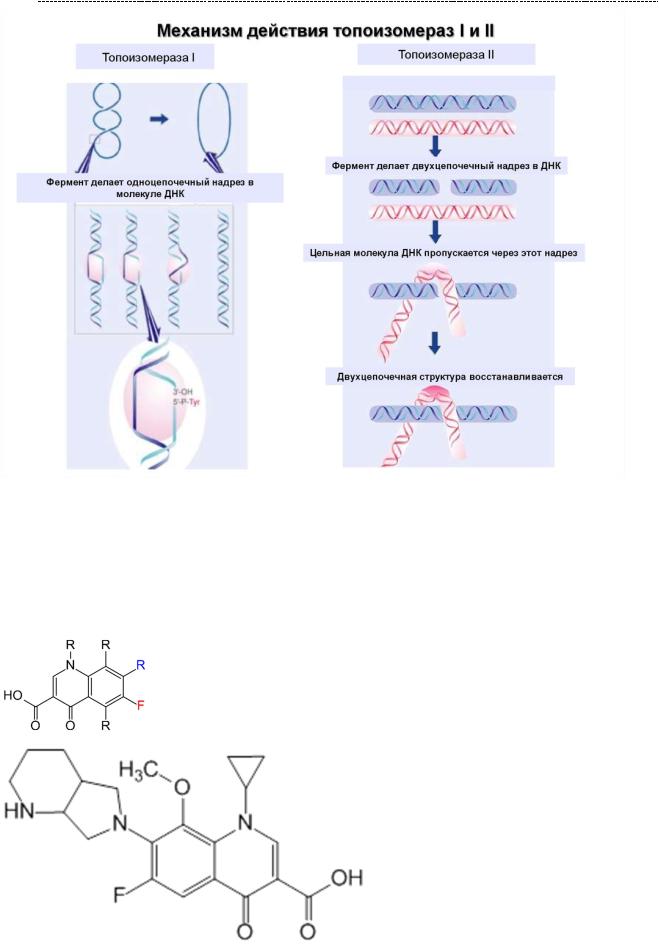
46
(источник иллюстрации: https://en.ppt-online.org/377884)
Для бактериальных клеток фермент имеет колоссальное значение, и в отсутствии его репликация невозможно. Именно поэтому человечество создало препараты,
способные угнетать данные ферменты, и это хинолоны/фторхинолоны.
моксифлоксацин
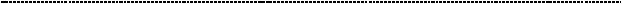
47
Представителей данных противомикробных синтетических много,
наиболее «ходовые» – ципрофлоксацин, левофлоксацин, норфлоксацин,
моксифлоксацин. Общим для них является достаточно широкий спектр действия,
за исключением анаэробных бактерий, листерий, спирохет (это сифилис и туберкулёз), хотя офлоксацин и ципрофлоксацин проявляют определённую активность в отношении возбудителя туберкулёза. Препараты обладают серьёзными преимуществами: они хорошо проникают в ткани, даже если попадают через таблетки, к ним долго развивается устойчивость бактерий, у них адекватный профиль токсичности. Но только у детей их применять нельзя (либо по жизненным показаниям, off – label через консилиум), т.к. есть данные о негативном влиянии на хрящевые зоны роста. У пожилых иногда рвётся Ахиллово сухожилие на фоне их применения. В силу сложившейся в мире опасной ситуации в виде широкого распространения антибиотикорезистентности среди микроорганизмов, фторхинолоны сейчас являются препаратами «резерва», и
используются преимущественно тогда, когда другие антибактериальные препараты неэффективны. Это обусловлено тем соображением, что широкое и чрезмерное применение отдельных групп антибактериальных препаратов приводит к риску возникновения антибиотикорезистентности микроорганизмов к данной группе препаратов на определённой географической территории.
Примечательно и то, что фторхинолоны не ингибируют топоизомеразы эукариотических клеток в терапевтических дозах. Это делает их сравнительно безопасными, хотя это и не означает, что они лишены побочных явлений.
2.4.1. Ингибиторы биосинтеза белка бактерий. У бактерий рибосом отличаются меньшим коэффицентом седиментации (70 s vs 80 s у эукариотических клеток).
Существует ряд препаратов, селективно угнетающих биосинтез белка на бактериальныхрибосомах. Некоторые из нихимеют на сегодняшний день широкое применение..
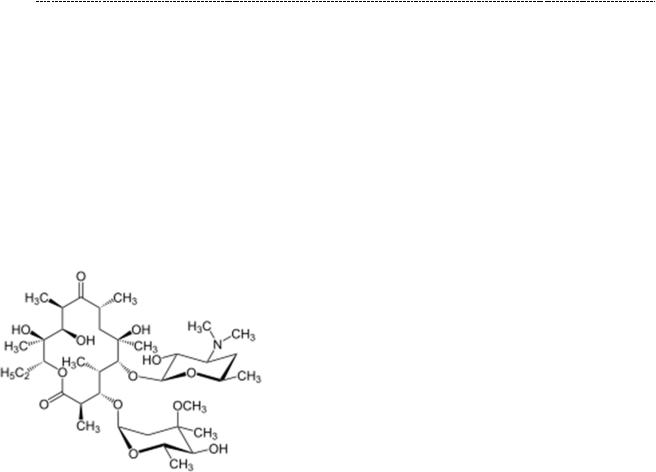
48
Макролиды – неравнодушны к пептидил – трансферазному центру 50 s -
субъединицы рибосом бактерий. Связываясь с ним, нарушаются процессы транслокации аминокислот (нарушается фаза элонгации), и белок не собирается.
Несмотря на то, что биосинтез белка протекает во всех бактериальных клетках,
макролиды не обладают достаточно широким спектром противомикробной активности. Он ограничивается преимущественно грамм – положительной микрофлорой. Но особенно актуальны макролиды против атипичных микробов
(микоплазмы, хламидии, в том числе уретральные), а это немало.
Азитромицин
Представители: азитромицин, кларитромицин, рокситромицин, телитромицин,
старый как мир эритромицин, офламицин, и прочие. Препараты достаточно безопасные, что обусловило их широкое использование.
К особенностям макролидов относят их высокую способность проникать в очаг воспаления. Происходит это путём проникновения макролидов в макрофаги, которые добираются до очага воспаления (под действием соответствующих хемоаттрактантов) к концу первых суток от повреждения ткани. Так достигается высокое содержание макролидов непосредственно вочаге воспаления. К другой особенностью относят способность макролидов проникать в клетки атипичных (не имеющих клеточной стенки бактерий), микоплазм,
хламидий. Особо важное значение это имеет для педиатрии: макролиды – практически единственные антибиотики, которыми можно победить респираторный микоплазмоз у детей младшего возраста. Другие, эффективные по отношению к микоплазме препараты, у детей используются лишь по жизненным показаниям в силу их профиля токсичности.
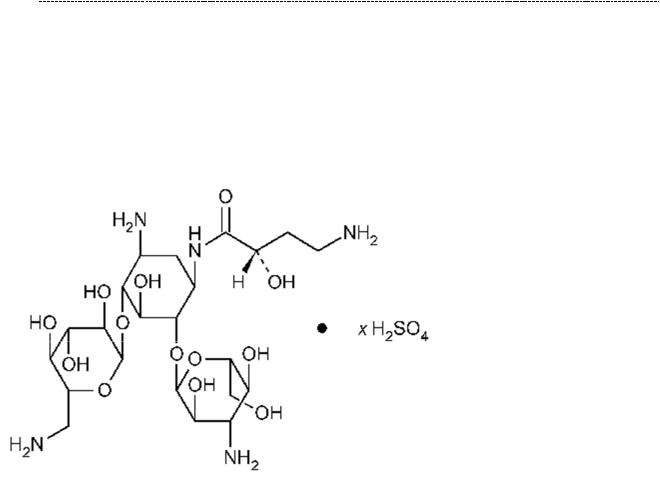
49
Аминогликозиды. Угнетают 30s – субъединицей рибосом, что затрудняет движение рибосомы по нити м РНК. В целом, они нарушают считывания кода мРНК. Вдобавок, повреждаютбактериальнуюмембрануклеток, ноэто ужедругая история.
Амикацин
От широкого применения аминогликозидов останавливает ихнефротоксичность,
ото – и вестибулотоксичность, но механизм поражения слухового и вестибулярного аппарата до настоящего времени понятен слабо. Есть данные,
что аминогликозиды активно накапливаются в пери – и эндолимфе внутреннего уха, достигают токсической концентрации в ней, угнетают биосинтез белка и нарушают целостность мембран в клетках внутреннего уха. В отношении почек известно, что токсическое действие обусловлено путём экскреции аминогликозидов – канальцевой секреции и токсическим повреждением эпителия канальцев почек.
Аминогликозиды – препараты с узким терапевтическим диапазоном, поэтому применяются по строгим показаниям, когда речь идёт о роли грам – отрицательной флоры в развитии конкретного инфекционного заболевания у конкретного пациента.
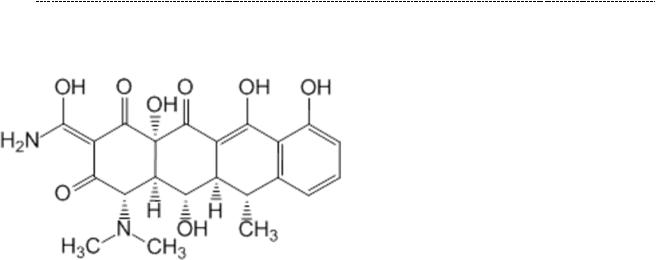
50
Тетрациклины. Похожий эффект у тетрациклинов. Среди них сейчас используется в основном только доксициклин.
Данные препараты обладают высокой биодоступностью (в силу высокой липофильности) и исходно широким спектром заболеваний. Но получилось так,
что многие бактерии приобрели к нему устойчивость в результате неконтролируемого применения. Их применения у детей ограничено в силу токсического действия тетрациклинов на хрящевые зоны роста, что делает разрешённым их применение лишь после 8 лет.
Тетрациклины нашли широкое применение в лечении некоторых, но весьма опасных, зоонозных инфекций – туляремии, бруцеллёза.
2.5.Клеточный цикл и роль структурных нарушений ДНК в онкогенезе.
Рост и пролиферация клетки в обычных условиях находится под жёстким контролем более высокихрегуляторныхсистем. Другими словами, пока клетке «не скажут – делись, мать -» – та не делится. Вся жизнь клетки подчинена клеточному циклу которая включает вышеуказанные фазы (см. рисунок).
Рассмотренная нами, в предыдущих параграфах, репликация ДНК является содержимым S – синтетической фазы, тогда как биосинтез белка – прерогатива всех остальных фаз. Движущей силой клеточного цикла является последовательная активация сменяющих друг друга циклин – зависимых протеинкиназ, набор которыхв зависимости от фазы цикла различается, во многом в результате действия на клетку различных биохимических сигналов (факторов роста, цитокинов, гормонов и проч.):
