
Ocherki_klinicheskoy_biokhimii
.pdf
221
К желтухам, опасными сами по себе, относятся надпечёночные желтухи, что связано с повышением концентрации непрямого билирубина. Непрямой билирубин является липофильным соединением, хорошо проникающим через клеточные мембраны и приводящим к повреждению клеток.
По одним данным, непрямой билирубин (НБ) вызывает дестабилизацию клеточных мембран, по другим – реализацию свободорадикальных реакций за счёт наличия двойных связей в своей структуре. Как бы там ни было, повышение НБ чревато развитием энцефалопатии (ядерной желтухи), и чаще всего это характернодляноворождённых.Одним изнаиболеечастых причиннадпечёночной желтухи у детей является гемолитическая болезнь новорождённых,
обусловленная резус или АВ0 – конфликтом, реализующимся в результате сенсибилизации иммунной системы матери к эритроцитарным антигенам формирующегося плода. Но почему именно новорождённых, спросит какой – нибудь лечебник?
Дело в том, что у новорожденного, особенно недоношенного, есть ряд факторов,
усугубляющим гипербилирубинемию. В первую очередь, это высокая проницаемость гематоэнцефалического барьера. На эту особенность может накладываться перинатальная патология в виде кровоизлияния в мозг,
нейроинфекций, асфиксии, дегидратации, т.е. всех тех факторов, что в той или иной мере повышают проницаемость ГЭБ.
Другими причинами надпечёночной желтухи могут быть иные варианты гемолитических (и не только) анемий, как врождённых (наследственный сфероцитоз, дефецит глюкозо – 6 – фосфат – дегидрогеназы, серповидно -
клеточная анемия, так и приобретённых (чаще всего – изоиммунных).
Примечательно, что гемолитическии анемии характеризуется своим биохимическим профилем.
222
Помимо НБ, при гемолитической анемии следует ожидать рост фермента ЛДГ,
в большом количестве содержащегося в эритроцитах, т.к. для них характерен анаэробный гликолиз; гиперкалиемия, т.к. калий в большом количестве содержиться внутри клеток и эритроциты – не исключение; гиперурикемия.
Особенно такая картина характерна для внутрисосудистого гемолиза, за одним исключением: НБ при внутрисосудистом гемолизе может и не повышаться, т.к.
гемоглобин эритроцитов захватывается гаптоглобином. Однако, в силу того,
что его количества ограничены, часть гемоглобина может фильтроваться в первичную мочу и обусловливать гемоглобинурию.
В остальном же, значение желтух чаще всего диагностическое, нежели патогенетическое. Желтуха является характерным, но не специфичным проявлением различных вариантов патологии печени. Однако, следует помнить,
что истинная желтуха обязательно начинается с прокрашивания склеры глаз и слизистых оболочек ротовой полости.
223
Глава 14. Белки плазмы крови.
Печень является фантастической по масштабам биохимической станцией. Здесь утилизируется просто нереальное количество продуктов, а
сложность взаимодействия веществ на уровне окисления в печени заставляет чувствовать у себя наличие лишней хромосомы. Сейчас я постараюсь усугубить у тебя это ощущение.
14.1.Альбумины. Альбумины – низкомолекулярные белки плазмы, составляют основной пул белков плазмы. Выполняют транспортную функцию, и переносят всё, что плохо лежит – билирубин, лекарства, нутриенты, токсины, словом всё, что влезет. Но есть ещё одна важная функция: это поддержание онкотического давления плазмы (иначе говоря, удерживание воды). Связано это с тем, что альбумины хорошо связывают воду и в целом обусловливают адекватность гемодинамики и транскапиллярного обмена.
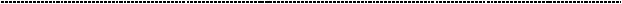
224
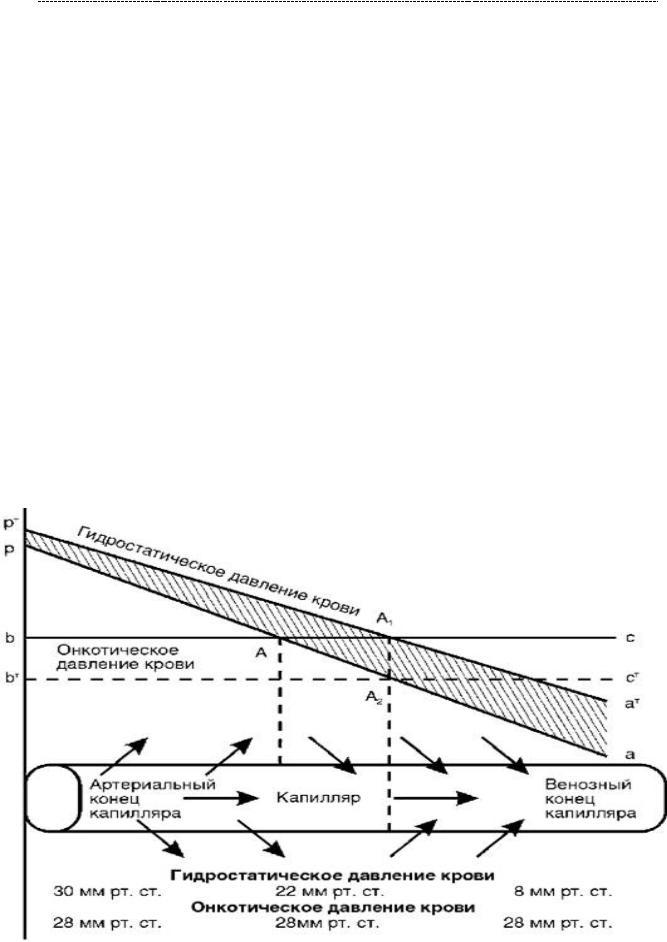
Движение жидкости между капилляром и тканью – неотъемлемый элемент обмена веществ между кровью и клетками. Во многом, вектор движения жидкости является результирующей гидростатического давления сосудов,
тканей и такого же онкотического давления в тканях и сосудах. Альбумины составляют львиную долю онкотического давления плазмы крови.
Но случись беда, и отхватывают они также первыми. Они являются одними из резервных белков, которые будут утилизироваться в условиях недостаточного поступления белка извне. Это те белки, которые будут интенсивно покидать мочу при нефротическом синдром (и в целом при поражении почечных клубочков), при ожогах и обширных ранах и травмах, выраженном воспалении и экссудации. Покидая организм, они разрешают образовываться отёкам, ибо уже ничто не удерживает воду (ничто их больше не ждёт) в дистальном отделе микроциркуляторного русла тканей (вглядись в картинку выше).
Существует ещё один важный клинический аспект, связанный с альбуминами, связан с фармакокинетикой лекарственных препаратов. Очень многие лекарства, при поступлении в кровь, связываются с белками плазмы крови
– чаще всего именно с альбуминами. Это связывание с белками отражается на их фармакологической активности: в таком состоянии препараты неактивны, и
составляют так называемый пул лекарственного препарата: по мере истощения свободной (несвязанной, активной) фракции препарата, последние высвобождаются из связи с белками и вновь приобретают фармакологическую активность. Важно помнить о том, что при снижении содержания альбумина,
фармакокинетика некоторых препаратов меняется: увеличивается доля свободной фракции, и это повышает риск токсических побочных эффектов, при, казалось бы,
адекватной дозы (в соответствии с рекомендациями)
225
14.2. Белкиостройфазы.Приповреждениитканей(привоспалении,ишемии,
некрозах и любых других обстоятельствах), лейкоцитами (макрофагами)
вырабатывают провоспалительные цитокины, которые, в высоких концентрациях оказывают системное действие. Воздействуя на клетки печени (гепатоциты и Купферовские клетки), они провоцируют усиление синтеза и секреции белков острой фазы.
*
Вотношениисекрециибелковостройфазынужносказать, чтоздесьдействуют уже известные нам механизмы. Взаимодействие цитокинов с рецепторами приводит к каскаду внутриклеточных изменений – серии взаимодействия различных протеинов с протеинкиназной активностью - приводящих к активации полифункционального NF-kB (nuclear factor – kappa –chain - enhancer of activated B cells). Переводя на человеческий язык, NF-kB является ключевой фигурой в регуляции (позитивной) экспрессии генов иммунного ответа, а также белков,
участвующих в изменении фазы клеточного цикла и реализации апоптоза.
* - ( http://www.med24info.com/books/immunologiya/provospalitelnye-citokiny-23082.html )

226
В данном случае, он является необходимым условием для синтеза белков острой фазы. Но с чего же всё начинается?
Прижизненный некроз, будучи патологическим вариантом клеточной гибели,
всегда сопряжён с развитием демаркационного (ограничивающего) воспаления.
Это одно из важнейших отличий от апоптоза. Дабы понять разницу, предлагаю тебе следующую, несколько дилетантскую, но понятную аналогию:
Представим себе маленький кирпичный (или досочный) домик твоей собаки.
Снести домик можно аккуратно, по кирпичикам и доскам, которые тыаккуратно сложишь в отдельную кучу. Это кучу заберут специально обученные люди (не спрашивай, как они оказались на твоём участке или в доме), не оставив при этом и следа как своего существования, так и былого существования материала, из которого был создан дом. Это была попытка описать апоптоз. Аккуратное уничтожение клетки, её дезорганизация и вакуолизация органелл и клеточных компартментов с образованием апоптозных телец, поглощаемых и утилизируемых макрофагами – это то, что придаёт апоптозу индивидуальность.
Апоптоз не сопровождается воспалением и системными проявлениями, вотличие от некрозов.
227
Домик можно снести иначе. Взять экскаватор ОМ – 202 и разнести домик в щепки. В этом случае мы получим неупорядоченную кучу мусора, превращающую окружающую землю на протяжении пары метров в непригодное для отдыха места. При некрозах в тканях происходит нечто похожее.
При некрозах формируется детрит – органические остатки погибших клеток в виде конгломерата остатков клеточных органелл. В таких условиях обнажаются те антигены клеток, которые иммунная система склонна распознавать как чужеродные. Макрофаги тканей распознают антигенные детерминанты погибших клеток, претерпевает активацию и секретирует огромное количество цитокинов, в том числе вышеупомянутые интерлейкин – 1 и фактор некроза опухоли. Именно они попадают в системный кровоток и провоцирует подъём белков острой фазы в крови (хотя это далеко не единственная их функция). В очаг повреждения, под действием хемоаттрактантов, подтягиваются лейкоциты,
формируя лейкоцитарный вал. Его суть – ограничить очаги некрозов от окружающих тканей и уничтожить эти очаги. Последний шаг осуществляется путём ферментативного катализа и генерации свободных радикалов.
Нейтрофилы, обладая в своём арсенале такими ферментами, как миелопероксидаза, каталаза, осуществляют экзоцитоз ферментов, однако при этом сами погибают. Совокупность клеточного детрита и погибших нейтрофилов вместе с воспалительным экссудатом (жидкостью - плазмы,
перешедшей из крови в очаг воспаления) составляет гной, или гнойный экссудат.
Любой гнойный процесс будет сопровождаться системными проявлениями, в виде лихорадки и интоксикации, имеющей самые разные выражения: головные боли,
слабость, боли в суставах и мышцах, эмоциональная лабильность. В основе этих проявлений лежит действие уже известных тебе цитокинов – ИЛ – 1, ФНО – а и ИЛ – 6. Место их продукции – очаг повреждения (некрозы). Путь реализации их системного эффекта представлен на вышеуказанном рисунке: данный каскад является достаточно универсальным для многих клеток.
228
14.2.1. Биологическая роль и клиническое значение белков острой фазы.
Биологическая роль белков острой фазы (БОФ) заключается в разносторонней защите от инфекционных агентов. БОФ усиливают эффективность иммунного ответа, ограничивают условия для жизнедеятельности инфекционных патогенов,
причём каждый белок это делает по своему..
Говоря о классификации, БОФ делятся на позитивные и негативные. Отличия обусловлены изменением концентрации при повреждении тканей: первая группа в этих условиях имеет тенденцию к повышению концентрации (С - реактивный белок, церулоплазмин, плазминоген, гаптоглобин, а1 – антитрипсин, антитромбин
III, фракция С3 системы комплемента и многие другие), вторая – к снижению
(трансферрин, транстиретин).
Примечательно, что функция некоторых БОФ выходит за пределы защиты от инфекционных агентов, что выражается в развитии тяжёлых наследственных заболеванийпри наличиидефицита экспрессиисоответствующихгенов(см. далее)
С – реактивный белок (СРБ). По разным данным, биологической функцией СРБ являетсяактивацияклассическогопутикомплементапосредствомсвязыванияC1q.
Каждая субъединица СРБ содержит Са2+ - зависимый сайт связывания фосфорилхолина и сайт связывания комплемента C1q. Связывание фосфорилхолина индуцирует конформационное изменение на противоположном участке молекулы с последовательным связыванием C1q и активацией классического пути комплемента; Другой функцией является связывание с рецепторами Fcγ иммуноглобулина и, тем самым, усиление опсонизации биологических частиц.
В целом, СРБ способен связывать широкий спектр лигандов – компонентов микроорганизмов, токсинов,частицповрежденныхтканей,препятствуятемсамым их распространению. А продукты такого взаимодействия, в свою очередь,
активируют систему комплемента, стимулируя процессы фагоцитоза и удаления

229
вредных продуктов. СРБ может так же взаимодействовать и с Т-лимфоцитами,
фагоцитами и тромбоцитами, регулируя их функции в условиях воспаления.
(механизм клеточной деструкции под действием системы комплемента, фото в цвете)
При повреждении тканей, бактериальных, грибковых (менее выраженно – при вирусных заболеваниях), уровень СРБ может превышать все допустимые нормы
(от 5 мг/л) в самых разных пределах. Показано повышение уровня СРБ при таких состояниях, как инфаркт миокарда, ишемический инсульт, болезнях периферических артерий, онкологических заболеваниях, аутоиммунных процессах. В настоящее время существуют работы, результаты которых свидетельствуют о важной роли СРБ в развитии атеросклероза.
В целом, можно утверждать, что СРБ является практически наиболее чувствительным маркером повреждения тканей самой разной этиологии. В силу этого, он нашёл широкое применение в клинической практике и используется для лабораторной оценки динамики течения воспалительных (инфекционных,
иммунопатологических и др.) заболеваний. Особое значение это имеет и для ведения пациентов хирургического профиля.
230
14.2.1.2. Биологическая роль меди. Место церулоплазмина в рядах БОФ.
Болезнь Вильсона – Коновалова. Метаболизм меди в организме выражается в участии ионов меди в различных окислительно – восстановительных реакциях.
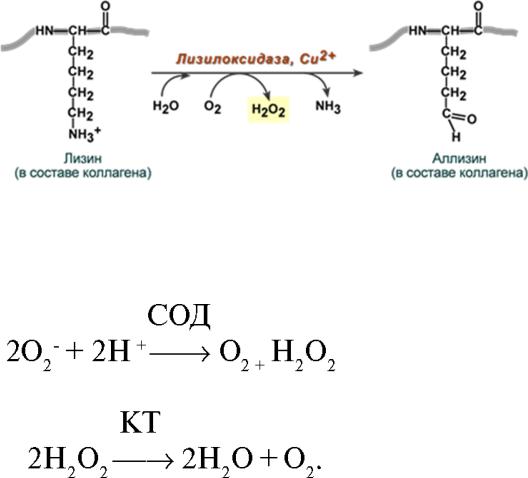
Так, медь является кофактором лизилоксидазы, необходимой для формирования поперечных сшивок в коллагене и эластине.
Важным медь – содержащим белком является цитохром – С – оксидазы
(участника электрон –транспортной цепи, см. главу 5). Незаменимой медь является в антиоксидантной защите (супероксиддисмутаза).
Но наиболее известным медь – содержащим белком является церулоплазмин,
который нашёл особое место в рядах БОФ. Установлено, что уровень церулоплазмина в сыворотке крови значительно изменяется
-при различных инфекционных заболеванияx;
-острых и хронических воспалительных процессах, сопровождающихся деструктивными и некротическими изменениями в тканях;
-при злокачественном опухолевом росте;
- при ишемической болезни сердца. ([Л.А. Куценко, И.П. Кайдашев МЕСТО ЦЕРУЛОПЛАЗМИНА СРЕДИ БЕЛКОВ ОСТРОЙ ФАЗЫ КАК МАРКЕРА СИСТЕМНОГО ВОСПАЛЕНИЯ, 2011 г.)
