
- •Глава I
- •§ 1. Предмет термодинамики и основные черты
- •§ 2. Виды энергии и формы обмена энергией
- •§ 3. Термодинамическая система, окружающая среда и взаимодействие между нмми
- •§ 4. Состояние термодинамической системы, параметры!
- •§ 5. Внутренняя енергия термодинамической системы
- •§ 6. Термодинамические процессы .
- •Глава III
- •§ 13. Понятие о разновесных и обратимых
- •IpOTbl.
- •§ 14. Термодинамический анализ круговых'' процессов (циклов)
- •§ 15. Цикл Карно
- •§ Is. Термический кпд цикла Карно.
- •§ 13. Изменение энтропии в произвольных
- •§ 19. Статистический смысл второго закона термодинамики
- •§ 29. Общая математическая формулировка второго закона
- •§ 23. Свойства характеристических функций
- •§ 31. Фазовая Тр-диаграмма
- •§ 32. Фазовые переходы 2-го рода
- •§ 33. Термодинамические характеристики идеального газа
- •Глава VIII
- •§ 44. Задачи изучения термодинамических процессов
- •§ 45. Изохорный процесс
- •§ 46'. Изобарный процесс
- •Рис, 23, Изобарный процесс:
- •§ 47. Изотермный процесс
- •Глава IX
- •§ 50. Качественные особенности реальных газов
- •§ 51. Уравнение состояния реальных газов
- •§ 52. Уравнение Ван-дер-Ваальса
- •§ 53. Получение пара
- •§ 54. Термодинамические свойства поверхности раздела фаз
- •§ 58. Термодинамические процессы изменения состояния пара
- •§ 60. Температура мокрого термометра
- •§ 62. Смешение потоков влажного воздуха
- •§ 63. Определение влажности воздуха по температурам мокрого и сухого термометров
- •§ 64. Кондиционирование воздуха
- •Глава XII
- •§ 65. Задание состава сложной системы
- •§ 84. Определение параметров состояния и состава рабочих тел и продуктов сгорания
- •Глава XV
- •§ 85. Состав и парциальные молярные свойства растворов
- •§ 86. Уравнение Ван-дер-Ваальса для бинарных систем
- •§ 89. Первый и второй законы Коновалова
- •§ 90. Реальные и многокомпонентные растворы
- •Глава XVI
- •§ 91. Установившееся одномерное течение газов
- •§ 92. Основные уравнения истечения
- •§ 95. Влияние трения на процессы истечения' из. Сопл и диффузоров
- •§ 97. Нерасчетный режим истечения через соппо Лаааля
- •1| § 98. Скачки уплотнения
- •§ 99. Процессы в эжекторах -
- •Глава XVII
- •§ 101. Основные уравнения истечения газа из сосуда
- •§ 120. Паровой цикл Карно
- •§ 121. Теоретический паросиловой цикл (цикл Ренкина)
- •§ 122. Расширение пределов рабочего процесса
- •§ 124. Бинарные циклы 1
- •§ 125. Регенеративный цикл паротурбинной установки
- •§ 126. Циклы атомных энергетических установок
- •§ 127. Циклы парогазовых установок
- •Глава XXII
- •§ 129. Понятие об обратных термодинамических циклах.1
- •§ 130. Разновидности обратных термодинамических циклов и
- •§ 131. Газовые холодильные машины
- •§ 132. Парокомпрессионные холодильные машины
- •§ 133. Абсорбционные холодильные машины
- •§ 134. Тепловой насос и термохимический j
- •§ 135. Получение сжиженных газов
- •§ 142. Эксергетический анализ работы тепловых машин
- •§ 148. Термодинамические параметры плазмы
Глава IX
РЕАЛЬНЫЕ ГАЗЫ
§ 50. Качественные особенности реальных газов
Исследования свойств реальных газов в широком диапазоне термодинамических параметров показали, что свойства таких газов отклоняются от законов, справедливых для идеальных газов, тем значительнее, чем выше их плотность. При условиях, близких к нормальным, оксид углерода (IV), а затем кислород, воздух и азот наимшее, а аргон, водород и гелий наиболее близки к свойствам идеального газа. Молекулы реальных газов в отличие от идеальных газов имеют определенные (конечные) размеры, и между ними существуют силы межмолекулярного взаимодействия. При определенных условиях эти силы могут приводить к ассоциации или диссоциации молекул, что существенно отражается на свойствах газа При малых межмолекулярных расстояниях внутренние силы могут действовать как силы отталкивания и создавать внутреннее давление. При значительных расстояниях между молекулами действуют главным образом силы взаимного притяжения (рис. 30). В связи с этим значение произведения давления реального -газа на его удельный объем pv при изменении давления и сохранении постоянства температуры, как правило, неостается постоянным. В случае уменьшения pv с ростом давления ре^ альный газ оказывается более сжимаемым, чем идеальный газ, и, наоборот, при увеличении pv с ростом р реальный газ оказывается менее сжимаемым по сравнению с идеальным газом.
Результаты измерений показывают, что газы в некотором интервале температур обнаруживают оба эти отклонения от свойств идеального газа и кривые р = pv/(RT) = f (р) имеют экстремум (рис. 31).
Параметр даже у гелия и водорода при определенных условиях существенно отличается от единицы, но по мере повышения температуры и уменьшения давления р приближается к единице.
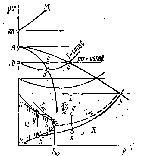
Особенности поведения реальных газов можно проследить при сравнении изотерм реального и идеального газов в координатах р, v.
Так, в области малых значений удельного объема газа (точка а на рис. 32, а) изотерма идеального газа (pv = const) более полога, чем изотерма реального газа (Т = const). Это связано с тем, что при большой плотности (мало а) молекулы реального газа, имеющие конечные
• а
размеры, находятся друг от друга на небольших расстояниях и их влияние на сжимаемость становится существенным. Коэффициент изотермной сжимаемости газа (6) характеризуется тангенсом угла <р или \j> между касательной в данной точке изотермы и отрицательным направлением оси ординат. Так как ср-угол между осью р и касательной в точке а, проведенной к изотерме реального газа Т = const, а ■ф — угол между осью р и касательной в точке а, проведенной к изотерме идеального газа pv = const, то сжимаемость реального газа меньше сжимаемости идеального газа (tg ф < tg гр).
В точке Ьу лежащей в области больших значений удельного объема у, сжимаемость реального газа оказывается более высокой вследствие влияния сил взаимного притяжения между молекулами (tg Ф > tg Ф).
Можно продолжить изотермы, проходящие через точку b в область малых удельных объемов, и найти точку с их пересечения.
Следовательно, при некотором давлении, большем, чем в точке Ь, и меньшем, чем в точке с, сжимаемости реального и идеального газов
одинаковы. Если соответствующие Р(1с 30 Изменение энергии взаим0. состояния реального и идеального действия молекул некоторых" газов а газов обозначить точками а и е, 'ГО зависимости от расстояния между мо- касательные к изотермам в этих лекулами,-
точках должны быть параллельны /-со; 2-аг; з-нг: 4-не „
(tg Ф = tg ф).
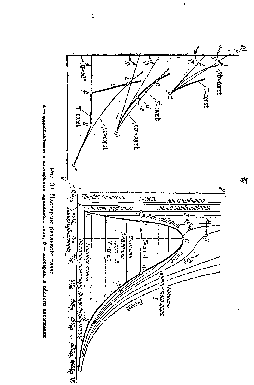
В области еще более высоких значений удельного объема и низких давлений изотермы реального газа имеют горизонтальный участок. Такова, например, изотерма Т — const, проходящая через точку f. При этом точка g соответствует началу конденсации газа, в то время как в точке Һ газ полностью превращается в капельно-жидкое состояние. Изменение физического состояния вещества на участке gh происходит при условии Т = const и р = const и характеризуется наличием как газообразной, так и жидкой фаз (область насыщения). Сравнивая изотерму реального газа с изотермой идеального газа pv = const, проходящей через ту же точку /, можно заметить, что сжимаемость реального газа или жидкости на участке fgh больше, а на участке hi меньше, чем у идеального газа. Из-за слабой сжимаемости для жидкостей характерно лишь незначительное уменьшение удельного объема при значительном- повышении давления.
В области насыщения gh при соответствующем изменении параметров состояния происходит постепенное сжижение газа по мере уменьшения удельного объема о. Повышение темиерачуры и давления приводит к

уменьшению участка сжижения, показанного на рис. 32, б< в виде горизонтального отрезка1 прямой gh. Следовательно, по мере повышения температуры разница между плотностями жидкой и газовой фаз уменьшается. Кривая KN называется верхней пограничной кривой. Состояния; саза, соответствующие точкам на< этой кривой, называются сухим насыщенным п а р о, м. Кривая КМ, на которой располагается, тонка hy называется нижней пограничной кривой. Она соответствует состояниям вещества, характер-

ным
для кипящей жидкости. Точка Қ,
в
которой исчезает различие между
жидкой и газовой фазами, называется
критической
точкой.
Состояние вещества при критическом
давлении критическое удельном объеме
у„р
и критической температуре Тк
v
называется
критическим
(табл. 4).

Критическое давление и температура являются максимальными для области двухфазного состояния. В критической точке К' удельная теплота парообразования г обращается в ноль. Это следует из уравнения (172) Клапейрона — Клаузиуса, так как в точке К v' = v", а dps/dT не может быть бесконечно большой величиной.
Критическая изотерма, проходящая через точку К, имеет точку перегиба. При температурах выше критической изотермы не имеют горизонтальных касательных. Это означает, что при сверхкритических температурах осуществить сжижение газа невозможно. Только по мере увеличения температуры (больше критической) характер изотерм реального газа постепенно приближается к характеру изотерм идеального газа.
На ир-диаграмме (рис. 32, б) видны три характерные области. В гомогенной области / вещество находится в газообразном состоянии. Газ в состояниях, близких к верхней пограничной кривой KN, принято называть перегретым паром. В изотермном процессе, протекающем в области /, по мере повышения давления наблюдается монотонное уменьшение удельного объема вещества. Область // соответствует капельно-жидкому состоянию. Как в области /, так и в области // вещество находится в гомогенном однофазном состоянии и граница между этими областями в значительной мере условна. Эта граница, при Т= Тнр и р >ркр совпадающая с критической изотермой (Ткр = const), на рис. 32, б показана пунктиром; В процессе испарения, соответствующем, например, линии х-у, происходит непрерывное накапливание качественных различий между жидкостью и паром. Если в точке х вещество обладает свойствами жидкости, то в
точке у появляются свойства газа. Здесь в отличие от процессов, протекающих при давлениях ниже критических, не наблюдается скачкообразного изменения физических свойств испаряющейся жидкости.
В гетерогенной (двухфазной) области /// сухой насыщенный пар и кипящая жидкость находятся в термодинамическом равновесии. По мере приближения к верхней пограничной кривой содержание жидкости уменьшается, в то время как содержание сухого насыщенного пара возрастает Эту смесь кипящей жидкости и сухого насыщенного пара принято называть влажным паром.
Из изложенного следует, что любой реальный газ путем изо- термного сжатия можно перевести в капельно-жидкое состояние. Однако это возможно лишь при температурах ниже критической .
Отношение RTKV! (ркрикр) реальных іазов в несколько раз больше единицы. Это свидетельствует о том, что поведение реальных газов в критической точке существенно отклоняется от идеальных газов (для которых RT! (pv) = 1)
Отклонение свойств реальных газов от свойств идеальных газов становится особенно замет, ным на р, pv—диаграмме, представленной на рис. 33 В системе Рис- 33- Р- /^-диаграмма реального газа координат р, pv изотермы реальных газов (Т = const) имеют минимум; изотермы идеальных газов (pv = const) изображаются отрезками горизонтальных прямых. На участке bd коэффициент сжимаемости реального газа р уменьшается, вто время как на. участке dc возрастает В точке минимума d сжимаемость реального и идеального газов одинакова.
Кривая Ad, соединяющая точки минимума реальных изотерм, называется линией Бойля. Температура, соответствующая изотерме с точкой минимума А на оси ординат, называется температурой Бойля. Вблизи точки А реальный газ обладает всеми свойствами идеального газа. (В самой точке А р = 0, а удельный объем бесконечно велик) При температурах, больших температуры Бойля (изотермы тМ), произведение pv увеличивается по мере роста р.
Показанная на рис. 33 р -pv-диаграмма, так же как и ир-диаграмма (рис. 32), является диаграммой состояния. Каждой точке на ней соответствуют три термодинамических параметра р, v и Т v?
О возможности существования реального вещества в различных агрегатных состояниях дают наглядное представление поверхность vpT (рис. 34, а) и ее проекция на плоскость Тр (рис. 34, б). Твердые
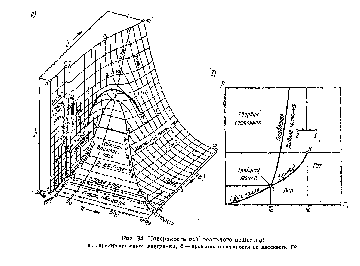
состояния соответствуют участку термодинамической поверхности twbf, жвдкие—участку кфае, а газообразные—участку kjtdgmmv Кроме snoro., на термодинамической поверхности состояния можно выделить обяа«та, в которых одновременно существуют две фазы: akd — область ішйшйя, need —область плавления и [dbg — область сублимации. В точке а. называемой тройной тачкой, вещество может суще
ствовать одновременно в трех агрегатных состояниях. Форма поверхности vpT отражает индивидуальные особенности данного вещества.
Об особенностях изменения основных термодинамических параметров реальных газов — водорода и гелия в области низких температур — можно судить по «Г-диаграіммам (см. приложения 1 и 2). Эти газы широко йоіишъзуются в технике низких температур.
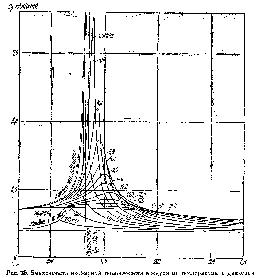
Об отклонении свойств реальных газов от свойств идеальных газов можно судить и ио их теплоемкостям. Если теплоемкости идеальных
газов зависят только от температуры, то теплоемкости реальных газов существенно зависят не только от температуры, но и от давления или объема. Так, например, по мере приближения к критической точке теплоемкость ср некоторых веществ, например водяного пара, водорода и воздуха, начинает неограниченно возрастать, что объясняется большим расходом тепловой энергии на распад крупных молекулярных ассоциаций. О зависимости/изобарной теплоемкости воздуха от температуры и давления можно судить по рис. 35.
