
- •Билет № 1
- •Принципы классификации дисперсных систем
- •Потенциал и ток течения
- •Поверхностно-активные вещества и их классификация
- •Билет № 2
- •Молекулярно-кинетические свойства дисперсных систем
- •Электрофорез
- •Адсорбционный потенциал
- •Билет № 3
- •Билет 3. Седиментация суспензий и седиментационно-диффузионное равновесие
- •Электроосмос
- •Теория быстрой коагуляции Смолуховского
- •1. Оптические свойства дисперсных систем
- •2. Зависимость ψ1-потенциала от концентрации электролита
- •3. Правило уравнивания полярностей Ребиндера
- •Билет № 5
- •Билет № 6
- •Строение двойного электрического слоя (дэс) на границе раздела твердое тело – жидкость. Потенциалы дэс.
- •Защитное действие растворов высокомолекулярных соединений
- •Билет № 7
- •Билет 7. Химический потенциал и давление пара у искривленных поверхностей
- •Механизмы образования двойного электрического слоя на поверхности твердых тел
- •Влияние многозарядных ионов на устойчивость гидрофобных коллоидов
- •Билет № 8
- •Уравнение адсорбции Гиббса
- •Числа переноса ионов в капиллярных системах
- •Электрокинетический потенциал и его роль в устойчивости гидрофобных коллоидов
- •Билет 9. Изотерма адсорбции Ленгмюра (адсорбция на границе раздела раствор - газ)
- •Основные положения теории двойного электрического слоя Гуи-Чепмена, модифицированной теории Гуи, теории Штерна.
- •Лиофильные коллоидные системы
- •Билет № 10
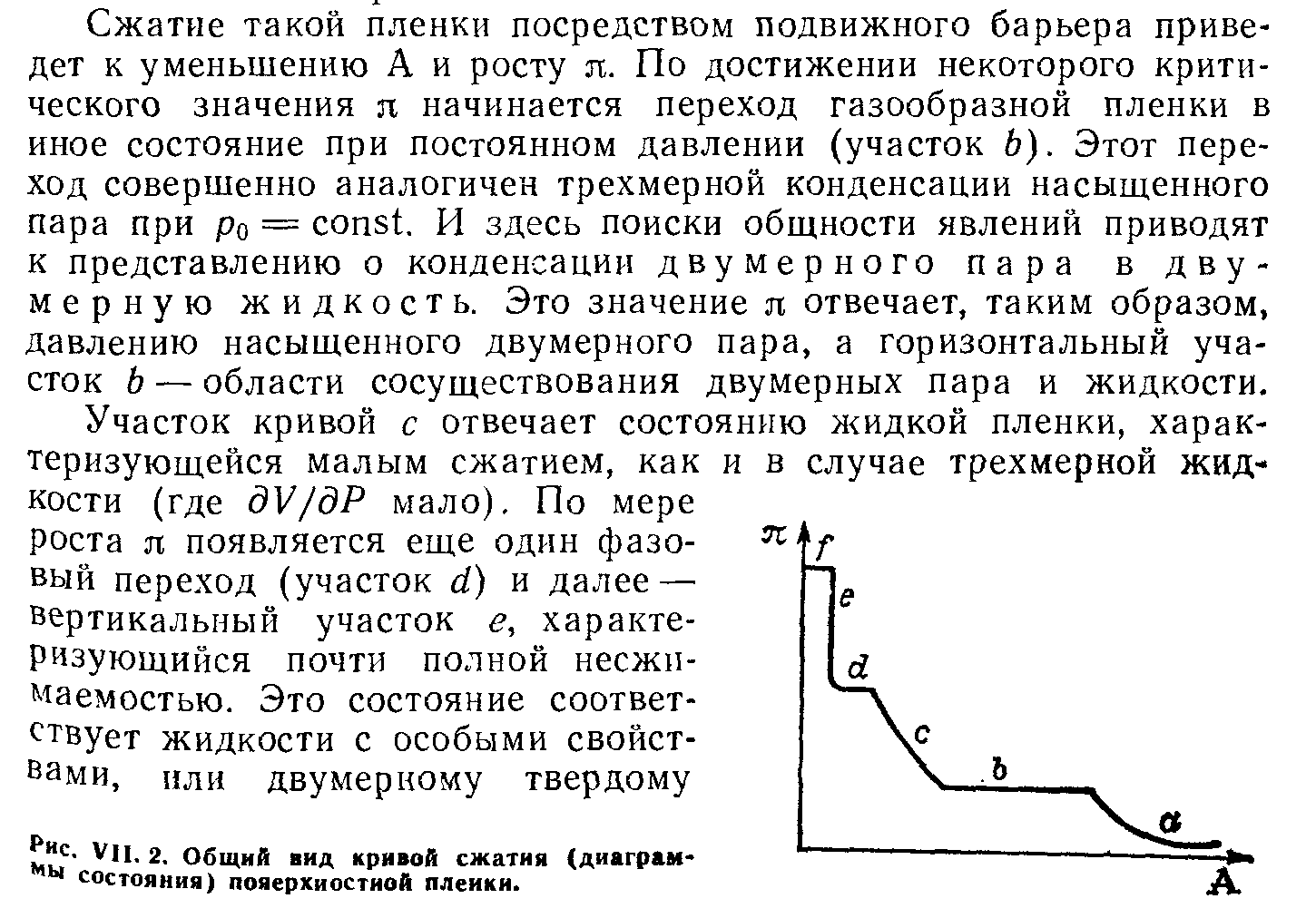
- •Поверхностные пленки нерастворимых веществ
- •Индифферентные и специфически сорбирующиеся электролиты. Влияние на устойчивость гидрофобных коллоидов
- •3. Поверхностная проводимость
- •Билет № 11
- •Адсорбция на поверхности твердых тел. Теплоты адсорбции и смачивания
- •Методы определения размеров частиц
- •Приведенная толщина диффузного слоя; зависимость от вида электролита
- •Билет № 12
- •Теория адсорбции Ленгмюра (граница раздела твердое тело – газ или пар)
- •Электрокинетический потенциал; влияние концентрации электролита и заряда противоиона
- •Поверхностное натяжение и способы его определения
- •Билет № 13
- •Теория адсорбции Поляни
- •Коллоидно-химические основы охраны окружающей среды
- •Электрокинетический потенциал
- •Билет № 14
- •Теория адсорбции Брунауэра – Эммета – Теллера
- •Высокомолекулярные электролиты
- •Правило уравнивания полярностей Ребиндера
- •Билет № 15
- •Адсорбция неэлектролитов на границе раздела твердое тело – жидкость (молекулярная адсорбция)
- •Мицеллообразование в водных и неводных средах.
- •Изоэлектрическая точка и точка нулевого заряда
- •Билет № 16
- •Адсорбция электролитов на границе раздела твердое тело – жидкость и возникновение двойного электрического слоя
- •Структурно-механические свойства дисперсных систем
- •Защитное действие растворов высокомолекулярных соединений
- •Билет № 17
- •Электрокапиллярные явления
- •Влияние электролитов на устойчивость гидрофобных коллоидов. Роль -потенциала
- •Поверхностная активность
- •Билет № 18
- •Теория двойного электрического слоя Гуи – Чепмена
- •Электродиализ
- •Флотация
- •Билет № 19
- •Теория двойного электрического слоя Штерна
- •Работа адсорбции. Правило Траубе
- •Основные факторы устойчивости гидрофобных коллоидов
- •Билет № 20
- •Параметры дэс и их зависимость от концентрации электролита
- •Электроосмос
- •Устойчивость лиофильных и лиофобных коллоидных систем
- •Билет № 21
- •Билет 21. Электрокинетические явления
- •Капиллярная конденсация
- •Адсорбционный потенциал
- •Билет № 22
- •Потенциал и ток течения
- •Теплоты физической адсорбции и смачивания
- •Поверхностное и пограничное натяжение
- •Билет № 23
- •Электрокинетический потенциал. Влияние концентрации электролита и вида противоиона
- •Уравнение состояния поверхностного слоя разбавленных растворов
- •Критическая концентрация мицеллообразования (ккм)
- •Билет № 24
- •Потенциалы двойного электрического слоя. Зависимость от концентрации электролита
- •Работа адсорбции. Правило Траубе
- •Пептизация
- •Билет № 25
- •Электрокинетические свойства капиллярных систем
- •Поверхностно-активные и поверхностно-инактивные вещества
- •Изоэлектрическая точка и точка нулевого заряда
- •Билет № 26
- •Билет 26. Методы получение и очистки дисперсных систем
- •Изменение уровня жидкости в капиллярах
- •Правило Шульце - Гарди
- •Билет № 27
- •Теория быстрой коагуляции Смолуховского
- •Критическое сопоставление теорий адсорбции газов и паров твердыми телами
- •Числа переноса ионов в капиллярных системах
- •Билет № 28
- •Поверхностное натяжение жидкостей
- •Теория устойчивости гидрофобных коллоидов Дерягина – Ландау – Фервея – Овербека
- •3. Правило уравнивания полярностей Ребиндера
- •Билет № 29
- •Специфика коллоидного состояния вещества
- •Коагулирующее действие электролитов
- •Капиллярное давление
Основные положения теории двойного электрического слоя Гуи-Чепмена, модифицированной теории Гуи, теории Штерна.
ДЭС – двойной электрический слой – тонкий поверхностный слой из пространственно разделенных электрических зарядов противоположного знака, образующихся на границе двух фаз. Модельные представления о строении ДЭС на границе раздела фаз: Б. Гуи, Д. Чапмен учли тепловое движение в растворах электролитов.
Эта теория позволяет рассчитать плотность ρзаряда ДЭС и величину дифференциальной емкости С, они учли влияние концентрации, но рассчитанные значения дифференциальной емкости С, но они меньше сходятся с экспериментально полученными результатами. Теория Гуи, Чапмена применима к разбавленным растворам электролитов.
Недостатки:
1) не учитываются размеры ионов;
2) не учитывается явление адсорбции на границе раздела фаз.

В. Штерн учел, что в электролитах наблюдается электростатическое взаимодействие между ионами, тепловое движение компонентов электролита и возможное специфическое взаимодействие компонентов электролита с поверхностью электрода.
Он соединил теорию Гельмгольца с теорией Гуи, Чапмен, в результате ДЭС представлялся состоящим из двух частей:
1) плотной части Гельмгольца;
2) диффузной части по модели Гуи, Чапмена.
За счет адсорбции ПА компонента может происходить перезаряд поверхности. Штерн считал, что адсорбция происходит на границе плотной и диффузной части ДЭС. Эта граница называетсяплоскостью Гельмгольца.
Теория Штерна легла в основу современных представлений и развивалась в работах Грема, Фрумкина, Эршлера, Есина и др.
Недостатки:
1) не учитывал дискретность зарядов;
2) величина емкости, рассчитанная по модельным представлениям Штерна, не соответствовала экспериментально полученным результатам.
Г. Греем рассмотрел возможность адсорбции ПА анионов внутри плотной части ДЭС, он ввел понятие внутренней и внешней плоскости Гельмгольца.
Адсорбция анионов происходит на внутренней плоскости Гельмгольца.
Недостаток: рассматривал адсорбцию только анионов и не учитывал дискретность зарядов.
Лиофильные коллоидные системы
К
лиофильным коллоидным системам относят
ультрамикрогетерогенные термодинамически
устойчивые системы, образование которых
может протекать самопроизвольно как
из макроскопических фаз, так и из
гомогенных растворов. Термодинамическая
выгодность самопроизвольного
диспергирования макрофаз обусловлена
тем, что возрастание свободной межфазной
энергии компенсируется энтропийным
фактором, так как энтропия смешения
возрастает вследствие включения каждой
образующейся частицы в самостоятельное
броуновское движение. При этом необходимым
условием образования лиофильной
коллоидной системы является значение
межфазной свободной энергии ![]() ,
не превышающее некоторой критической
величины
c (при
комнатной температуре это десятые -
сотые доли мДж/м2).
,
не превышающее некоторой критической
величины
c (при
комнатной температуре это десятые -
сотые доли мДж/м2).





![]()
Билет № 10
Поверхностные пленки нерастворимых веществ

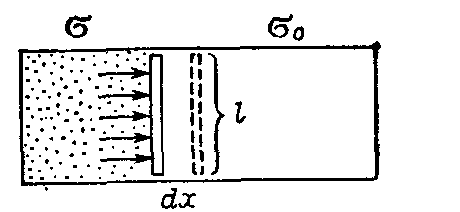


Индифферентные и специфически сорбирующиеся электролиты. Влияние на устойчивость гидрофобных коллоидов
Индифферентным
называется
электролит, при введении которого
межфазный потенциал φ не изменяется.
Данный электролит не содержит таких
ионов, которые были бы способны к
специфической адсорбции на частицах
по правилу Панета-Фаянса т.е. не способны
достраивать кристаллическую решётку
агрегата. Концентрационная коагуляция
наблюдается, например, при добавлении
нитратов к коллоидному раствору AgI
с положительным зарядом коллоидных
частиц:
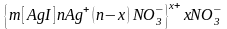
 +
+
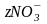 →
→


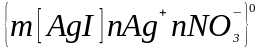 +
zNO3-
+
zNO3-
По
мере увеличения концентрации добавляемого
электролита (ионов
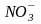 )
концентрации противоионов в диффузном
слое увеличивается, что приводит к
нарушению установившегося ранее
диффузионного распределения противоионов
и усилению сил электростатического
притяжения между потенциалопределяющими
и противоионами, в следствие чего часть
ионов из диффузного слоя переходит в
адсорбционный. При этом диффузный слой
сжимается, уменьшается заряд коллоидной
частицы и, как следствие, снижается ζ –
потенциал.
)
концентрации противоионов в диффузном
слое увеличивается, что приводит к
нарушению установившегося ранее
диффузионного распределения противоионов
и усилению сил электростатического
притяжения между потенциалопределяющими
и противоионами, в следствие чего часть
ионов из диффузного слоя переходит в
адсорбционный. При этом диффузный слой
сжимается, уменьшается заряд коллоидной
частицы и, как следствие, снижается ζ –
потенциал.

 φ
φ
A
ζ0
ζ1
ζ2 B
r
Рис. Изменение ζ – потенциала при добавлении индифферентного электролита. Граница ДЭС 1–1 соответствует исходному коллоидному раствору; границы 2 – 2, 3 – 3 получены после добавления соответствующих количеств электролита (поверхность скольжения совпадает с границей адсорбционного и диффузного слоёв).
В рис. и далее для простоты принято, что поверхность скольжения АВ совпадает с границей адсорбционного и диффузного слоев. При достаточном увеличении концентрации индифферентного электролита может наступить состояние, при котором диффузный слой исчезнет и коллоидная частица станет электронейтральной, т.е. наступает изоэлектрическое состояние – состояние коллоидной частицы, при котором электрокинетический потенциал (ζ) равен нулю, наступает коагуляция. Формула мицеллы в таком состоянии приобретает вид:
Нейтрализационная коагуляция происходит при добавлению к золю неиндифферентного электролита. Неиндифферентным называется электролит способный изменить межфазный (φ) и линейно с ним связанный электрокинетический (ζ) потенциалы, т.е. данный электролит содержит ионы, способные специфически адсорбироваться на поверхности агрегата, достраивать его кристаллическую решётку или химически взаимодействовать с потенциалопределяющими ионами. Нейтрализационный механизм реализуется лишь тогда, когда заряд частиц невелик. При этом слои противоинов малы и возможна непосредственная адсорбция коагулирующих ионов на поверхности частиц, т.е. нейтрализуют потенциалоопределяющие ионы, уменьшая термодинамический потенциал и соответственно ξ – потенциал.
Нейтрализационная
коагуляция наблюдается, например, при
добавлении K2S
к коллоидному раствору AgI
с положительно заряженными коллоидными
частицами. Между коагулирующими анионами
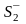 и потенциалопределяющими ионами Ag+
происходит реакция с образованием
малорастворимого соединения Ag2S,
что приводит к разрушению мицеллы AgI:
и потенциалопределяющими ионами Ag+
происходит реакция с образованием
малорастворимого соединения Ag2S,
что приводит к разрушению мицеллы AgI:
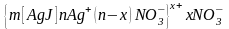
 +
+
 K2S
+ 2K+
K2S
+ 2K+
Ag2S↓ + KI + KNO3
В результате связывания потенциалопределяющих ионов и число противоинов, необходимых для компенсации заряда поверхности ядра, уменьшается, что приводит к падению межфазного потенциала, а следовательно и дзета – потенциала вплоть до нуля (рис. ).
 φ0
A
φ0
A

φ1
 ζ0
ζ0
 φ2
φ2
ζ1
B
 ζ2
ζ2
r
Рис. Изменение φ и ζ – потенциалов при добавлении неиндифферентного электролита.
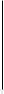

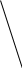
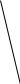 φ1
φ1
φ0
ζ1
ζ0
ζ2

Рис. Изменение φ и ζ – потенциалов при добавлении неиндифферентного электролита, способного достраивать кристаллическую решётку агрегата.
При введении в коллоидную систему электролита, один из ионов которого способен достраивать кристаллическую решётку дисперсной фазы, сначала может произойти увеличение φ – потенциала, вследствие дополнительной адсорбции потенциалопределяющих ионов, и, соответственно, увеличение ζ – потенциала (рис. φ1 >φ0, ζ1 > ζ0). Затем при достижении максимальной адсорбции потенциалопределяющих ионов будет наблюдаться сжатие диффузного слоя, приводящее к снижению дзета – потенциала (как в случае действия индифферентного электролита) и, после достижения его критического значения, к коагуляции коллоидной системы.
