
- •Билет № 1
- •Принципы классификации дисперсных систем
- •Потенциал и ток течения
- •Поверхностно-активные вещества и их классификация
- •Билет № 2
- •Молекулярно-кинетические свойства дисперсных систем
- •Электрофорез
- •Адсорбционный потенциал
- •Билет № 3
- •Билет 3. Седиментация суспензий и седиментационно-диффузионное равновесие
- •Электроосмос
- •Теория быстрой коагуляции Смолуховского
- •1. Оптические свойства дисперсных систем
- •2. Зависимость ψ1-потенциала от концентрации электролита
- •3. Правило уравнивания полярностей Ребиндера
- •Билет № 5
- •Билет № 6
- •Строение двойного электрического слоя (дэс) на границе раздела твердое тело – жидкость. Потенциалы дэс.
- •Защитное действие растворов высокомолекулярных соединений
- •Билет № 7
- •Билет 7. Химический потенциал и давление пара у искривленных поверхностей
- •Механизмы образования двойного электрического слоя на поверхности твердых тел
- •Влияние многозарядных ионов на устойчивость гидрофобных коллоидов
- •Билет № 8
- •Уравнение адсорбции Гиббса
- •Числа переноса ионов в капиллярных системах
- •Электрокинетический потенциал и его роль в устойчивости гидрофобных коллоидов
- •Билет 9. Изотерма адсорбции Ленгмюра (адсорбция на границе раздела раствор - газ)
- •Основные положения теории двойного электрического слоя Гуи-Чепмена, модифицированной теории Гуи, теории Штерна.
- •Лиофильные коллоидные системы
- •Билет № 10
- •Поверхностные пленки нерастворимых веществ
- •Индифферентные и специфически сорбирующиеся электролиты. Влияние на устойчивость гидрофобных коллоидов
- •3. Поверхностная проводимость
- •Билет № 11
- •Адсорбция на поверхности твердых тел. Теплоты адсорбции и смачивания
- •Методы определения размеров частиц
- •Приведенная толщина диффузного слоя; зависимость от вида электролита
- •Билет № 12
- •Теория адсорбции Ленгмюра (граница раздела твердое тело – газ или пар)
- •Электрокинетический потенциал; влияние концентрации электролита и заряда противоиона
- •Поверхностное натяжение и способы его определения
- •Билет № 13
- •Теория адсорбции Поляни
- •Коллоидно-химические основы охраны окружающей среды
- •Электрокинетический потенциал
- •Билет № 14
- •Теория адсорбции Брунауэра – Эммета – Теллера
- •Высокомолекулярные электролиты
- •Правило уравнивания полярностей Ребиндера
- •Билет № 15
- •Адсорбция неэлектролитов на границе раздела твердое тело – жидкость (молекулярная адсорбция)
- •Мицеллообразование в водных и неводных средах.
- •Изоэлектрическая точка и точка нулевого заряда
- •Билет № 16
- •Адсорбция электролитов на границе раздела твердое тело – жидкость и возникновение двойного электрического слоя
- •Структурно-механические свойства дисперсных систем
- •Защитное действие растворов высокомолекулярных соединений
- •Билет № 17
- •Электрокапиллярные явления
- •Влияние электролитов на устойчивость гидрофобных коллоидов. Роль -потенциала
- •Поверхностная активность
- •Билет № 18
- •Теория двойного электрического слоя Гуи – Чепмена
- •Электродиализ
- •Флотация
- •Билет № 19
- •Теория двойного электрического слоя Штерна
- •Работа адсорбции. Правило Траубе
- •Основные факторы устойчивости гидрофобных коллоидов
- •Билет № 20
- •Параметры дэс и их зависимость от концентрации электролита
- •Электроосмос
- •Устойчивость лиофильных и лиофобных коллоидных систем
- •Билет № 21
- •Билет 21. Электрокинетические явления
- •Капиллярная конденсация
- •Адсорбционный потенциал
- •Билет № 22
- •Потенциал и ток течения
- •Теплоты физической адсорбции и смачивания
- •Поверхностное и пограничное натяжение
- •Билет № 23
- •Электрокинетический потенциал. Влияние концентрации электролита и вида противоиона
- •Уравнение состояния поверхностного слоя разбавленных растворов
- •Критическая концентрация мицеллообразования (ккм)
- •Билет № 24
- •Потенциалы двойного электрического слоя. Зависимость от концентрации электролита
- •Работа адсорбции. Правило Траубе
- •Пептизация
- •Билет № 25
- •Электрокинетические свойства капиллярных систем
- •Поверхностно-активные и поверхностно-инактивные вещества
- •Изоэлектрическая точка и точка нулевого заряда
- •Билет № 26
- •Билет 26. Методы получение и очистки дисперсных систем
- •Изменение уровня жидкости в капиллярах
- •Правило Шульце - Гарди
- •Билет № 27
- •Теория быстрой коагуляции Смолуховского
- •Критическое сопоставление теорий адсорбции газов и паров твердыми телами
- •Числа переноса ионов в капиллярных системах
- •Билет № 28
- •Поверхностное натяжение жидкостей
- •Теория устойчивости гидрофобных коллоидов Дерягина – Ландау – Фервея – Овербека
- •3. Правило уравнивания полярностей Ребиндера
- •Билет № 29
- •Специфика коллоидного состояния вещества
- •Коагулирующее действие электролитов
- •Капиллярное давление
Числа переноса ионов в капиллярных системах
:
Билет № 28
Поверхностное натяжение жидкостей
Пове́рхностное натяже́ние — термодинамическая характеристика поверхности раздела двух находящихся в равновесии фаз, определяемая работой обратимого изотермокинетического образования единицы площади этой поверхности раздела при условии, что температура, объем системы и химические потенциалы всех компонентов в обеих фазах остаются постоянными.
Поверхностное натяжение имеет двойной физический смысл — энергетический (термодинамический) и силовой (механический). Энергетическое (термодинамическое) определение: поверхностное натяжение — это удельная работа увеличения поверхности при её растяжении при условии постоянства температуры. Силовое (механическое) определение: поверхностное натяжение — это сила, действующая на единицу длины линии, которая ограничивает поверхность жидкости[1].
Сила поверхностного натяжения направлена по касательной к поверхности жидкости, перпендикулярно к участку контура, на который она действует и пропорциональна длине этого участка. Коэффициент пропорциональности γ — сила, приходящаяся на единицу длины контура — называется коэффициентом поверхностного натяжения. Он измеряется в ньютонах на метр. Но более правильно дать определение поверхностному натяжению, как энергии (Дж) на разрыв единицы поверхности (м²). В этом случае появляется ясный физический смысл понятия поверхностного натяжения.
Теория устойчивости гидрофобных коллоидов Дерягина – Ландау – Фервея – Овербека
Отличительной особенностью лиофобных коллоидов является их двойственное отношение к электролитам. Так, присутствие не-больших количеств некоторых, потенпиалопределяющих ионов в дисперсионной среде является необходимым для придания всей лио-фобной системе агрегативной устойчивости. Но введение в устойчивый золь несколько больших количеств низкомолекулярных электролитов обычно вызывает сначала медленную, а затем по достижении пороговой, или критической, концентрации быструю коагуляцию золя. Фактически именно подобное поведение какого-либо золя под воздействием электролита считается достаточным, чтобы классифицировать его как лиофобный в отличие от лиофильных коллоидов, для коагуляции которых необходима высокая концентрация электролита, порядка нескольких молей на литр. В основу теории ДЛФО было положено предположение, что в силу термодинамической неустойчивости лирфобных золей их агрегатив-ная устойчивость может иметь лишь кинетический характер, а устойчивое состояние следует трактовать как «замороженное» состояние с практически нулевой скоростью коагуляции. Причиной такой устойчивости является то, что в коллоидных растворах в отличие от обычных молекулярных или истинных растворов дальнодействующие поверхностные силы способны при определенных условиях создавать достаточно высокий потенциальный барьер, резко уменьшающий вероятность сближения частиц или даже практически целикомисклю-чающий зту возможность. Поэтому важнейшее место в решении задачи об устойчивости любого лиофобного золя теория ДЛФО отводит анализу силовых и потенциальных кривых г получаемых суперпозицией электростатического отталкивания и молекулярного притяжения. "
Теория коагуляции золей под действием электролитов (теория ДЛФО) строится на рассмотрении баланса молекулярных сил притяжения и сил ионно-электростатического отталкивания, действующих в узком зазоре, разделяющим частицы дисперсной фазы. Первые количественные расчеты были произведены Б.В.Дерягиным в конце 30-х гг. и затем завершены в работе Б.В.Дерягина и Л.Д.Ландау (1941 г.). Аналогичный подход к изучению устойчивости коллоидных систем независимо был развит в работах голландских исследователей Фервея и Оербека (1946 г.). По начальным буквам фамилий основных авторов теория получила название ДЛФО.
Основное
упрощение теории ДЛФО состоит в том,
что на частицы действуют две силы. Одна
из них – взаимное
притяжение частиц, создаваемое
дисперсионными силами.
Энергия дисперсионного притяжения,
отнесенная к единице площади поверхности
определяется выражением ![]() (1) где А* –
сложная константа Гамакера, h –
ширина зазора между частицами. Знак
минут указывает на взаимное притяжение
частиц. Вторая сила – ионно-электростатическое
отталкивание, возникающее за счет
перекрывания диффузных частей двойных
электрических слоев,
окружающих частицы. При перекрывании
двойных слоев для сближения частиц надо
совершить дополнительную работу по
концентрированию противоионов в тонкой
пленке раствора электролита в зазоре
между частицами. Энергия электростатического
отталкивания на достаточно больших
расстояниях определяется выражением:
(1) где А* –
сложная константа Гамакера, h –
ширина зазора между частицами. Знак
минут указывает на взаимное притяжение
частиц. Вторая сила – ионно-электростатическое
отталкивание, возникающее за счет
перекрывания диффузных частей двойных
электрических слоев,
окружающих частицы. При перекрывании
двойных слоев для сближения частиц надо
совершить дополнительную работу по
концентрированию противоионов в тонкой
пленке раствора электролита в зазоре
между частицами. Энергия электростатического
отталкивания на достаточно больших
расстояниях определяется выражением:
![]() (2) где n0 –
концентрация электролита, k –
постоянная Больцмана, Т –
температура, æ –
обратная эффективная толщина ионной
атмосферы, γ= th(zeφ0/4kT) (ze –
заряд ионов, φ0 –
потенциал поверхности).
(2) где n0 –
концентрация электролита, k –
постоянная Больцмана, Т –
температура, æ –
обратная эффективная толщина ионной
атмосферы, γ= th(zeφ0/4kT) (ze –
заряд ионов, φ0 –
потенциал поверхности).
Полная энергия взаимодействия дисперсных частиц U представляет сумму энергий притяжения и отталкивания(мол=молекулярная, эл=электростатическая) U=Umol +Uel(рис.1). Поскольку энергии притяжения и отталкивания имеют разные знаки и по-разному зависят от толщины разделяющей частицы жидкой пленки, зависимость суммарной энергии U(h) имеет сложный вид с минимумом на больших расстояниях и максимумом на средних. Кроме того, существует первичный, или ближний, минимум (обозначенный пунктиром на рис.1), связанный с возникновением на малых расстояниях сил отталкивания, не учтенных в теории ДЛФО. Вид зависимости U(h)показывает, что притяжение преобладает на больших и малых расстояниях, а на средних существует потенциальный барьер, препятствующий сближению частиц. Чем выше высота барьера, тем больше агрегативная устойчивость коллоиднойсистемы.

←Рис.1. Зависимость энергии взаимодействия от расстояния между частицами
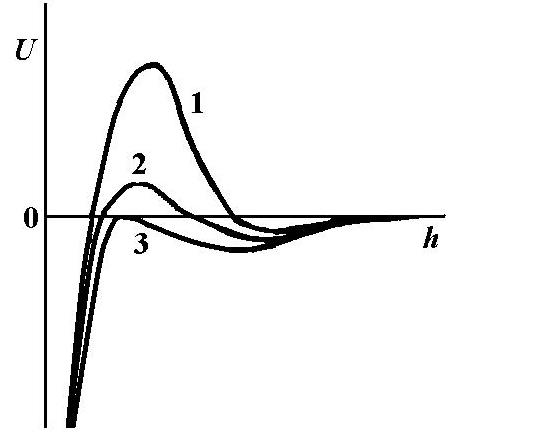 ←Рис.2.
Зависимость взаимодействия в пленке
от концентрации электролита
←Рис.2.
Зависимость взаимодействия в пленке
от концентрации электролита
Добавки электролита прежде всего влияют на электростатические силы отталкивания. При добавлении электролита происходит уменьшение толщины диффузного ионного слоя; на суммарной зависимости U(h) уменьшается величина потенциального барьера и происходит сдвиг положения максимума в сторону меньших толщин (кривая 2 на рис.2). При определенной концентрации электролита барьер полностью исчезает, что соответствует полной потере системой агрегативной устойчивости (кривая 3 рис.2). Происходит коагуляция.
Концентрация
электролита, при которой исчезает барьер
(U(h)=0)
соответствует порогу коагуляции nc и
определяется выражением: ![]() (3), где k1≈2∙105 -
безразмерный коэффициент, ε –
диэлектрическая протицаемость среды, ε0 –
диэлектрическая постоянная.
(3), где k1≈2∙105 -
безразмерный коэффициент, ε –
диэлектрическая протицаемость среды, ε0 –
диэлектрическая постоянная.
Различают случаи сильно- и слабозаряженных поверхностей. Энергия притяжения противоионов к сильнозаряженным поверхностям существенно превышает энергию теплового движения (zeφ0>>4kT) , γ→1 и nc ~ 1/(ze)6. Это соотношение дает теоретическое обоснование полученному ранее экспериментально правилу Шульца-Гарди о влиянии заряда противоиона, вызывающего коагуляцию, на порог коагуляции. Для слабозаряженных поверхностей (zeφ0<<4kT) γ→ (zeφ0/4kT) и nc ~ 1/(ze)2.
Теория ДЛФО объяснила главные закономерности коагуляции гидрозолей электролитами и объединила на общей количественной основе имеющиеся ранее представления, относящиеся к различным частным случаям.
