
- •Билет № 1
- •Принципы классификации дисперсных систем
- •Потенциал и ток течения
- •Поверхностно-активные вещества и их классификация
- •Билет № 2
- •Молекулярно-кинетические свойства дисперсных систем
- •Электрофорез
- •Адсорбционный потенциал
- •Билет № 3
- •Билет 3. Седиментация суспензий и седиментационно-диффузионное равновесие
- •Электроосмос
- •Теория быстрой коагуляции Смолуховского
- •1. Оптические свойства дисперсных систем
- •2. Зависимость ψ1-потенциала от концентрации электролита
- •3. Правило уравнивания полярностей Ребиндера
- •Билет № 5
- •Билет № 6
- •Строение двойного электрического слоя (дэс) на границе раздела твердое тело – жидкость. Потенциалы дэс.
- •Защитное действие растворов высокомолекулярных соединений
- •Билет № 7
- •Билет 7. Химический потенциал и давление пара у искривленных поверхностей
- •Механизмы образования двойного электрического слоя на поверхности твердых тел
- •Влияние многозарядных ионов на устойчивость гидрофобных коллоидов
- •Билет № 8
- •Уравнение адсорбции Гиббса
- •Числа переноса ионов в капиллярных системах
- •Электрокинетический потенциал и его роль в устойчивости гидрофобных коллоидов
- •Билет 9. Изотерма адсорбции Ленгмюра (адсорбция на границе раздела раствор - газ)
- •Основные положения теории двойного электрического слоя Гуи-Чепмена, модифицированной теории Гуи, теории Штерна.
- •Лиофильные коллоидные системы
- •Билет № 10
- •Поверхностные пленки нерастворимых веществ
- •Индифферентные и специфически сорбирующиеся электролиты. Влияние на устойчивость гидрофобных коллоидов
- •3. Поверхностная проводимость
- •Билет № 11
- •Адсорбция на поверхности твердых тел. Теплоты адсорбции и смачивания
- •Методы определения размеров частиц
- •Приведенная толщина диффузного слоя; зависимость от вида электролита
- •Билет № 12
- •Теория адсорбции Ленгмюра (граница раздела твердое тело – газ или пар)
- •Электрокинетический потенциал; влияние концентрации электролита и заряда противоиона
- •Поверхностное натяжение и способы его определения
- •Билет № 13
- •Теория адсорбции Поляни
- •Коллоидно-химические основы охраны окружающей среды
- •Электрокинетический потенциал
- •Билет № 14
- •Теория адсорбции Брунауэра – Эммета – Теллера
- •Высокомолекулярные электролиты
- •Правило уравнивания полярностей Ребиндера
- •Билет № 15
- •Адсорбция неэлектролитов на границе раздела твердое тело – жидкость (молекулярная адсорбция)
- •Мицеллообразование в водных и неводных средах.
- •Изоэлектрическая точка и точка нулевого заряда
- •Билет № 16
- •Адсорбция электролитов на границе раздела твердое тело – жидкость и возникновение двойного электрического слоя
- •Структурно-механические свойства дисперсных систем
- •Защитное действие растворов высокомолекулярных соединений
- •Билет № 17
- •Электрокапиллярные явления
- •Влияние электролитов на устойчивость гидрофобных коллоидов. Роль -потенциала
- •Поверхностная активность
- •Билет № 18
- •Теория двойного электрического слоя Гуи – Чепмена
- •Электродиализ
- •Флотация
- •Билет № 19
- •Теория двойного электрического слоя Штерна
- •Работа адсорбции. Правило Траубе
- •Основные факторы устойчивости гидрофобных коллоидов
- •Билет № 20
- •Параметры дэс и их зависимость от концентрации электролита
- •Электроосмос
- •Устойчивость лиофильных и лиофобных коллоидных систем
- •Билет № 21
- •Билет 21. Электрокинетические явления
- •Капиллярная конденсация
- •Адсорбционный потенциал
- •Билет № 22
- •Потенциал и ток течения
- •Теплоты физической адсорбции и смачивания
- •Поверхностное и пограничное натяжение
- •Билет № 23
- •Электрокинетический потенциал. Влияние концентрации электролита и вида противоиона
- •Уравнение состояния поверхностного слоя разбавленных растворов
- •Критическая концентрация мицеллообразования (ккм)
- •Билет № 24
- •Потенциалы двойного электрического слоя. Зависимость от концентрации электролита
- •Работа адсорбции. Правило Траубе
- •Пептизация
- •Билет № 25
- •Электрокинетические свойства капиллярных систем
- •Поверхностно-активные и поверхностно-инактивные вещества
- •Изоэлектрическая точка и точка нулевого заряда
- •Билет № 26
- •Билет 26. Методы получение и очистки дисперсных систем
- •Изменение уровня жидкости в капиллярах
- •Правило Шульце - Гарди
- •Билет № 27
- •Теория быстрой коагуляции Смолуховского
- •Критическое сопоставление теорий адсорбции газов и паров твердыми телами
- •Числа переноса ионов в капиллярных системах
- •Билет № 28
- •Поверхностное натяжение жидкостей
- •Теория устойчивости гидрофобных коллоидов Дерягина – Ландау – Фервея – Овербека
- •3. Правило уравнивания полярностей Ребиндера
- •Билет № 29
- •Специфика коллоидного состояния вещества
- •Коагулирующее действие электролитов
- •Капиллярное давление
Работа адсорбции. Правило Траубе



ПРАВИЛО ТРАУБЕ - в гомологическом ряду ПАВ поверхностная активность вещества увеличивается в 3-3,5 раза при удлинении углеводородной цепи на одно звено (группу-CH2-).
Основные факторы устойчивости гидрофобных коллоидов
Гидрофобные коллоиды ( глина, гидраты окиси железа и алюминия, силиций, обезволенный уголь и др.) осаждаются в виде порошков или хлопьев и отличаются неспособностью дисперсных частиц связывать молекулы воды, служащей дисперсной средой. Устойчивость гидрофобных коллоидов зависит главным образом от их электрокинетического потенциала, и коагуляция является результатом сжатия двойного слоя ионов и, следовательно, уменьшения электрокинетического потенциала. Так как ионы подвергаются, с одной стороны, влиянию броуновского движения и десорбируются с поверхности коллоидных частиц, а с другой - притягиваются к поверхности кулоновскими силами, то равновесное распределение ионов характеризуется некоторым средним расстоянием менаду ними и коллоидными частицами.
Неустойчивые золи гидрофобных коллоидов, которые легко коагулируют, можно сделать очень устойчивыми по отношению к воздействию электролитов, добавляя к ним небольшие количества какого-либо гидрофильного коллоида, например желатина, гуммиарабика, гуминовых веществ и др.
Такое «защитное» действие оказывают гидрофильные коллоиды и на суспензии, частицы которых в их присутствии осаждаются чрезвычайно медленно.
В природе роль защитных коллоидов играют гуминовые вещества, чаще всего по отношению к гидроокисям железа и алюминия.
Минимальное количество гидрофильного вещества, вызывающее устойчивость гидрофобных коллоидов, называется по защищаемому коллоиду «золотым числом», «серебряным числом», «рубиновым числом» и т.
Такое же защитное действие на гидрофобные коллоиды оказывают поверхностно-активные вещества (ПАВ), но в этом случае большое значение имеет характер ориентации ПАВ в адсорбционном слое.
Р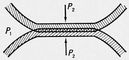 асклинивающее
давление, термодинамический
параметр, характеризующий состояние
тонкого слоя (плёнки) жидкости или газа
в промежутке между поверхностями тел.
В условиях равновесия системы Расклинивающее
давление П
= P2 — P1,
где P2 — нормальное
давление на плёнку со стороны разделённых
ею тел, a P1 — давление
в объёме жидкости (газа), из которой
образовалась плёнка (см. рис.).
Если Расклинивающее
давление имеет
положительное значение (П > 0), то плёнка
устойчива, если отрицательное (П < 0),
— плёнка самопроизвольно утончается
вплоть до прорыва. Расклинивающее
давление впервые
обнаружено советскими учёными Б.
В. Дерягиным и
Е. В. Обуховым (1934). Оно возникает при
взаимном перекрытии 2 поверхностных
слоев и
обусловлено совокупным действием сил
различной природы. Так,
составляющимиРасклинивающее
давление могут
быть электростатические силы, силы
«упругого» сопротивления сольватных
(или адсорбционно-сольватных) слоев,
силы межмолекулярного
взаимодействия. Расклинивающее
давление зависит
от толщины плёнки, состава и свойств
взаимодействующих фаз (тел) и температуры.
Учение о Расклинивающее
давление положено
в основу теории устойчивости гидрофобных
коллоидов Дерягина — Ландау — Фервея
— Овербека (сокращённо — теория ДЛФО),
объясняет многие поверхностные
явления. Преодоление
положительногоРасклинивающее
давление,
препятствующего утончению плёнки под
действием внешних сил, приводит к
слипанию или слиянию соприкасающихся
тел. В случае коллоидных систем это
означает коагуляцию или коалесценцию частиц
дисперсной фазы. Расклинивающее
давление оказывает
решающее влияние на эффективность таких
важных в практическом отношении
процессов, как набухание и пептизацияглинистых
минералов, стабилизация пен, флотация,
пропитка, склеивание.
асклинивающее
давление, термодинамический
параметр, характеризующий состояние
тонкого слоя (плёнки) жидкости или газа
в промежутке между поверхностями тел.
В условиях равновесия системы Расклинивающее
давление П
= P2 — P1,
где P2 — нормальное
давление на плёнку со стороны разделённых
ею тел, a P1 — давление
в объёме жидкости (газа), из которой
образовалась плёнка (см. рис.).
Если Расклинивающее
давление имеет
положительное значение (П > 0), то плёнка
устойчива, если отрицательное (П < 0),
— плёнка самопроизвольно утончается
вплоть до прорыва. Расклинивающее
давление впервые
обнаружено советскими учёными Б.
В. Дерягиным и
Е. В. Обуховым (1934). Оно возникает при
взаимном перекрытии 2 поверхностных
слоев и
обусловлено совокупным действием сил
различной природы. Так,
составляющимиРасклинивающее
давление могут
быть электростатические силы, силы
«упругого» сопротивления сольватных
(или адсорбционно-сольватных) слоев,
силы межмолекулярного
взаимодействия. Расклинивающее
давление зависит
от толщины плёнки, состава и свойств
взаимодействующих фаз (тел) и температуры.
Учение о Расклинивающее
давление положено
в основу теории устойчивости гидрофобных
коллоидов Дерягина — Ландау — Фервея
— Овербека (сокращённо — теория ДЛФО),
объясняет многие поверхностные
явления. Преодоление
положительногоРасклинивающее
давление,
препятствующего утончению плёнки под
действием внешних сил, приводит к
слипанию или слиянию соприкасающихся
тел. В случае коллоидных систем это
означает коагуляцию или коалесценцию частиц
дисперсной фазы. Расклинивающее
давление оказывает
решающее влияние на эффективность таких
важных в практическом отношении
процессов, как набухание и пептизацияглинистых
минералов, стабилизация пен, флотация,
пропитка, склеивание.
Теория рассматривает конкуренцию Вар-дер-Ваальсовских сил притяжения и электростатических сил отталкивания, действующих между частицами. В агрегативно устойчивых ко лло идных системах силы отталкивания преобладают над силами притяжения.
Под агрегативной устойчивостью лиофобной системы понимают её способность противостоять процессам, приводящим к изменению размеров частиц дисперсной фазы в результате их слияния (коалесценция), переноса вещества между ними (изотермическая перегонка) или объединения в более или менее рыхлые агрегаты (коагуляция). Устойчивость системы характеризуется временем ее жизни в практически неизменном состоянии. В зависимости от соотношения скоростей трех основных процессов - коагуляции, коалесценции, изотермической перегонки - разрушение системы может приводить к возникновению новых различных по строению и свойствам систем, в том числе к получению материалов с ценными механическими свойствами. Устойчивость лиофобных дисперсных систем может иметь как термодинамическую, так и кинетическую природу.
В настоящее время выделяют следующие факторы устойчивости: 1. Электростатическое отталкивание диффузных частей двойных электрических слоев (ионно-электростатическая составляющая расклинивающего давления). 2. Лиофилизация поверхности за счет адсобции ПАВ. 3. Эффективная упругость пленок с адсорбционными слоями ПАВ (эффекты Гиббса и Марангони-Гиббса). 4. Вязкое сопротивление прослойки среды, препятствующее ее утоньшению. 5. Структурно-механический барьер по Ребиндеру. Особенности устойчивости и разрушения конкретных дисперсных систем (механизм разрушения и относительная роль различных факторов стабилизации) связаны, прежде всего, с фазовым состоянием дисперсной фазы и дисперсионной среды.
Различают два вида устойчивость дисперсных систем: седиментационную и агрегативную.
Седиментационная (кинетическая) устойчивость – это способность системы противостоять осаждению частиц дисперсной фазы под действием силы тяжести (седиментация). Она находится в зависимости от размеров частиц в системе, осаждению которой противодействуют силы диффузии. Высокодисперсные системы устойчивы к седиментации, в то время как грубодисперсные системы седиментационно не устойчивы.
Агрегативная устойчивость это способность системы противостоять слипанию частиц дисперсной фазы. Агрегативная устойчивость обусловлена термодинамическими и кинетическими факторами. Термодинамические факторы связаны с величиной удельной поверхностной энергии σ (поверхностное натяжение (δ) и энтропией в системе, а кинетические влияют на скорость столкновения частиц и зависит от вязкости и плотности дисперсионной среды. Оба вида устойчивости (агрегативная и седиментационная) определяют срок хранения и качество многих пищевых продуктов, медицинских препаратов и т.д.
Все дисперсные системы делятся на лиофильные и лиофобные. Лиофильные системы обладают агрегативной устойчивостью, а лиофобные неустойчивы к агрегации в независимости от степени дисперсности. Они обладают огромной свободной поверхностной энергией и стремятся ее само- произвольно изменить поверхность раздела фаз путем слипания частиц.
Различают следующие факторы стабилизации или устойчивости дисперсных систем:
электростатический (термодинамический), связаны с образованием двойного электрического слоя (ДЭС) на поверхности частиц. ДЭС приводит не только к появлению зарядов но и понижению поверхностной энергии (поверхностного натяжения) на границе раздела;
адсорбционно – сольватационный (термодинамический), состоящий в снижении поверхностной энергии при адсорбции стабилизатора и молекул дисперсной среды на поверхности частиц;
энтропийный (термодинамический), проявляющийся в стремлении системы к равномерному распределению частиц по объему;
структурно – механический (термодинамический и кинетический), заключающийся в образовании слоев ПАВ и ВМС на поверхности частиц. Благодаря переплетению молекул ПАВ на поверхности частиц, образуются высоковязкая стабилизирующая прослойка, которая препятствует слипанию частиц.
Стабилизация реальных дисперсных систем обеспечивается, как правило, действием нескольких факторов одновременно. Каждому фактору стабилизации подбирают метод его стабилизации. Например, электростатический фактор чувствителен к введению электролитов.
