
- •Билет № 1
- •Принципы классификации дисперсных систем
- •Потенциал и ток течения
- •Поверхностно-активные вещества и их классификация
- •Билет № 2
- •Молекулярно-кинетические свойства дисперсных систем
- •Электрофорез
- •Адсорбционный потенциал
- •Билет № 3
- •Билет 3. Седиментация суспензий и седиментационно-диффузионное равновесие
- •Электроосмос
- •Теория быстрой коагуляции Смолуховского
- •1. Оптические свойства дисперсных систем
- •2. Зависимость ψ1-потенциала от концентрации электролита
- •3. Правило уравнивания полярностей Ребиндера
- •Билет № 5
- •Билет № 6
- •Строение двойного электрического слоя (дэс) на границе раздела твердое тело – жидкость. Потенциалы дэс.
- •Защитное действие растворов высокомолекулярных соединений
- •Билет № 7
- •Билет 7. Химический потенциал и давление пара у искривленных поверхностей
- •Механизмы образования двойного электрического слоя на поверхности твердых тел
- •Влияние многозарядных ионов на устойчивость гидрофобных коллоидов
- •Билет № 8
- •Уравнение адсорбции Гиббса
- •Числа переноса ионов в капиллярных системах
- •Электрокинетический потенциал и его роль в устойчивости гидрофобных коллоидов
- •Билет 9. Изотерма адсорбции Ленгмюра (адсорбция на границе раздела раствор - газ)
- •Основные положения теории двойного электрического слоя Гуи-Чепмена, модифицированной теории Гуи, теории Штерна.
- •Лиофильные коллоидные системы
- •Билет № 10
- •Поверхностные пленки нерастворимых веществ
- •Индифферентные и специфически сорбирующиеся электролиты. Влияние на устойчивость гидрофобных коллоидов
- •3. Поверхностная проводимость
- •Билет № 11
- •Адсорбция на поверхности твердых тел. Теплоты адсорбции и смачивания
- •Методы определения размеров частиц
- •Приведенная толщина диффузного слоя; зависимость от вида электролита
- •Билет № 12
- •Теория адсорбции Ленгмюра (граница раздела твердое тело – газ или пар)
- •Электрокинетический потенциал; влияние концентрации электролита и заряда противоиона
- •Поверхностное натяжение и способы его определения
- •Билет № 13
- •Теория адсорбции Поляни
- •Коллоидно-химические основы охраны окружающей среды
- •Электрокинетический потенциал
- •Билет № 14
- •Теория адсорбции Брунауэра – Эммета – Теллера
- •Высокомолекулярные электролиты
- •Правило уравнивания полярностей Ребиндера
- •Билет № 15
- •Адсорбция неэлектролитов на границе раздела твердое тело – жидкость (молекулярная адсорбция)
- •Мицеллообразование в водных и неводных средах.
- •Изоэлектрическая точка и точка нулевого заряда
- •Билет № 16
- •Адсорбция электролитов на границе раздела твердое тело – жидкость и возникновение двойного электрического слоя
- •Структурно-механические свойства дисперсных систем
- •Защитное действие растворов высокомолекулярных соединений
- •Билет № 17
- •Электрокапиллярные явления
- •Влияние электролитов на устойчивость гидрофобных коллоидов. Роль -потенциала
- •Поверхностная активность
- •Билет № 18
- •Теория двойного электрического слоя Гуи – Чепмена
- •Электродиализ
- •Флотация
- •Билет № 19
- •Теория двойного электрического слоя Штерна
- •Работа адсорбции. Правило Траубе
- •Основные факторы устойчивости гидрофобных коллоидов
- •Билет № 20
- •Параметры дэс и их зависимость от концентрации электролита
- •Электроосмос
- •Устойчивость лиофильных и лиофобных коллоидных систем
- •Билет № 21
- •Билет 21. Электрокинетические явления
- •Капиллярная конденсация
- •Адсорбционный потенциал
- •Билет № 22
- •Потенциал и ток течения
- •Теплоты физической адсорбции и смачивания
- •Поверхностное и пограничное натяжение
- •Билет № 23
- •Электрокинетический потенциал. Влияние концентрации электролита и вида противоиона
- •Уравнение состояния поверхностного слоя разбавленных растворов
- •Критическая концентрация мицеллообразования (ккм)
- •Билет № 24
- •Потенциалы двойного электрического слоя. Зависимость от концентрации электролита
- •Работа адсорбции. Правило Траубе
- •Пептизация
- •Билет № 25
- •Электрокинетические свойства капиллярных систем
- •Поверхностно-активные и поверхностно-инактивные вещества
- •Изоэлектрическая точка и точка нулевого заряда
- •Билет № 26
- •Билет 26. Методы получение и очистки дисперсных систем
- •Изменение уровня жидкости в капиллярах
- •Правило Шульце - Гарди
- •Билет № 27
- •Теория быстрой коагуляции Смолуховского
- •Критическое сопоставление теорий адсорбции газов и паров твердыми телами
- •Числа переноса ионов в капиллярных системах
- •Билет № 28
- •Поверхностное натяжение жидкостей
- •Теория устойчивости гидрофобных коллоидов Дерягина – Ландау – Фервея – Овербека
- •3. Правило уравнивания полярностей Ребиндера
- •Билет № 29
- •Специфика коллоидного состояния вещества
- •Коагулирующее действие электролитов
- •Капиллярное давление
Капиллярное давление
Капиллярным давлением (p0, Па) (англ. capillary pressure) называют разность давлений (±Δp), возникающую вследствие искривления поверхности жидкости.
Капиллярное давление. Т.
к. силы поверхностного (межфазного)
натяжения направлены по касательной к
пов-сти жидкости,
искривление последней ведет к появлению
составляющей, направленной внутрь
объема жидкости.
В результате возникает капиллярное давление,
величина к-рого Dp
связана со средним радиусом кривизны
пов-сти r0 ур-нием
Лапласа: Dp
= p1 - p2 =
2s12/r0, (1) где
p1 и
p2 - давления в жидкости 1
и соседней фазе 2 (газе или жидкости), s12 -
поверхностное (межфазное) натяжение.
Если пов-сть жидкостивогнута
(r0<0), давление в
ней оказывается пониженным по сравнению
с давлением в
соседней фазе p1 <
р2 и Dp
< 0. Для выпуклых пов-стей (r0 >
0) знак Dp
изменяется на обратный. Отрицат.
капиллярное давление,
возникающее в случае смачивания жидкостью стенок
капилляра, приводит к тому, что жидкость будет
всасываться в капилляр до тех пор,
пока вес столба жидкости высотой
h не уравновесит перепад давления Dp.
В состоянииравновесия высота
капиллярного поднятия определяется
ф-лой Жюрена:
![]() где r1 и r2 -
плотности жидкости 1
и среды 2, g - ускорение силы тяжести, r -
радиус капилляра, q -
краевой угол смачивания.
Для несмачивающих стенки
капилляра жидкостей cos q <
0, что приводит к опусканию жидкости в
капилляре ниже уровня плоской пов-сти
(h < 0). Из
выражения (2) следует определение
капиллярной постоянной жидкости а
= [2s12/(r1 — r2)g]1/2.
Она имеет размерность длины и характеризует
линейный размер Z[ а,
при к-ром становятся существенными
капиллярные явления. Так, для воды при
20 °С а = 0,38 см. При слабой гравитации
(g : 0)
значение а возрастает. На участке
контакта частиц капиллярная
конденсация приводит
к стягиванию частиц под действием
пониж. давления Dp
< 0.
где r1 и r2 -
плотности жидкости 1
и среды 2, g - ускорение силы тяжести, r -
радиус капилляра, q -
краевой угол смачивания.
Для несмачивающих стенки
капилляра жидкостей cos q <
0, что приводит к опусканию жидкости в
капилляре ниже уровня плоской пов-сти
(h < 0). Из
выражения (2) следует определение
капиллярной постоянной жидкости а
= [2s12/(r1 — r2)g]1/2.
Она имеет размерность длины и характеризует
линейный размер Z[ а,
при к-ром становятся существенными
капиллярные явления. Так, для воды при
20 °С а = 0,38 см. При слабой гравитации
(g : 0)
значение а возрастает. На участке
контакта частиц капиллярная
конденсация приводит
к стягиванию частиц под действием
пониж. давления Dp
< 0.
Уравнение
Кельвина. Искривление
пов-сти жидкости приводит
к изменению над ней равновесного давления пара р
по сравнению с давлениемнасыщ. пара ps над
плоской пов-стью при той же т-ре Т. Эти
изменения описываются ур-нием
Кельвина: ![]() где
где ![]() -
молярный объем жидкости,
R - газовая
постоянная.
Понижение или повышение давления пара зависит
от знака кривизны пов-сти: над выпуклыми
пов-стями (r0 >
0) p > ps; над вогнутыми (r0 <
0) р < рs. Так, над каплями давление пара повышено;
в пузырьках, наоборот, понижено. Наосновании ур-ния
Кельвина рассчитывают заполнение
капилляров или пористых тел при капиллярной
конденсации.
Т. к. значения р различны для частиц
разных размеров или для участков пов-сти,
имеющей впадины и выступы, ур-ние (3)
определяет и направление переноса в-ва
в процессе перехода системы к
состоянию равновесия.
Это приводит, в частности, к тому, что
относительно крупные капли или частицы
растут за счетиспарения (растворения)
более мелких, а неровности пов-сти
некристаллич. тела сглаживаются за
счет растворения выступов
и залечивания впадин. Заметные
различия давления пара и
р-римости имеют место лишь при достаточно
малых r0 (для воды,
напр., при r0 [ 0,1
мкм). Поэтому ур-ние Кельвина часто
используется для характеристики
состояния коллоидных
систем и
пористых тел и процессов в них.
-
молярный объем жидкости,
R - газовая
постоянная.
Понижение или повышение давления пара зависит
от знака кривизны пов-сти: над выпуклыми
пов-стями (r0 >
0) p > ps; над вогнутыми (r0 <
0) р < рs. Так, над каплями давление пара повышено;
в пузырьках, наоборот, понижено. Наосновании ур-ния
Кельвина рассчитывают заполнение
капилляров или пористых тел при капиллярной
конденсации.
Т. к. значения р различны для частиц
разных размеров или для участков пов-сти,
имеющей впадины и выступы, ур-ние (3)
определяет и направление переноса в-ва
в процессе перехода системы к
состоянию равновесия.
Это приводит, в частности, к тому, что
относительно крупные капли или частицы
растут за счетиспарения (растворения)
более мелких, а неровности пов-сти
некристаллич. тела сглаживаются за
счет растворения выступов
и залечивания впадин. Заметные
различия давления пара и
р-римости имеют место лишь при достаточно
малых r0 (для воды,
напр., при r0 [ 0,1
мкм). Поэтому ур-ние Кельвина часто
используется для характеристики
состояния коллоидных
систем и
пористых тел и процессов в них.
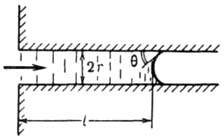 Рис.
2. Перемещение жидкости на
длину l в капилляре радиуса r; Ξ
- краевой
угол.
Рис.
2. Перемещение жидкости на
длину l в капилляре радиуса r; Ξ
- краевой
угол.
