
- •Билет № 1
- •Принципы классификации дисперсных систем
- •Потенциал и ток течения
- •Поверхностно-активные вещества и их классификация
- •Билет № 2
- •Молекулярно-кинетические свойства дисперсных систем
- •Электрофорез
- •Адсорбционный потенциал
- •Билет № 3
- •Билет 3. Седиментация суспензий и седиментационно-диффузионное равновесие
- •Электроосмос
- •Теория быстрой коагуляции Смолуховского
- •1. Оптические свойства дисперсных систем
- •2. Зависимость ψ1-потенциала от концентрации электролита
- •3. Правило уравнивания полярностей Ребиндера
- •Билет № 5
- •Билет № 6
- •Строение двойного электрического слоя (дэс) на границе раздела твердое тело – жидкость. Потенциалы дэс.
- •Защитное действие растворов высокомолекулярных соединений
- •Билет № 7
- •Билет 7. Химический потенциал и давление пара у искривленных поверхностей
- •Механизмы образования двойного электрического слоя на поверхности твердых тел
- •Влияние многозарядных ионов на устойчивость гидрофобных коллоидов
- •Билет № 8
- •Уравнение адсорбции Гиббса
- •Числа переноса ионов в капиллярных системах
- •Электрокинетический потенциал и его роль в устойчивости гидрофобных коллоидов
- •Билет 9. Изотерма адсорбции Ленгмюра (адсорбция на границе раздела раствор - газ)
- •Основные положения теории двойного электрического слоя Гуи-Чепмена, модифицированной теории Гуи, теории Штерна.
- •Лиофильные коллоидные системы
- •Билет № 10
- •Поверхностные пленки нерастворимых веществ
- •Индифферентные и специфически сорбирующиеся электролиты. Влияние на устойчивость гидрофобных коллоидов
- •3. Поверхностная проводимость
- •Билет № 11
- •Адсорбция на поверхности твердых тел. Теплоты адсорбции и смачивания
- •Методы определения размеров частиц
- •Приведенная толщина диффузного слоя; зависимость от вида электролита
- •Билет № 12
- •Теория адсорбции Ленгмюра (граница раздела твердое тело – газ или пар)
- •Электрокинетический потенциал; влияние концентрации электролита и заряда противоиона
- •Поверхностное натяжение и способы его определения
- •Билет № 13
- •Теория адсорбции Поляни
- •Коллоидно-химические основы охраны окружающей среды
- •Электрокинетический потенциал
- •Билет № 14
- •Теория адсорбции Брунауэра – Эммета – Теллера
- •Высокомолекулярные электролиты
- •Правило уравнивания полярностей Ребиндера
- •Билет № 15
- •Адсорбция неэлектролитов на границе раздела твердое тело – жидкость (молекулярная адсорбция)
- •Мицеллообразование в водных и неводных средах.
- •Изоэлектрическая точка и точка нулевого заряда
- •Билет № 16
- •Адсорбция электролитов на границе раздела твердое тело – жидкость и возникновение двойного электрического слоя
- •Структурно-механические свойства дисперсных систем
- •Защитное действие растворов высокомолекулярных соединений
- •Билет № 17
- •Электрокапиллярные явления
- •Влияние электролитов на устойчивость гидрофобных коллоидов. Роль -потенциала
- •Поверхностная активность
- •Билет № 18
- •Теория двойного электрического слоя Гуи – Чепмена
- •Электродиализ
- •Флотация
- •Билет № 19
- •Теория двойного электрического слоя Штерна
- •Работа адсорбции. Правило Траубе
- •Основные факторы устойчивости гидрофобных коллоидов
- •Билет № 20
- •Параметры дэс и их зависимость от концентрации электролита
- •Электроосмос
- •Устойчивость лиофильных и лиофобных коллоидных систем
- •Билет № 21
- •Билет 21. Электрокинетические явления
- •Капиллярная конденсация
- •Адсорбционный потенциал
- •Билет № 22
- •Потенциал и ток течения
- •Теплоты физической адсорбции и смачивания
- •Поверхностное и пограничное натяжение
- •Билет № 23
- •Электрокинетический потенциал. Влияние концентрации электролита и вида противоиона
- •Уравнение состояния поверхностного слоя разбавленных растворов
- •Критическая концентрация мицеллообразования (ккм)
- •Билет № 24
- •Потенциалы двойного электрического слоя. Зависимость от концентрации электролита
- •Работа адсорбции. Правило Траубе
- •Пептизация
- •Билет № 25
- •Электрокинетические свойства капиллярных систем
- •Поверхностно-активные и поверхностно-инактивные вещества
- •Изоэлектрическая точка и точка нулевого заряда
- •Билет № 26
- •Билет 26. Методы получение и очистки дисперсных систем
- •Изменение уровня жидкости в капиллярах
- •Правило Шульце - Гарди
- •Билет № 27
- •Теория быстрой коагуляции Смолуховского
- •Критическое сопоставление теорий адсорбции газов и паров твердыми телами
- •Числа переноса ионов в капиллярных системах
- •Билет № 28
- •Поверхностное натяжение жидкостей
- •Теория устойчивости гидрофобных коллоидов Дерягина – Ландау – Фервея – Овербека
- •3. Правило уравнивания полярностей Ребиндера
- •Билет № 29
- •Специфика коллоидного состояния вещества
- •Коагулирующее действие электролитов
- •Капиллярное давление
Билет № 18
Теория двойного электрического слоя Гуи – Чепмена
Распределение
противоионов диффузионной части двойного
ионного слоя зависит
от их природы, концентрации электролитов в растворе и
оттемпературы.
Предполагается, что это распределение
подчиняется закону распределения
Больцмана
![]() , (1.4.4)
где
, (1.4.4)
где ![]() – работа
перемещения 1 кг-экв. ионов с
бесконечно большого расстояния в точку
x двойного
ионного слоя;
jx–
потенциал в этой точке; Сi(x),
Сi(0)- концентрация ионов i
– того сорта на
расстоянии х от поверхности и
в растворе (кмоль/м3 );
zi–
заряд иона (с
учётом знака). Предполагается, что
объёмная плотность заряда в точке х
диффузного слоя rxописывается
уравнением
– работа
перемещения 1 кг-экв. ионов с
бесконечно большого расстояния в точку
x двойного
ионного слоя;
jx–
потенциал в этой точке; Сi(x),
Сi(0)- концентрация ионов i
– того сорта на
расстоянии х от поверхности и
в растворе (кмоль/м3 );
zi–
заряд иона (с
учётом знака). Предполагается, что
объёмная плотность заряда в точке х
диффузного слоя rxописывается
уравнением
![]() . (1.4.5)
В объеме раствора rx =
0 (условие электронейтральности).
. (1.4.5)
В объеме раствора rx =
0 (условие электронейтральности).
Для аналитического совместного решения уравнений (1.4.4) и (1.4.5) следует ввести предпосылки, сделанные Гуи и Чепменом :
1) двойной ионный слой является плоским, т.е. предполагается, что радиус кривизны поверхности твердого тела значительно больше толщины ионного слоя, т.е. r > 1/k, где k - параметр Дебая, равный обратной величине протяженности двойного ионного слоя;
2) диэлектрическая проницаемость растворителя в пределах ДИС считается постоянной, независимо от расстояния до поверхности;
3) предполагается, что для перевода ионов из раствора в точку хследует совершить работу лишь против сил электрического взаимодействия;
4) считается, что собственный объем ионов исчезающе мал, т.е. рассматриваются точечные заряды;
5) считается, что распределение ионов в пределах двойного ионного слоя подчиняется закону распределения Больцмана.
Удобным
для расчетов является случай симметричного
бинарного электролита,
для которого ![]() .
При этих условиях были получены уравнения
для поверхностей с потенциалом не более
50·10-3В
:
.
При этих условиях были получены уравнения
для поверхностей с потенциалом не более
50·10-3В
:
– для
плотности заряда на поверхности
![]() , (1.4.6)
, (1.4.6)
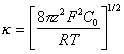 ,
(1.4.7) где j0 –
потенциал поверхности, k – параметра
Дебая, С0 – концентрация ионов в растворе;
,
(1.4.7) где j0 –
потенциал поверхности, k – параметра
Дебая, С0 – концентрация ионов в растворе;
– для зависимости потенциала от расстояния до поверхности
![]() . (1.4.8)
Величина 1/k эквивалентна понятию
«радиус ионной
атмосферы»,
введенному в теорию растворов сильных электролитов Дебаем
позднее создания теории Гуи-Чепмена.
. (1.4.8)
Величина 1/k эквивалентна понятию
«радиус ионной
атмосферы»,
введенному в теорию растворов сильных электролитов Дебаем
позднее создания теории Гуи-Чепмена.
Для
любых значений j0 и,
следовательно, j Овербек получил выражение
![]() (1.4.9)
где
(1.4.9)
где
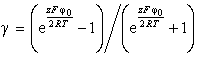 . (1.4.10)
Из уравнения (1.4.6) можно видеть, что
поверхностный заряд пропорционален
потенциалу поверхности.
. (1.4.10)
Из уравнения (1.4.6) можно видеть, что
поверхностный заряд пропорционален
потенциалу поверхности.
При
течении жидкости,
как известно, скорость течения ее вблизи
поверхности равна нулю и возрастает по
мере удаления от нее. Плоскость, которая
отделяет слой неподвижной жидкости вблизи
стенки от жидкости,
текущей по капилляру, и разделяет двойной
ионный слой на
две части, называется плоскостью
скольжения. Потенциал на этой плоскости
называют электрокинетическим, и
обозначают буквой z (дзета). Обычно
считается, что этот потенциал равен
электрическому потенциалу на расстоянии
D от поверхности твердой фазы, т.е. ![]() .
Хотя концентрация ионов в растворе не
влияет на потенциал поверхности, электрокинетический
потенциал снижается
пропорционально С1/2.
.
Хотя концентрация ионов в растворе не
влияет на потенциал поверхности, электрокинетический
потенциал снижается
пропорционально С1/2.
В
этом основное отличие электрокинетического
потенциала от
термодинамического. Причем z-потенциал
может изменяться в пределах от z =
j0 приконцентрации электролита в растворе ![]() до
до ![]() при
высоких значениях С0.
В соответствии с теорией во всех случаях
j0 и
z-потенциалы должны иметь один знак. Эти
рассуждения не справедливы для ионов,
отнесенных ранее к группе 1,
повышение концентрации которых
приводит к росту потенциала поверхности.
Кроме того, теория Гуи-Чепмена не может
объяснить наблюдающиеся на практике
случаи, когда электрокинетический
и термодинамический
потенциалы имеют
различный знак.
при
высоких значениях С0.
В соответствии с теорией во всех случаях
j0 и
z-потенциалы должны иметь один знак. Эти
рассуждения не справедливы для ионов,
отнесенных ранее к группе 1,
повышение концентрации которых
приводит к росту потенциала поверхности.
Кроме того, теория Гуи-Чепмена не может
объяснить наблюдающиеся на практике
случаи, когда электрокинетический
и термодинамический
потенциалы имеют
различный знак.
Можно отметить, что теория Гуи-Чепмена хорошо объясняет качественное различие между j0 и z-потенциалами, влияние на электрокинетический потенциал индифферентных (непотенциал- определяющих) ионов, но она не в состоянии объяснить, например, изменение знака z-потенциала при повышении концентрации некоторых электролитов и дает завышенное на порядок значение емкости двойного ионного слоя.
