
- •В.М. Васюков
- •Курс лекций
- •Часть I. Теоретическая химия
- •Глава 1. Основные понятия и законы химии
- •Основные понятия химии
- •Основные положения атомно-молекулярной теории
- •Газовые законы
- •Глава 2. Строение атома и периодический закон Модели строения атома
- •Квантовые числа электронов
- •Электронные конфигурации атомов
- •Ядро атома и радиоактивные превращения
- •Периодический закон
- •Глава 3. Химическая связь Валентность и степень окисления
- •Ковалентная связь
- •Ионная связь
- •Металлическая связь
- •Межмолекулярные взаимодействия
- •Глава 4. Комплексные соединения
- •Глава 5. Состояние вещества
- •Глава 6. Физико-химические закономерности протекания химических реакций Химическая термодинамика
- •Химическая кинетика и катализ
- •Обратимые и необратимые реакции. Состояние химического равновесия
- •Глава 7. Физико-химическая теория растворов электролитов и неэлектролитов Механизм образования растворов и их классификация
- •Идеальные и реальные растворы. Растворение как физико-химический процесс
- •Зависимость растворимости различных веществ от природы растворителя, температуры и давления
- •Законы разбавленных растворов
- •Способы выражения концентрации (состава) растворов
- •Электролиты и электролитическая диссоциация
- •Гидролиз солей
- •Глава 8. Дисперсные системы
- •Классификации дисперсных систем
- •Оптические и молекулярно-кинетические свойства дисперсных систем
- •Поверхностные и адсорбционные явления
- •Коллоидные (коллоидно-дисперсные) системы
- •Глава 9. Теория окислительно-восстановительных процессов Окислительно-восстановительные реакции
- •Химические источники электрической энергии. Электродные потенциалы
- •1) Металлы, обладающие более электроотрицательным потенциалом, способны вытеснить менее активные металлы (с более положительным потенциалом) из водных растворов их солей;
- •Коррозия металлов
- •Электролиз
- •Восстанавливается вода Восстанавливается вода и катионы металла Восстанавливается катионы металла
- •Глава 10. Качественный и количественный анализ веществ
- •Качественный анализ
- •Классификация катионов на аналитические группы
- •Классификация анионов на аналитические группы
- •Количественный анализ
- •Химические методы анализа
- •Физические и физико-химические методы анализа
- •Часть II. Неорганическая химия
- •Глава 11. Важнейшие классы неорганических соединений
- •Основания (гидроксиды металлов)
- •Кислоты
- •Глава 12. Элементы I группы
- •Водород
- •Глава 13. Элементы II группы
- •Бериллий
- •Глава 14. Элементы III группы
- •Алюминий
- •Лантаноиды
- •Актиноиды
- •Глава 15. Элементы IV группы
- •Углерод
- •Кремний
- •Глава 16. Элементы V группы
- •Глава 17. Элементы VI группы
- •Кислород
- •Глава 18. Элементы VII группы
- •Глава 19. Элементы VIII группы
- •Часть III. Органическая химия Глава 20. Общая характеристика органических соединений
- •Теория строения органических соединений
- •Атомы в молекулах соединены между собой в определенном порядке химическими связями согласно их валентности; углерод во всех органических соединениях четырехвалентен.
- •Свойства вещества определяются не только качественным составом, но и его строением, взаимным влиянием атомов, как связанных между собой химическими связями, так и непосредственно не связанных.
- •Строение молекул может быть установлено на основе изучения их химических свойств.
- •Формулы органических соединений
- •Классификация органических соединений
- •Номенклатура органических соединений
- •Изомерия органических соединений
- •Взаимное влияние атомов в молекуле и реакционная способность органических соединений
- •Общая характеристика органических реакций
- •Промышленное производство органических соединений
- •Глава 21. Алканы Номенклатура и изомерия
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Применение
- •Глава 22. Циклоалканы Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Глава 23. Алкены (олефины) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 24. Алкадиены (диеновые углеводороды) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 25. Алкины (ацетилены) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 26. Ароматические углеводороды (арены) Номенклатура и изомерия
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Правила ориентации (замещения) в бензольном кольце
- •Применение
- •Глава 27. Гидроксильные соединения (спирты)
- •Одноатомные спирты (алкоголи) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Многоатомные спирты
- •Получение
- •Химические свойства
- •Применение
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Применение
- •Глава 28. Карбонильные соединения (оксосоединения) Номенклатура и изомерия
- •Метаналь этаналь
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 29. Карбоновые кислоты Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 30. Сложные эфиры. Жиры Номенклатура и изомерия
- •Физические свойства
- •Химические свойства
- •Жиры и масла
- •Глава 31. Углеводы (сахара)
- •Моносахариды Номенклатура и изомерия
- •Физические и химические свойства глюкозы
- •Дисахариды
- •Полисахариды
- •Глава 32. Амины
- •Предельные алифатические амины Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Ароматические амины
- •Физические свойства
- •Химические свойства
- •Применение
- •Глава 33. Аминокислоты, пептиды и белки
- •Аминокислоты Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Пептиды
- •Физические свойства
- •Химические свойства
- •Биологическое значение белков
- •Глава 34. Гетероциклические соединения
- •Шестичленные гетероциклы
- •Пятичленные гетероциклы
- •Нуклеиновые кислоты Строение нуклеиновых кислот
- •Биологическая роль нуклеиновых кислот
- •Глава 35.Синтетические высокомолекулярные соединения
- •Общая характеристика полимеров
- •Пластмассы
- •Волокна
- •Каучуки
- •Литература
- •Приложения Растворимость неорганических веществ в воде при 25°c
Нуклеиновые кислоты Строение нуклеиновых кислот
Нуклеиновые кислоты – это природные высокомолекулярные соединения (полинуклеотиды), которые играют огромную роль в хранении и передаче наследственной информации в живых организмах. Молекулярная масса нуклеиновых кислот может меняться от 100 тыс. до 60 млрд. Они были открыты и выделены из клеточных ядер еще в XIX веке, однако их биологическая роль была выяснена только во второй половине XX века.
Строение нуклеиновых кислот можно установить, анализируя продукты их гидролиза. При полном гидролизе нуклеиновых кислот образуется смесь пиримидиновых и пуриновых оснований, моносахарид (β-рибоза или β-дезоксирибоза) и фосфорная кислота. Это означает, что нуклеиновые кислоты построены из фрагментов этих веществ.
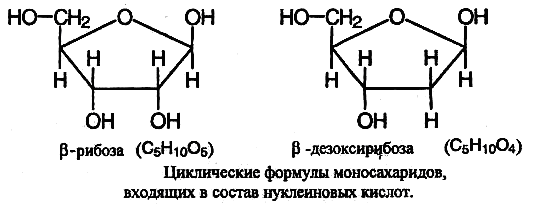
При частичном гидролизе нуклеиновых кислот образуется смесь нуклеотидов.
Нуклеотид – основная структурная единица нуклеиновых кислот, их мономерное звено, молекулы которых построены из остатков фосфорной кислоты, моносахарида (рибозы или дезоксирибозы) и азотистого основания (пуринового или пиримидинового). Остаток фосфорной кислоты связан с 3-м или 5-м атомом углерода моносахарида, а остаток основания – с первым атомом углерода моносахарида. Общие формулы нуклеотидов:
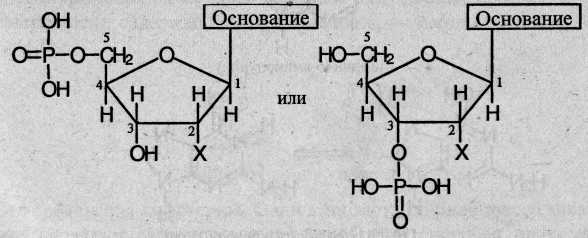
где X = ОН для рибонуклеотидов, построенных на основе рибозы, и X = Н для дезоксирибонуклеотидов, построенных на основе дезокскрибозы. В зависимости от типа азотистого основания, различают пуриновые и пиримидиновые нуклеотиды.
Нуклеиновые кислоты, состоящие из рибонуклеотидов, называют рибонуклеиновыми кислотами (РНК). Нуклеиновые кислоты, состоящие из дезоксирибонуклеотидов, называют дезоксирибонуклеиновыми кислотами (ДНК). В состав молекул ДНК входят нуклеотиды, содержащие аденин, гуанин, цитозин и тимин. В состав молекул РНК входят нуклеотиды, содержащие основания аденин, гуанин, цитозин и урацил (вместо тимина).
Для обозначения оснований используют однобуквенные сокращения: аденин – А, гуанин – G, тимин – Т, цитозин – С, урацил – U.
Свойства ДНК и РНК определяются последовательностью оснований в полинуклеотидной цепи и пространственным строением цепи. Последовательность оснований содержит генетическую информацию, а остатки моносахаридов и фосфорной кислоты играют структурную роль (носители оснований).
При частичном гидролизе нуклеотидов отщепляется остаток фосфорной кислоты, и образуются нуклеозиды, молекулы которых состоят из остатка пуринового или пиримидинового основания, связанного с остатком моносахарида – рибозы или дезоксирибозы Ниже приведены структурные формулы основных пуриновых и пиримидиновых нуклеозидов:
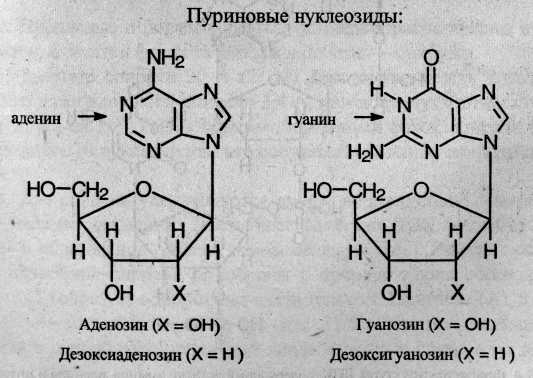
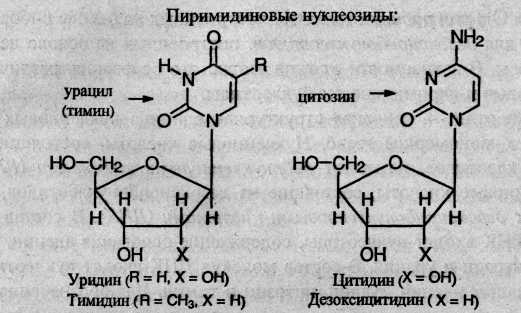
В молекулах ДНК и РНК отдельные нуклеотиды связаны в единую полимерную цепь за счет образования сложноэфирных связей между остатками фосфорной кислоты и гидроксильными группами при 3-м и 5-м атомах углерода моносахарида.

П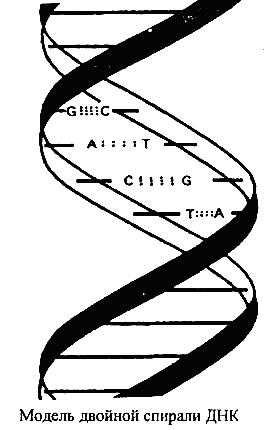 ространственная
структура полинуклеотидных цепей
ДНК и РНК была определена методом
рентгеноструктурного анализа. Одним
из самых крупных открытий биохимии XX
века оказалась модель трехмерной
структуры ДНК, которую предложили в
1953 г Дж. Уотсон и Ф. Крик. Эта модель
состоит в следующем.
ространственная
структура полинуклеотидных цепей
ДНК и РНК была определена методом
рентгеноструктурного анализа. Одним
из самых крупных открытий биохимии XX
века оказалась модель трехмерной
структуры ДНК, которую предложили в
1953 г Дж. Уотсон и Ф. Крик. Эта модель
состоит в следующем.
1. Молекула ДНК представляет собой двойную спираль и состоит из двух полинуклеотидных цепей, закрученных в противоположные стороны вокруг общей оси.
Пуриновые и пиримидиновые основания расположены внутри спирали, а остатки фосфата и дезоксирибозы – снаружи.
Диаметр спирали 20 Л (2 нм), расстояние между соседними основаниями вдоль оси спирали 3,4 А, они повернуты относительно друг друга на 36°. Таким образом, на полный виток спирали (360°) приходится 10 нуклеотидов, что соответствует длине спирали по оси 34 А.
Две спирали удерживаются вместе водородными связями между парами оснований. Важнейшее свойство ДНК – избирательность в образовании связей (комплементарность). Размеры оснований и двойной спирали подобраны в природе таким образом, что тимин (Т) образует водородные связи только с аденином (А), а цитозин (С) – только с гуанином (G). Обратите внимание на то, что в первой паре оснований две водородные связи, а во второй паре – три.
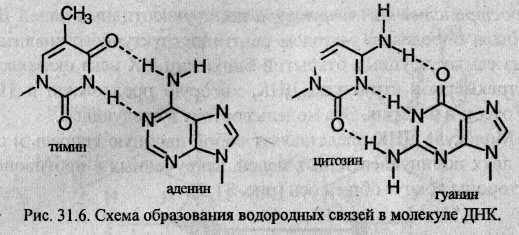
Схема образования водородных связей в молекуле ДНК
Таким образом, две спирали в молекуле ДНК комплементарны друг другу. Последовательность нуклеотидов в одной из спиралей однозначно определяет последовательность нуклеотидов в другой.
В каждой паре оснований, связанных водородными связями, одно из оснований – пуриновое, а другое – пиримидиновое. Отсюда следует, что общее число остатков пуриновых оснований в молекуле ДНК равно числу остатков пиримидиновых оснований.
Двухспиральная структура ДНК с комплементарными полинуклеотидными цепями обеспечивает возможность самоудвоения (репликации) этой молекулы. Этот сложный процесс можно упрощенно представить следующим образом.
Перед удвоением водородные связи разрываются, и две цепи раскручиваются и расходятся. Каждая цепь затем служит матрицей для образования на ней комплементарной цепи.
Таким образом, после репликации образуются две дочерние молекулы ДНК, в каждой из которых одна спираль взята из родительской ДНК, а другая (комплементарная) синтезирована заново. Синтез новых цепей происходит с участием фермета ДНК-полимеразы.
Длина полинуклеотидных цепей ДНК практически неограничена. Число пар оснований в двойной спирали может меняться от нескольких тысяч у простейших вирусов до сотен миллионов у человека. Каждой тысяче пар оснований соответствует длина оси спирали (называемая контурной длиной) 3400 А и молекулярная масса примерно 660 тыс.
В отличие от ДНК, молекулы РНК состоят из одной полинуклеотидной цепи. Число нуклеотидов в цепи колеблется от 75 до нескольких тысяч, а молекулярная масса РНК может изменяться в пределах от 25 тыс. до нескольких млн.
Полинуклеотидная цепь РНК не имеет строго определенной структуры. Она может складываться сама на себя и образовывать отдельные двухцепочечные участки с водородными связями между пуриновыми и пиримидиновыми основаниями.
Водородные связи в РНК не подчиняются таким строгим правилам, как в ДНК. Так, гуанин (G) может образовывать водородные связи как с урацилом (U), так и с цзатозином (С). Поэтому двухцепочечные участки РНК некомплементарны, и нуклеотидный состав РНК может меняться в широких пределах.
